
- •Предисловие
- •Неорганические лекарственные средства Алгоритм изучения неорганических лекарственных средств.
- •VII группа периодической системы д.И.Менделеева. Соединения галогенов.
- •Соединения галогенов с другими элементами находят большое применение в медицине.
- •Кислота хлористоводородная
- •Кислота хлористоводородная разведенная
- •Натрия хлорид
- •Калия хлорид
- •Натрия бромид
- •Калия бромид
- •Натрия йодид
- •Калия йодид
- •Йод и его спиртовые растворы
- •VI группа периодической системы д.И.Менделеева Соединения кислорода. Перекись водорода. Соединения серы. Натрия тиосульфат.
- •Вода очищенная
- •Перекись водорода
- •Раствор перекиси водорода
- •Натрия тиосульфат
- •IV и III группы Периодической системы д.И.Менделеева Соединения бора и углерода.
- •Кислота борная
- •Натрия тетраборат
- •Натрия гидрокарбонат
- •II и I группы периодической системы д.И.Менделеева. Соединения магния, кальция, цинка.
- •Магния сульфат
- •Кальция хлорид
- •Цинка сульфата
- •Соединения серебра.
- •Серебра нитрат
- •Колларгол
- •Протаргол
- •Органические лекарственные средства Алгоритм изучения органических лекарственных средств.
- •Ациклические и карбоциклические лекарственные средства Спирты
- •Спирт этиловый 95 %
- •Альдегиды и их производные
- •Раствор формальдегида
- •Гексаметилентетрамин
- •Углеводы (глициды)
- •Глюкоза
- •Простые эфиры
- •Димедрол
- •Карбоновые кислоты, аминокислоты и их производные
- •Кислота аскорбиновая
- •Натрия цитрат для инъекций
- •Натрия гидроцитрат (двузамещенный) для инъекций
- •Кальция глюконат
- •Кальция лактат
- •Аминокислоты
- •Кислота глютаминовая
- •Кислота аминокапроновая
- •Аминоспирты и их производные
- •Эфедрина гидрохлорид
- •Адреналина гидротартрат
- •Терпеноиды. Тепингидрат, ментол, валидол, бромкамфора. Роль современных ученых в разработке полусинтетического метода получения камфоры.
- •Валидол
- •Камфора
- •Бромкамфора
- •Терпингидрат
- •Ароматические соединения Фенолы
- •Резорцин
- •Ароматические кислоты
- •Кислота бензойная
- •Натрия бензоат
- •Кислота салициловая
- •Натрия салицилат
- •Кислота ацетилсалициловая
- •Фенилсалицилат
- •Ароматические аминокислоты и их производные
- •Анестезин
- •Бензокаин
- •Новокаин
- •Ацетаминопроизводные ароматического ряда
- •Парацетамол
- •Лидокаина гидрохлорид
- •Тримекаин
- •Сульфаниламидные препараты. Общая характеристика. Амиды сульфаниловой кислоты
- •Механизм антимикробного действия сульфаниламидов
- •Свойства сульфаниламидных препаратов
- •Методы количественного определения.
- •Стрептоцид
- •Стрептоцид растворимый
- •Сульфацил-натрий
- •Норсульфазол
- •Фталазол
- •Сульфадимезин
- •Гетероциклические соединения
- •Производные пиразола и фурана
- •Антипирин
- •Анальгин
- •Бутадион
- •Производные фурана
- •Фурацилин
- •Производные имидазола
- •Пилокарпина гидрохлорид
- •Производные бензимидазола
- •Дибазол
- •Производные пиридина
- •Пиридоксина гидрохлорид
- •Кислота никотиновая
- •Никотинамид
- •Производные пиримидина
- •Тиамина бромид (хлорид)
- •Производные пиперидина
- •Промедол
- •Производные тропана
- •Атропина сульфат
- •Производные хинолина
- •Хинина дигидрохлорид
- •Хинина гидрохлорид
- •Хинина сульфат
- •Производные изохинолина
- •Папаверина гидрохлорид
- •Производные барбитуровой кислоты
- •Барбитал
- •Барбитал - натрий
- •Фенобарбитал
- •Этаминал - натрий
- •Производные фенантренизохинолина
- •Морфина гидрохлорид
- •Кодеина фосфат
- •Этилморфина гидрохлорид
- •Производные пурина
- •Кофеин-бензоат натрия
- •Теобромин
- •Теофиллин
- •Эуфиллин
- •Производные изоаллоксозина
- •Рибофлавин
- •Антибиотики
- •Производные ароматического ряда
- •Левомицетин
- •Пенициллины (лактамиды)
- •Бензилпенициллина калиевая соль
- •Бензилпенициллина натриевая соль
- •Феноксиметилпенициллин
- •Полусинтетические пенициллины
- •Общая структура пенициллинов
- •Приложения Качественные реакции на катионы
- •Критерии оценки знаний по фармацевтической химии
- •Список литературы
Производные барбитуровой кислоты

пиримидин |
|
барбитуровая кислота |
Барбитуровая кислота представляет собой уреид - продукт конденсации мочевины с двухосновной малоновой кислотой.

мочевина |
малоновая кислота |
барбитуровая кислота |
Синтезировал барбитуровую кислоту польский ученый Фишер в день Святой Барбары. Сама барбитуровая кислота не применяется в медицине, однако ее производные - барбитураты - нашли широкое медицинское применение. Их снотворное действие впервые было обнаружено в начале XX века Фишером и Мерингом.

общая формула барбитуратов
Для производных барбитуровой кислоты характерна имидо-имидольная таутомерия.

имидная форма |
|
имидольная форма |
Получают барбитураты синтетически:
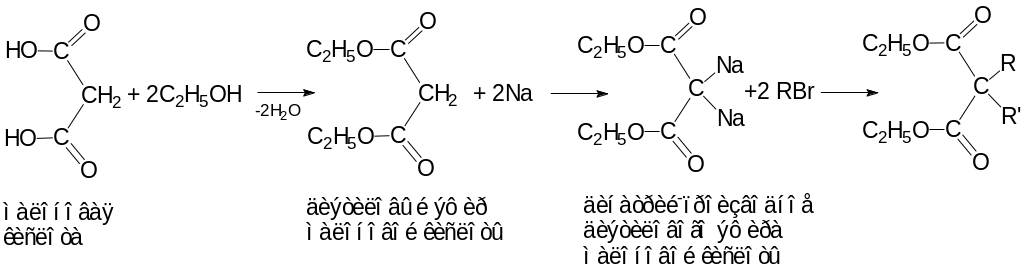

мочевина |
|
барбитурат (кислотная форма) |
Для получения натриевых солей барбитуровой кислоты препарат растворяют в щелочи

натриевая соль барбитуровой кислоты
Физические свойства.
Белые кристаллические порошки без запаха. Кислотные формы мало растворимы в воде, растворимы в щелочах, растворах карбонатов, в спирте и др. органических растворителях. Солевые формы легко растворимы в воде, не растворимы в органических растворителях, очень гигироскопичны.
Подлинность.
1. общая реакция, основанная на образовании комплексных солей барбитуратов с тяжелыми металлами.
0,05 препарата растворяют в 2 мл 96%-ного спирта, прибавляют 1 каплю раствора кальция хлорида, 2 капли раствора кобальта нитрата и 2 капли 1%-ного раствора едкого натра, появляется сине-фиолетовое окрашивание.
2. специфическая реакция, т.к. каждый барбитурат образует различные окрашивания. 0,1 препарата взбалтывают с 1 мл 1%-ного раствора едкого натра в течение 1 - 2 мин, прибавляют 0,2 мл раствора гидрокарбоната и карбоната калия, 0,1 мл раствора меди сульфата, появляется характерное окрашивание.
3. характерные реакции на ион натрия для солевых форм.
Количественное определение.
Кислотные формы
ГФ: Метод кислотно-основного титрования в неводных средах. Поскольку барбитураты являются слабыми кислотами, титрант - едкий натр в смеси с метанолом и бензолом, растворитель - диметилформамид, индикатор тимоловый синий.
Методика: точную навеску препарата растворяют в смеси диметилформамида и бензола, прибавляют индикатор тимоловый синий и титруют 0,1М NaOH в смеси метилового спирта и бензола от желтого до синего окрашивания.
УЧ = 1, формула прямого титрования
Солевые формы
Метод нейтрализации
Точную навеску препарата растворяют в воде, прибавляют индикатор метиловый оранжевый, титруют 0,1 М HCl до розового окрашивания

ВАК: весовой метод, аргентометрический, фотометрические методы.
Хранение. В хорошо закрытых склянках, в сухом месте.
Применение. Группа снотворных препаратов.
Связь химического строения с действием: усиление снотворного действия препаратов этой группы зависит от радикалов (R и R').
1 . при увеличении углеродных атомов в цепи до 5 - 6 , снотворный эффект уменьшается, дальнейшее увеличение приводит к снижению физиологической активности и появлению судорог (барбамил);
2. фенильный радикал при одновременном присутствии этилового радикала усиливает снотворный эффект, и придает препарату противосудорожное действие (фенобарбитал);
3. разветвленная цепь R усиливает снотворный эффект, при этом длительность действия преапарата сокращается (барбамил, этаминал натрия);
4. непредельная связь в радикале усиливает снотворный эффект (гексенал - наркотик - вводится внутривенно);
5. замена водорода при атоме азота может вызвать возбуждающее действие и судороги;
солевые формы по скорости действия быстрее, чем кислотные, но действие их кратковременно.
Barbitalum
