
- •Общие методические указания
- •Раздел 1 Моль. Количество вещества эквивалента простых и сложных веществ. Закон эквивалентов
- •Задачи для самостоятельного решения
- •Раздел 2 Строение атома. Периодический закон, периодическая система элементов д.И. Менделеева
- •Распределение электронов по уровням при различных степенях окисления элементов vib группы
- •V период Zr Nb Mo
- •VI период Hf Ta w
- •Задачи для самостоятельного решения
- •Раздел 3 Химическая связь и строение молекул. Конденсированное состояние вещества
- •Задачи для самостоятельного решения
- •Раздел 4 Энергетика химических процессов. Термохимические расчеты
- •Стандартные энтальпии образования fH0, энтропии s 0 и энергии Гиббса образования fG0 некоторых веществ
- •Задачи для самостоятельного решения
- •Раздел 5 Химическая кинетика и равновесие
- •Задачи для самостоятельного решения
- •Раздел 6 Способы выражения концентрации раствора
- •Задачи для самостоятельного решения
- •Раздел 7 Свойства разбавленных растворов неэлектролитов
- •Задачи для самостоятельного решения
- •Раздел 8 Ионное произведение воды. Водородный показатель. Произведение растворимости
- •Задачи для самостоятельного решения
- •Раздел 9 Гидролиз солей
- •Задачи для самостоятельного решения
- •Раздел 10 Окислительно-восстановительные реакции
- •Задачи для самостоятельного решения
- •Раздел 11 Комплексные соединения
- •Задачи для самостоятельного решения
- •Раздел 12 Химия неметаллов
- •Задачи для самостоятельного решения
- •Раздел 13 Химия s-, p-металлов
- •Задачи для самостоятельного решения
- •Раздел 14 Химия d-металлов
- •Химические свойства высших оксидов 3p- и 3d-элементов
- •Задачи для самостоятельного решения
- •Список использованной литературы
- •Рекомендуемая литература (основная)
- •Рекомендуемая литература (дополнительная)
Раздел 3 Химическая связь и строение молекул. Конденсированное состояние вещества
Свободные атомы большинства элементов стремятся объединиться, образуя системы с более низкой энергией – молекулы, цепи, слои, каркасы. Большинство веществ в газообразном состоянии состоят из молекул, образованных двумя и более атомами. Исключением являются благородные газы, молекулы которых одноатомны. Связь между атомами называют химической связью. Она имеет электростатическую природу, т.е. основана на электростатическом взаимодействии всех ядер и электронов, принадлежащих молекуле.
Описание химической связи в любой молекуле есть, по существу, описание распределения в ней электронной плотности. По характеру этого распределения принято различать ионный, ковалентный и металлический тип связи.
Ковалентную связь образуют атомы, не сильно отличающиеся по электроотрицательности. Химическая связь осуществляется за счёт обобществления электронов, принадлежащих взаимодействующим атомам. Электронная плотность сосредоточена в пространстве между ядрами атомов (H2, N2 и т.д.).
Ионная связь возникает в результате электростатического взаимодействия противоположно заряженных ионов, обладающих обособленными друг от друга электронными оболочками (Na+Cl-, Cs+F- и т.д.).
Чисто ионные и чисто ковалентные связи представляют собой лишь предельные случаи химической связи. В подавляющем большинстве молекул химические связи являются промежуточными между чисто ионными и чисто ковалентными. Это полярные ковалентные связи, при которых общая электронная плотность смещена к ядру более электроотрицательного атома-партнера. Если такое смещение невелико, то связь по своему характеру приближается к чисто ковалентной; чем это смещение больше, тем ближе связь к чисто ионной.
При сближении молекул также возникает химическая связь. Межмолекулярные связи отличаются от межатомных значительно меньшей прочностью.
К числу фундаментальных характеристик молекулы относятся её геометрическое строение и прочность. Геометрическое строение молекулы определяется межъядерными расстояниями (длиной связи) и валентными углами (углами, образованными прямыми, проходящими через ядра химически связанных атомов). Прочность молекулы характеризуется энергией связи.
Для квантовомеханического описания ковалентной связи существуют два основных метода: метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
Основные положения метода валентных связей:
1. Ковалентная связь образуется двумя электронами, обладающими противоположно направленными спинами, принадлежащими двум атомам, между которыми осуществляется химическая связь.
Общая электронная пара может образоваться как в результате обобществления двух неспаренных электронов, принадлежащих разным атомам (обменный механизм образования связи), так и за счёт пары электронов одного атома – донора – и вакантной орбитали второго атома – акцептора (донорно-акцепторный механизм).
2. При образовании ковалентной связи происходит перекрывание электронных облаков взаимодействующих атомов: чем больше степень перекрывания, тем прочнее связь. Поэтому ковалентная связь образуется в том направлении, в котором достигается максимальное перекрывание.
Таким образом, МВС рассматривает ковалентную связь как двухэлектронную и двухцентровую связь, локализованную между двумя атомами.
Во многих случаях число неспаренных электронов в атоме оказывается меньшим, чем число образованных им связей. Это объясняется тем, что при возбуждении атома происходит распаривание одной или нескольких электронных пар внешнего (валентного) уровня с переходом одного электрона от каждой пары на свободную и энергетически доступную орбиталь более высокого подуровня. Такой процесс называется промотированием и требует затрат энергии (Епром.). Промотирование электронов возможно при условии, что Епром. не превышает той энергии, которая выделяется при образовании связей возбуждённым атомом. Например, промотирование электрона с 2s- на 2p-АО в атоме Be (1s22s2→1s22s12p1) требует затрат энергии, равной 264 кДж/моль. Однако при образовании двух связей возбуждённым атомом выделяется 922 кДж/моль, что с большим избытком компенсирует энергию промотирования и делает этот процесс энергетически выгодным. Наоборот, для атомов фтора, неона и гелия промотирование электронов невозможно, так как для этого могут быть использованы только орбитали следующего энергетического уровня. Это требует затраты энергии, лежащей за пределами возможных значений энергии связи и оценивается соответственно в 1257, 1605 и 1876 кДж/моль. В результате атом фтора образует только одну связь за счёт одного неспаренного электрона (1s22s22p5), а неон и гелий, в атомах которых отсутствуют неспаренные электроны, химических связей не образуют.
Свойства ковалентной связи: насыщаемость, направленность и полярность.
Насыщаемость ковалентной связи обусловлена способностью атомов к образованию строго ограниченного числа связей, которое обычно лежит в пределах от 1 до 6. Общее число валентных орбиталей в атоме, т.е. тех, которые могут принимать участие в образовании химических связей, определяет максимально возможную ковалентность атома. Реальная ковалентность атома элемента в данном соединении определяется числом орбиталей, использованных для образования связей.
Если атом образует все связи только за счёт спаривания электронов (обменный механизм), то обычно говорят о его валентности (или спиновой валентности). Она определяется числом неспаренных электронов атома в основном или возбуждённом состояниях. Общее число связей, образованных атомом как по обменному, так и по донорно-акцепторному механизму, характеризует ковалентность атома.
Пример 1. Поясните, какие значения валентности и ковалентности могут иметь атомы азота и фосфора в соединениях?
Решение: Азот является элементом II периода. Валентный уровень его атома имеет 4 орбитали и 5 электронов:
На валентном уровне атома азота отсутствуют вакантные орбитали, следовательно, промотирование электрона с 2s-подуровня невозможно. Атом азота образует три ковалентные связи по обменному механизму, проявляя валентность, равную трем. Одна ковалентная связь может быть образована по донорно-акцепторному механизму. Таким образом, ковалентность азота равна 4.
Например, в катионе аммония три связи N-H возникают в результате перекрывания одноэлектронных облаков атомов азота и водорода, а четвертая – за счет донорной 2s-орбитали атома азота и пустой орбитали иона H+.
Сера является элементом III периода. Валентный уровень атома серы состоит из трех подуровней и 9 орбиталей. Атом серы может иметь два возбужденных состояния:
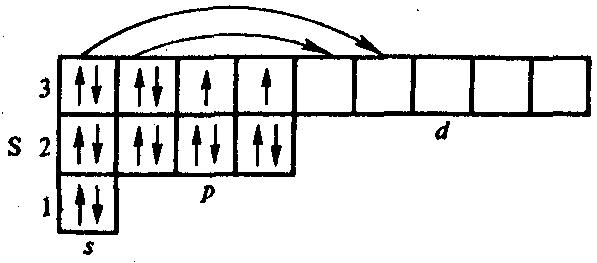
Невозбужденное состояние: валентность=2.
Возбуждённое состояние 1: валентность=4.
Возбуждённое состояние 2: валентность=6.
Наличие 9 валентных орбиталей в электронной оболочке атома серы предполагает его высокую ковалентность. Однако небольшие размеры атома серы не позволяют образовать более 6 ковалентных связей с соседями.
Максимальная ковалентность связана в большей степени с номером периода периодической системы, в котором находится элемент. У элементов I периода имеется одна валентная атомная орбиталь (1s), поэтому ковалентность атома водорода должна быть равна единице (H-H). Однако, ковалентность атома водорода может быть увеличена до двух за счёт его способности образовывать водородные связи (H-F…H-F). Элементы II периода имеют только 4 валентных атомных орбитали (одна 2s- и три 2p-), поэтому их максимальная ковалентность равна 4. У атомов элементов III периода, имеющих 9 валентных орбиталей (одна 3s-, три 3p- и пять 3d-АО), максимальная ковалентность меньше 9, что объясняется небольшими размерами атомов.
Направленность связи. Ковалентная связь возникает при перекрывании атомных орбиталей, а они строго направлены в пространстве, поэтому ковалентные связи также имеют вполне определённое направление, именно то, которое обеспечивает максимальную степень перекрывания электронных облаков.
Для s-электронных облаков, имеющих сферическую симметрию, все направления взаимодействия равноценны. Для p- и d-электронных облаков перекрывание возможно лишь вдоль оси, по которой они вытянуты, образующаяся при этом связь называется σ-связью.
σ-Связь имеет осевую симметрию, оба атома могут вращаться вдоль линии связи, т.е. той воображаемой линии, которая проходит через ядра химически связанных атомов.
![]()
После образования между двумя атомами σ-связи для остальных электронных облаков остается возможность бокового перекрывания, по обе стороны от линии связи. В результате образуется π-связь.
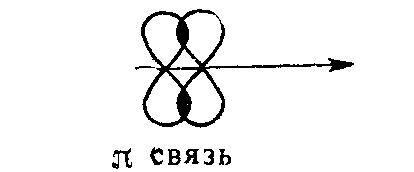
Таким образом, одинарные связи являются σ-связями. Если между двумя атомами возникает кратная (двойная, тройная) связь, то только одна из них является σ-связью. Например, молекула азота:
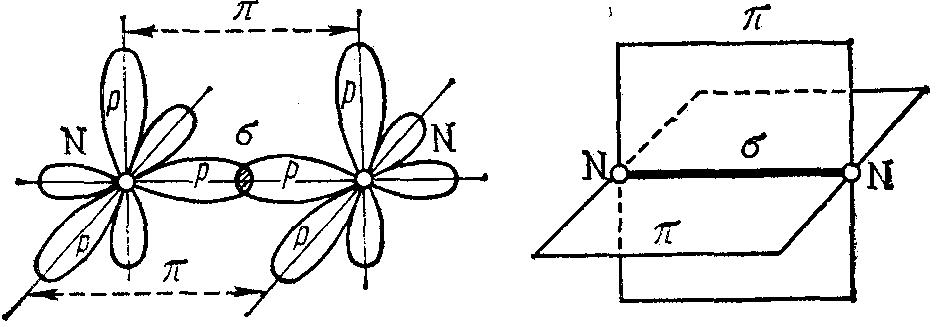
Рис. 2. σ- и π-связи в молекуле азота
Число σ-связей, которые образует центральный атом в сложных молекулах или ионах, определяет для него координационное число (кч). Например, в молекуле SO3 и ионе SO42- для атома серы оно соответственно равно трём и четырём.
Образование σ-связей фиксирует пространственное положение атомов относительно друг друга. Число σ-связей и углы между связями (валентные углы) определяют пространственную геометрическую конфигурацию ковалентных молекул и комплексных ионов. На величину валентных углов, а значит и на пространственную конфигурацию молекул, оказывают влияние и неподелённые электронные пары. Считается, что π-связь влияет только на длину и энергию связи.
Существует несколько способов определения геометрической формы молекул или, другими словами, направленности ковалентных связей.
Например, молекула сероводорода H2S – нелинейная, так как связь образована двумя p-орбиталями атома серы, находящимися под углом 900:
![]()
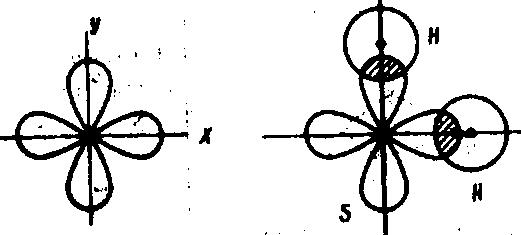
а б
Рис. 3. Схема образования молекулы H2S
Каждая p-орбиталь образует σ-связь с 1s-орбиталью атома водорода (а), ядра атомов серы и водорода расположены под углом 920 (б). Следовательно, форма молекулы H2S – угловая.
Однако геометрическая форма многих молекул и ионов не может быть описана с помощью атомных s-, p- и d-орбиталей. Это бывает тогда, когда σ-связи образуются разными по симметрии орбиталями центрального атома, например, s- и p- или s-, p- и d-орбиталями. В таких случаях для описания пространственной формы молекул используется представление о гибридизации атомных орбиталей центрального атома. Согласно этому представлению, образованию химических связей предшествует изменение формы, а значит и энергии валентных атомных орбиталей атома: исходные неравноценные атомные орбитали, как бы “перемешиваясь”, образуют энергетически равноценные орбитали. При этом происходит перераспределение электронной плотности, которое требует затраты энергии и в изолированных атомах не реализуется. В результате гибридизации электронное облако центрального атома вытягивается по направлению к взаимодействующему с ним атому, благодаря чему увеличивается область перекрывания облаков. Это приводит к образованию более прочной химической связи и, следовательно, к выделению дополнительной энергии, которая и компенсирует затраты энергии на гибридизацию.
Число гибридных АО равно числу участвующих в гибридизации исходных АО атома. Если в гибридизации участвуют одна s- и одна p-орбиталь (sp-гибридизация), то образуются две равноценные sp-орбитали: из одной s- и двух p-орбиталей (sp2-гибридизация) образуются три sp2- орбитали; из одной s- и трёх p-орбиталей (sp3-гибридизация) образуются три sp3- орбитали и т.д.
Гибридные облака, соответствующие данному типу гибридизации, располагаются в атоме так, чтобы взаимодействие между электронами было минимальным, т.е. как можно дальше друг от друга. Поэтому при sp-гибридизации наиболее энергетически выгодным будет положение АО вдоль одной прямой в противоположных направлениях. Это определяет линейную конфигурацию соответствующих молекул, например, BeF2, BeCl2:
Be 1s22s2 Be* 1s22s12px1
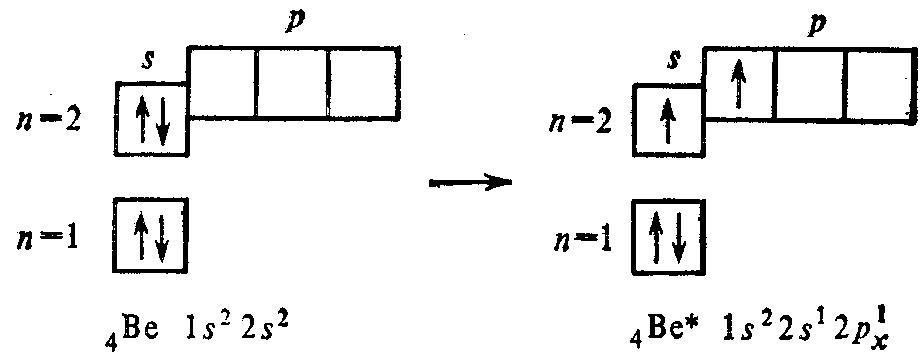
![]()
(s+p)-орбитали две sp-орбитали
![]()
Рис. 4 . Схема образования молекулы BeCl2.
При sp2-гибридизации гибридные облака находятся в одной плоскости и направлены от центра к вершинам правильного треугольника (рис. 5). Валентный угол в этом случае равен 1200. Такой тип гибридизации осуществляется в молекулах BF3, BCl3.
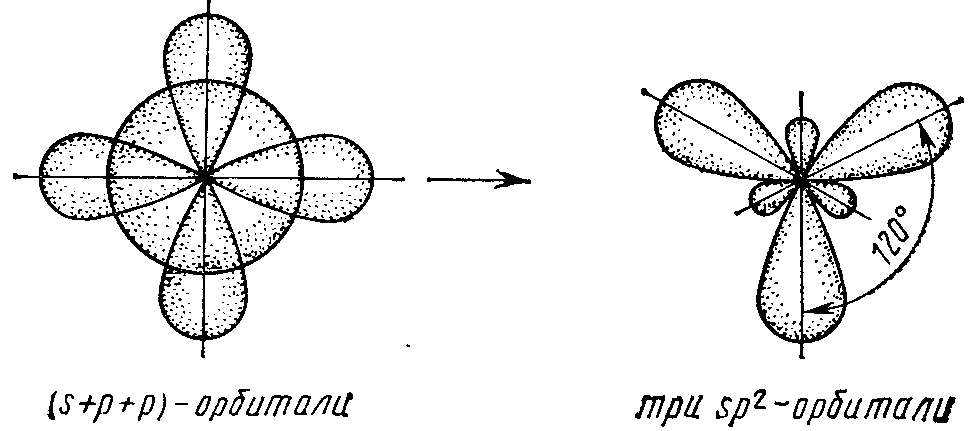
(s+p+p)-орбитали три sp2-орбитали
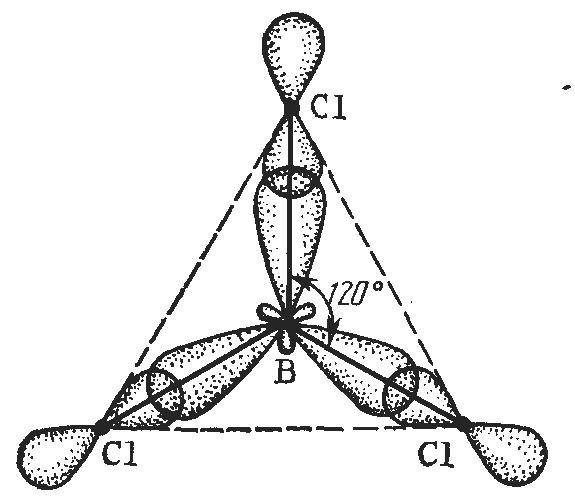
Рис. 5. Схема образования молекулы BCl3.
В случае sp3-гибридизации четыре гибридных орбитали направлены к вершинам правильного тетраэдра под углом 109028′ (рис. 6). Примером тетраэдрических молекул являются CH4, CCl4, ион NH4+.
C: 1s22s22p2 C*: 1s22s12p1x2p1y2p1z
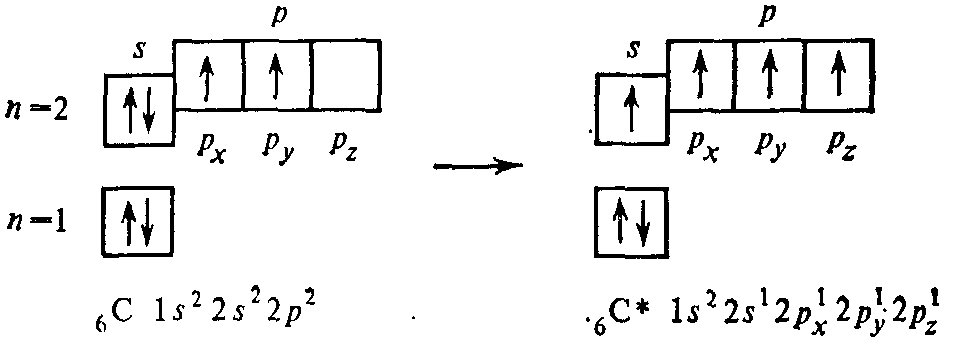
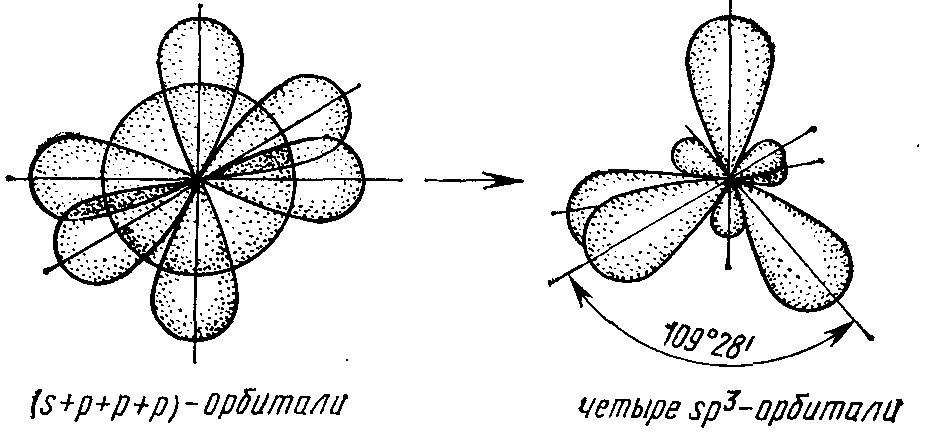
(s+p+p+p)-орбитали четыре sp3-орбитали
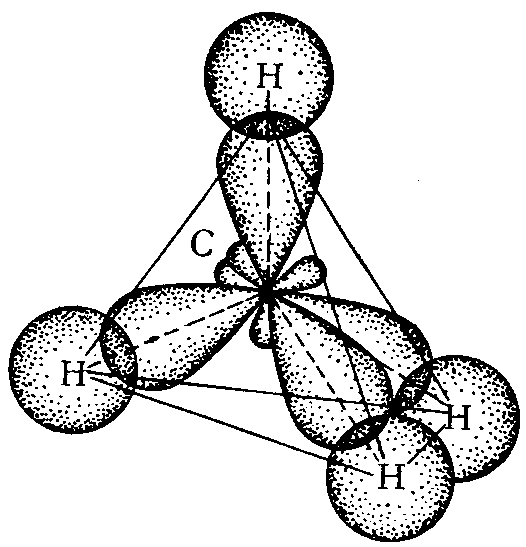
Рис. 6. Схема образования молекулы CH4.
Если кроме s- и p-орбиталей в гибридизации участвуют, например, две d-орбитали (sp3d2-гибридизация), то образовавшиеся шесть гибридных атомных орбиталей направлены к вершинам октаэдра (т.е. расположены по взаимно перпендикулярным направлениям).
В гибридизации могут участвовать не только орбитали с одним электроном и образующие σ-связи, но и АО с двумя электронами, не принимающие участия в образовании связи. В этом случае на гибридных орбиталях остаётся такое же число неподелённых (нп) электронных пар, которое было на исходных АО. Так, в молекуле SO2 у атома серы в гибридизации могут участвовать две p-орбитали, использованные на образование σ-связи, и одна s-орбиталь, имеющая неподеленную (нп) пару электронов. Следовательно, атом серы находится в состоянии sp2-гибридизации и валентный угол OSO близок к 1200.
Геометрическая конфигурация молекул полностью определяется типом гибридизации орбиталей центрального атома только при условии, что все гибридные АО принимают участие в образовании связй. Если на валентном уровне центрального атома остаются электронные пары, не участвующие в образовании связей (нп), то они могут располагаться на гибридных орбиталях. В этом случае при одном и том же типе гибридизации возможны различные геометрические формы молекул (табл. 3).
Таблица 3
Наиболее распространённые геометрические формы молекул
Число электронных пар |
Тип гибриди-зации |
Расположение электронных пар центр. атома |
Геометрическая форма и состав молекулы |
При-меры |
|
связы-вающих (пп) |
несвязывающих (нп) |
||||
2 |
0 |
sp |
Линейное |
Линейная АВ2 |
CO2, BeCl2 |
3 |
0 |
sp2 |
Треугольное
|
Плоский треугольник АВ3 |
AlCl3, CO32- |
2 |
1 |
Угловая АВ2 |
SO2, GeF2 |
||
4 |
0 |
sp3 |
Тетраэдрическое |
Тетраэдр АВ4 |
CH4, ClO4-, |
3 |
1 |
Тригональ-ная пирамида АВ3 |
NH3, PF3, |
||
2 |
2 |
Угловая АВ2 |
H2O, H2S, |
||
5 |
0 |
sp3d |
Тригонально-бипирами-дальное |
Тригональная бипирамида АВ5 |
PCl5, PF5 |
6 |
0 |
sp3d2 |
Октаэдричес-кое |
Октаэдр АВ6 |
SF6, [SiF6] |
Присутствие в молекуле неподеленных электронных пар сказывается на величине валентных углов. Так, в молекулах аммиака и воды имеет место одинаковый тип гибридизации атомных орбиталей центральных атомов – sp3, но валентные углы различаются. Это связано с тем, что силы расталкивания между неподеленными электронными парами больше, чем между поделёнными парами (пп).
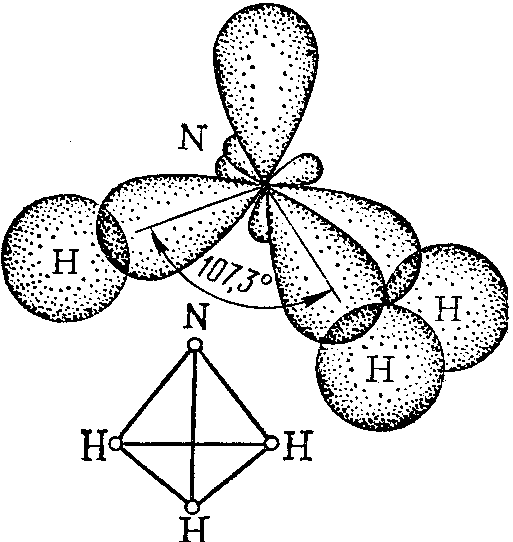
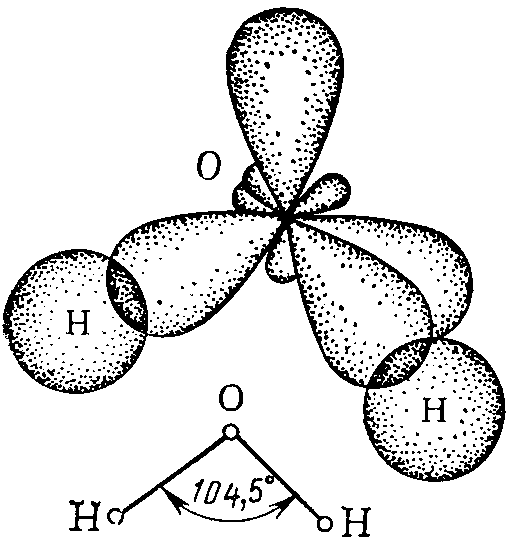
а б
Рис. 7. Схемы образования молекул NH3 (а) и H2O (б).
Пример 2. Опишите пространственную структуру молекул:
а) CO2; б) SO2; в) SiF4.
Решение:
а) Графическая формула молекулы CO2 имеет вид: O=C=O. Атом углерода образует четыре связи, две из них – σ-связи.
Строение валентного уровня атома углерода соответствует формуле: 2s22p2. Для образования четырех ковалентных связей атом углерода при взаимодействии с кислородом переходит в возбужденное состояние, которое сопровождается переходом одного из 2s-электронов на свободную 2p-орбиталь:
C:
Образование двух равноценных σ-связей объясняется гибридизацией одной s- и одной p-орбитали, в результате которой получается две одинаковые sp-гибридные АО.
![]()
Оставшиеся две 2p-орбитали участвуют в образовании π-связей. Таким образом, молекула CO2 имеет линейное строение.
б) Изобразим графическую формулу молекулы SO2: O=S=O.
Атом серы образует четыре ковалентных связи, две из них – σ- и две π-связи. Для их образования требуется переход атома серы в возбуждённое состояние, при котором происходит распаривание 3p-электронной пары на свободную 3d-орбиталь.
В электронографической формуле атома серы выделим электроны, образующие σ-связи (т.е. поделённые электронные пары) и определим число неподелённых электронных пар.
![]()
1нп+2пп <OSO~119,50
В пространстве вокруг атома серы необходимо разместить три электронные пары: одну неподеленную и две σ-связывающие (π-связывающие орбитали не рассматриваются). Для этого требуется три гибридных атомных орбитали. Таким образом, в гибридизации будут участвовать одна s- и две p-орбитали, тип гибридизации – sp2.
Следует иметь в виду, что расположение в пространстве σ-связывающих и неподеленных электронных пар, как правило, не соответствует форме молекул. Форма молекул определяется расположением ядер атомов. Следовательно, молекула SO2 имеет угловую форму.
в) Графическая формула, расположение σ-связей атома кремния с атомами фтора в молекуле SiF4 имеют вид:
![]()
4пп (4 σ-связи)
Для образования четырех ковалентных связей атом кремния переходит в возбужденное состояние, при котором один из 3s-электронов промотирует на свободную 3p-орбиталь. В гибридизации участвуют одна s- и три p-орбитали, тип гибридизации – sp3. Четыре гибридных АО располагаются в пространстве по направлению к вершинам правильного тетраэдра под углом 109,5° друг к другу. Следовательно, молекула SiF4 имеет форму тетраэдра.
Наиболее универсальным методом описания ковалентной связи является метод молекулярных орбиталей. Он применим для веществ с любым типом химической связи за исключением слабых межмолекулярных взаимодействий. На качественном уровне этот метод достаточно прост. Основная идея метода молекулярных орбиталей (ММО) заключается в том, что все электроны находятся на молекулярных орбиталях, единых для всей системы ядер и электронов данной молекулы. Для определения волновых функций молекулярных орбиталей используют приближение, называемое линейной комбинацией атомных орбиталей (ЛКАО): молекулярная волновая функция (МО) получается простым сложением или вычитанием атомных волновых функций (АО). Основные положения метода МО ЛКАО (метода молекулярных орбиталей в предположении линейной комбинации атомных орбиталей) заключаются в следующем:
В образовании МО могут участвовать АО, имеющие сходную симметрию и близкую энергию.
Количество МО в молекуле равно сумме АО атомов, входящих в её состав.
МО, которая получается при сложении АО, имеет более низкую энергию, чем исходные АО, и называется связывающей, а при вычитании АО – более высокую энергию и называется разрыхляющей. При этом у гомоядерных молекул число связывающих и разрыхляющих МО одинаково.
При заполнении МО электронами выполняются принцип наименьшей энергии, принцип Паули и правило Хунда.
Электронные облака молекулярных орбиталей двухатомных молекул по аналогии с атомными орбиталями обозначают греческими буквами σ, π и δ.
Электронное строение молекулы изображают в виде энергетической диаграммы.
Рассмотрим принципы построения диаграмм МО гомоядерных двухатомных молекул, образованных атомами элементов I и II периодов периодической системы элементов.
Простейшей является молекула водорода H2. При образовании молекулы Н2 из двух 1s- АО образуется две МО: одна связывающая (σ1s) и одна разрыхляющая (σ1s*). Соотношение между энергиями АО и МО отражено на энергетической диаграмме, где каждая атомная или молекулярная орбиталь изображена горизонтальной чертой. Уровень расположения черты соответствует относительной энергии орбитали. МО расположены в средней части диаграммы, АО – по ее краям. Электроны обозначают стрелками, направление которых соответствует спину электрона.
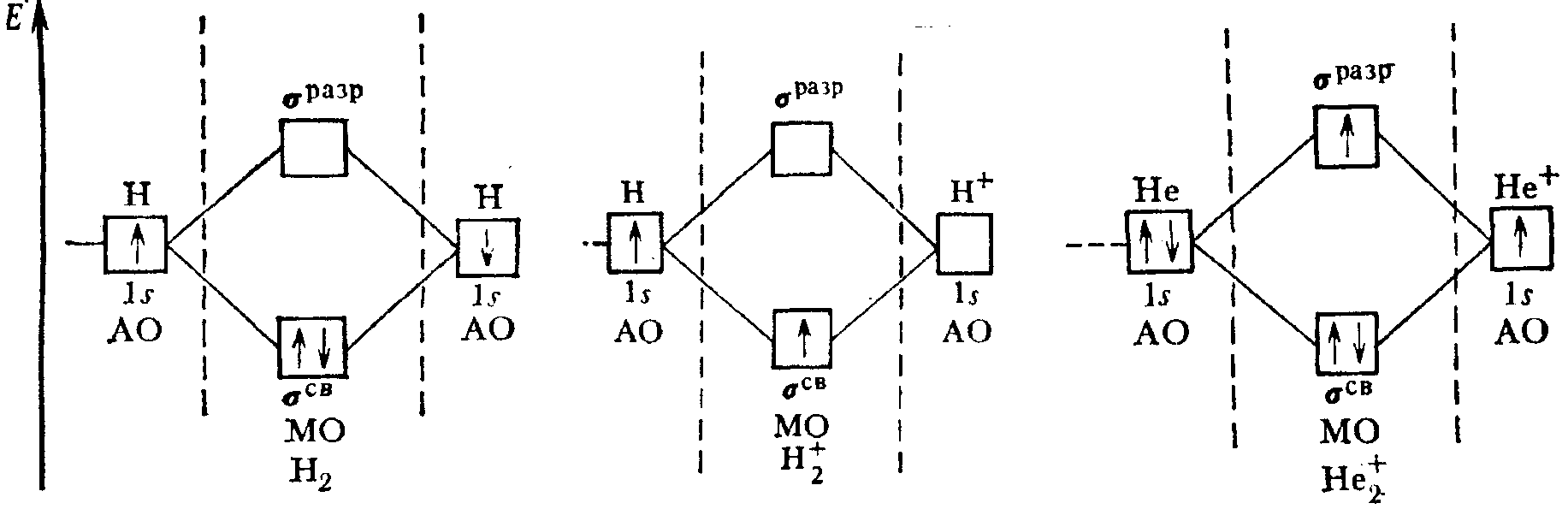
Рис. 8. Энергетические диаграммы двухатомных молекул, образованных элементами первого периода
Энергия связи коррелирует с величиной кратности или порядка связи (ρ), вычисляемой как полуразность числа электронов на связывающих и разрыхляющих орбиталях:
ρ=(∑связ. е – ∑разрых.е)/2.
Если ρ=0, то молекула не образуется. Порядок связи может принимать как целые, так и дробные положительные значения.
Есвязи, кДж/моль
ρ(Н2+) = (1 - 0)/2=0,5 256
ρ (Н2) = (2 - 0)/2=1 432
ρ (Не2+) = (2 - 1)/2=0,5 250
Таким образом, энергия связи в молекуле Н2 больше, чем в ионе Н2+. Молекула Не2 существовать не может, так как число связывающих и разрыхляющих электронов в ней одинаково и порядок связи равен нулю.
Двухатомные молекулы элементов II периода.
Атомы элементов этого периода имеют заполненный первый уровень и частично или полностью заполненный 2-ой (валентный) уровень. Орбитали заполненного слоя, как правило, не принимают участия в в образовании связи, так как число электронов на образующихся СМО и РМО одинаково. Они составляют остов молекулы. МО образуются при линейной комбинации 2s- и 2р- орбиталей. На рис. 9 представлены диаграммы МО молекул N2 и O2.
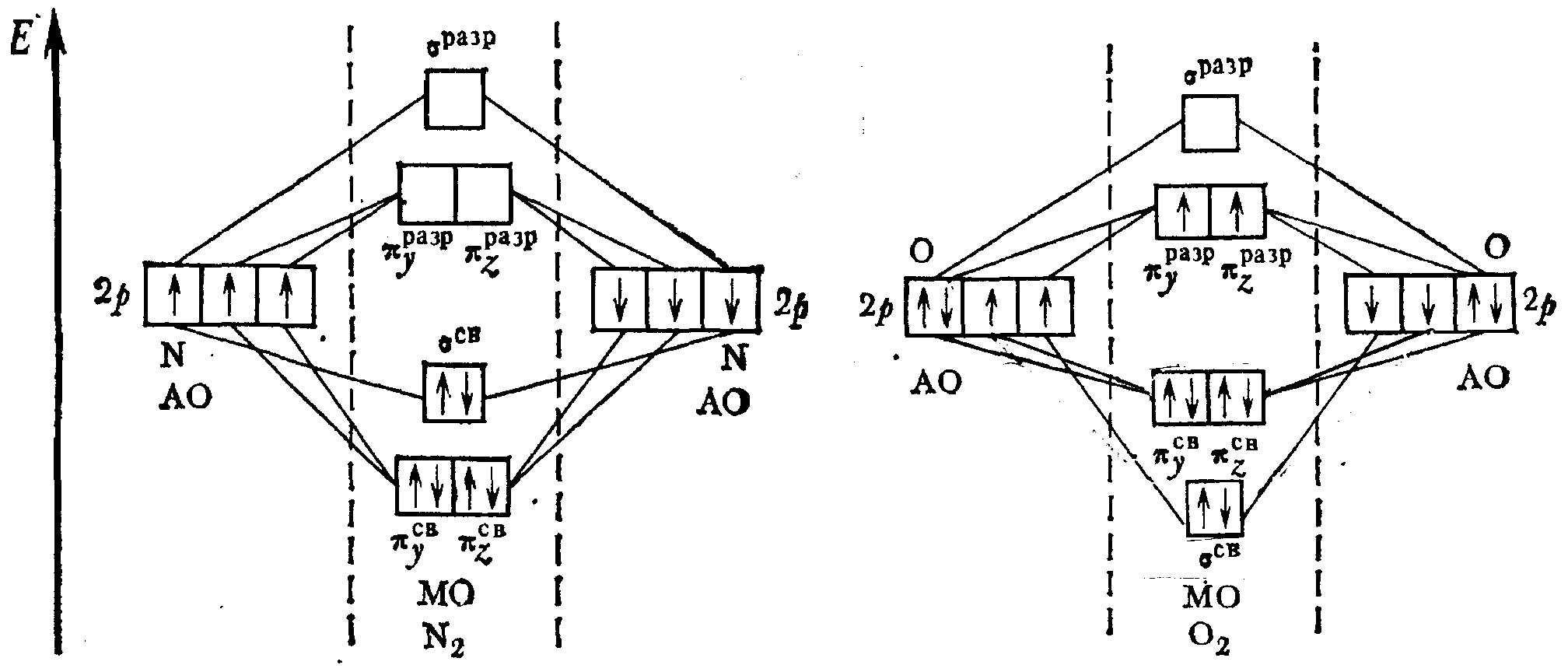
Рис. 9. Энергетические диаграммы молекул N2 и O2.
В молекуле О2 8 электронов (2р-подуровней) заселяют сначала σ2р-, а затем π2р- и π2р*-молекулярные орбитали. На каждой из π2р*-МО в соответствии с правилом Хунда находится по 1е-. Отсюда следует, что молекула О2 – парамагнитна, так как имеет два неспаренных электрона. Порядок связи в молекуле О2 равен 2, энергия связи составляет 498 кДж/моль, длина связи – 1,21 Å.
Экспериментально доказано, что в молекулах от Li2 до N2 π2р-СМО лежат ниже, чем σ2р-СМО. На разрыхляющих орбиталях данных молекул электроны отсутствуют, поэтому связи более прочные и короткие.
В молекуле N2, в отличие от молекулы О2, 6 электронов (2р-подуровней) заселяют сначала две π2р-СМО, а затем σ2р-МО, на π2р*-МО электронов нет. Порядок связи в молекуле N2 равен 3, энергия связи составляет 945 кДж/моль, длина связи – 1,10 Å.
Какую информацию о строении и свойствах молекул можно извлечь из энергетических диаграмм МО?
Прочность молекул (энергия диссоциации) коррелирует со значением порядка связи. Молекула N2 значительно прочнее молекулы О2.
Длина связи (межатомные расстояния) также коррелирует со значением порядка связи. Так, молекула N2 значительно прочнее молекулы О2, соответственно длина связи N-N меньше, чем O-O.
Магнитные свойства молекулярных частиц определяется так же, как и для атомов: частицы, имеющие неспаренные электроны, парамагнитны (втягиваются во внешнее магнитное поле) и диамагнитны (выталкиваются из магнитного поля), если все электроны спарены. Следовательно, ион Н2+ и молекула О2 – парамагнитны, а молекулы Н2 и N2 – диамагнитны.
Ионная связь. При взаимодействии наиболее электроотрицательных атомов с наиболее электроположительными (например, щелочных металлов и галогенов) образуется связь с большой степенью полярности. Поскольку электроотрицательности этих атомов различаются очень сильно, при сближении атомов валентные электроны одного из них полностью переходят ко второму атому. В результате оба атома становятся ионами:
Na· + ·Cl → [Na : Cl] → [Na+][Cl-]
Между ионами Na+ и Cl- возникает электростатическое притяжение. Такую связь называют ионной.
Чисто ионных связей нет. В реальных молекулах связи носят промежуточный характер между ионными и ковалентными
Ионная связь может быть описана в рамках методов ВС и МО, однако обычно её рассматривают с помощью законов электростатики.
При обычных условиях ионные соединения существуют в твёрдом состоянии. Кристалл ионного соединения состоит из закономерно расположенных положительно и отрицательно заряженных ионов. Все связи данного иона с другими энергетически равноценны. При растворении или плавлении ионного кристалла в раствор переходят заряженные ионы.
В отличие от ковалентной связи ионная связь ненаправлена и ненасыщаема. Это объясняется тем, что электрическое поле ионов имеет сферическую симметрию. Ионы противоположного знака притягиваются друг к другу независимо от их расположения в пространстве, при этом полной взаимной компенсации электрических полей ионов не происходит. Каждый ион имеет возможность взаимодействовать с переменным и большим числом противоположно заряженных ионов. Координационные числа (кч) ионов в ионных соединениях имеют большие значения. В отличие от ковалентных соединений кч определяются не электронной структурой атомов, а соотношением радиусов взаимодействующих ионов.
Ионные связи обладают большой прочностью, поэтому ионные кристаллы имеют:
а) высокую прочность, твердость, хрупкость;
б) высокие температуры плавления;
в) компактную структуру (плавятся с увеличением объема);
г) твердые ионные кристаллы являются изоляторами, так как в узлах кристаллической решетки находятся ионы противоположного знака;
д) хорошую растворимость в полярных растворителях (“подобное растворяется в подобном”).
Электростатическое взаимодействие ионов в ионном соединении приводит к взаимной деформации их электронных оболочек, которую называют поляризацией. Процесс поляризации двусторонний, в нем сочетается пояризующее действие и поляризуемость.
Если изолированные ионы могут сохранять сферическую форму (рис. 10а), то в результате поляризации происходит изменение формы облаков (рис. 10б), приводящее к уменьшению степени ионности связи (связь становится частично ковалентной).
![]()
![]()
![]()
а б
![]()
Увеличение поляризации
Рис. 10. Поляризация катиона анионом
Это отражается на свойствах веществ с ионным типом связи: уменьшает их растворимость, термическую устойчивость, приводит к появлению окраски.
Металлическая связь. Атомы металлов содержат на внешних уровнях мало электронов и, следовательно, имеют много вакантных атомных орбиталей. Образование атомом возможно большего числа химических связей способствует понижению внутренней энергии - его химическому насыщению. Атомы металлов могут достичь этого при плотной упаковке в кристаллические структуры, в которых малочисленные валентные электроны каждого атома смогут принадлежать одновременно нескольким атомам, образуя между ними нелокализованные связи.
При одновременном взаимодействии N атомов в кристалле число возникающих молекулярных орбиталей равно сумме орбиталей отдельных атомов. Даже если учитывать только внешние s- и р-орбитали, то при содержании в кристалле N атомов образуется 4N молекулярных орбиталей (рис. 11). Число электронов, занимающих эти МО в порядке возрастания соответствующей им энергии, мало. Так, атом лития имеет один валентный электрон на 2s-орбитали. При взаимодействии N атомов лития 2s-АО, на которых находятся валентные электроны, образуют валентную зону, состоящую из N σ-МО. Нижняя часть валентной зоны, включающая σ-связывающие МО, заполнена электронами. Верхняя часть валентной зоны, образованная σ*-разрыхляющими МО, свободна и называется зоной проводимости.
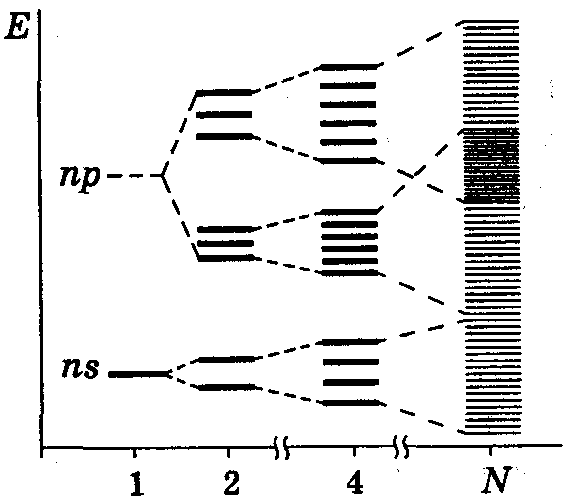
Рис. 11. Расщепление энергетических уровней электронов
при последовательном присоединении атомов
При наложении даже незначительной разности потенциалов электроны, благодаря близости энергетических уровней, способны переходить из валентной зоны в зону проводимости, перенося электрические заряды через весь кристалл. Таким образом, у металлов валентная зона сливается с зоной проводимости.
В атомах неметаллов число валентных электронов велико и валентная зона кристалла практически заполнена электронами. Зона проводимости образуется за счет орбиталей, имеющих намного большую энергию, чем валентные орбитали, т.е. принадлежащих следующему электронному уровню. В таких кристаллах между валентной зоной и зоной проводимости находится запрещенная зона. Если валентная зона полностью занята электронами, вещества не обладают металлической проводимостью. Их электрофизические свойства зависят от ширины запрещенной зоны.
В кристалле алмаза валентная зона заполнена электронами, ширина запрещенной зоны ΔЕ=5,7 эВ. Электроны не могут перейти в зону проводимости без разрыва химических связей, т. е. без разрушения кристалла. В связи с этим алмаз является диэлектриком, так как не способен проводить электрический ток.
Кристаллы кремния имеют структуру алмаза, но атомы Si обладают свободными 3d-орбиталями, близкими по энергии к 3р-орбиталям. Поэтому зона проводимости, образуемая 3d-АО, располагается ближе к валентной зоне, ΔЕ составляет только 1,12 эВ и валентные электроны при небольшом возбуждении могут переходить в зону проводимости. В результате кристалл кремния способен проводить электрический ток.
Подобные материалы, которые в нормальном состоянии являются диэлектриками, а в возбужденном (под действием теплоты или света) – проводниками электричества, называют полупроводниками. У полупроводников ширина запрещенной зоны ΔЕ составляет 0,1 – 3 эВ.
Различия в зонной структуре металлов (а), полупроводников (б) и диэлектриков (в) показаны на рис. 12.
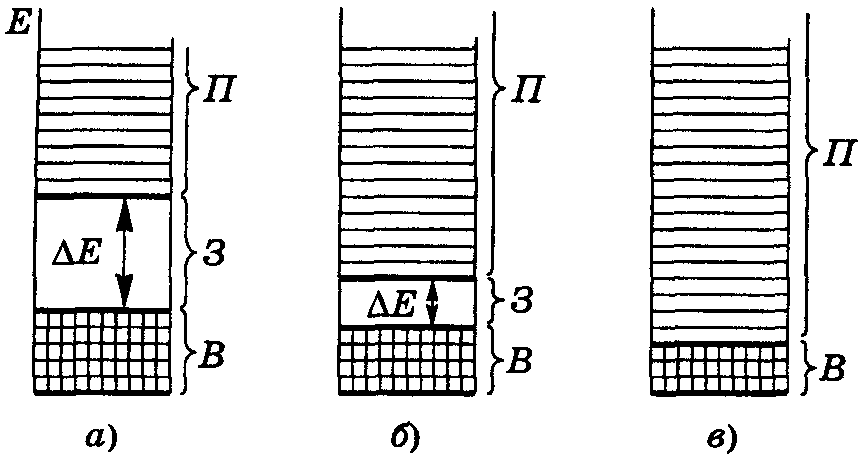
Рис. 12. Относительные размеры энергетических зон:
В – валентной, З – запрещенной, П – проводимости – для кристаллов:
а – диэлектриков, б - полупроводников, в – металлов.
Водородная связь образуется между положительно поляризованным атомом водорода одной молекулы и сильно электроотрицательным атомом (F, O, N, реже – Cl и S), принадлежащим той же или другой молекуле. Такую связь может образовывать только атом водорода, связанный с электроотрицательным атомом, смещающим на себя электронную плотность и создающим тем самым на атоме водорода эффективный положительный заряд (+δ). Например, в молекуле спирта водородную связь с другими молекулами может осуществлять только атом водорода, связанный с кислородом:
CH3-CH2-O-δ←H+δ (стрелка указывает направление смещения пары электронов).
Водородную связь (Н-связь) обозначают тремя точками (…):
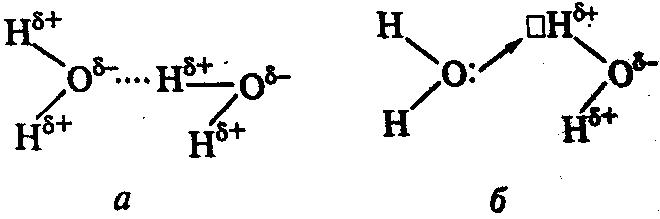
Рис. 13. Схема образования водородной связи
Водородная связь является, с одной стороны, результатом диполь-дипольного взаимодействия (рис. 13 а). С другой стороны, в образовании водородной связи существенную роль играют донорно-акцепторные взаимодействия. Положительно поляризованный атом водорода, практически лишенный электронной оболочки, так как в его связях электронная плотность смещена в сторону более электроотрицательного атома, может являться акцептором электронной пары (рис. 13 б).
По энергии водородная связь не очень прочная (от 4 до 20 кДж/моль), но в некоторых случаях, например, в H2F2, её энергия близка к энергии ковалентной связи (~200 кДж/моль).
Сильные водородные связи возникают в воде. Многие удивительные свойства воды обусловлены наличием таких связей. Например, плотность льда меньше плотности жидкой воды, поскольку молекулы воды во льду связаны с четырьмя другими молекулами водородными связями, образуя трехмерную решетку, в которой существуют пустоты. При плавлении льда часть водородных связей разрушается, молекулы сближаются, и плотность воды увеличивается. Однако при температуре, близкой к температуре плавления (0 0С), не все водородные связи в структуре льда рвутся. В жидкой воде сохраняются большие фрагменты льда. Часть молекул, не вошедших в структуру льда, помещается в его пустотах, и это приводит к повышению плотности жидкости по сравнению с плотностью кристалла. Наибольшую плотность вода имеет при 4 0С. Система водородных связей сохраняется в жидкой воде и при дальнейшем нагревании вплоть до температуры кипения. Лишь в газовой фазе вода практически неассоциирована. Этим объясняется высокая температура кипения воды.
Наличие водородной связи оказывает значительное влияние на многие физико-химические свойства веществ, в том числе:
повышает температуру кипения веществ;
увеличивает их растворимость в воде за счет образования водородной связи между молекулами воды и растворённых веществ, например, NH3, спирты и др.;
способствует ориентации полимерных молекул, например, с помощью водородной связи между нуклеиновыми основаниями (N-H…N и N-H…O) соединены цепи нуклеиновых кислот, образующие двойную спираль.
Пример 3.
Сероводород при обычной температуре – газ, а вода – жидкость. Чем можно объяснить это различие в свойствах?
Решение: Кислород более электроотрицательный элемент, чем сера. Поэтому между молекулами воды возникают более прочные водородные связи, чем между молекулами сероводорода, разрыв этих связей, необходимый для перехода воды в газообразное состояние, требует значительной затраты энергии, что и приводит к аномальному повышению температуры кипения воды.
Межмолекулярные взаимодействия существуют между молекулами в жидкостях, кристаллах, в реальных газах. Этот тип связи не сопровождается дополнительным обобществлением электронной плотности, а основан на взаимодействии диполей. Понятие о межмолекулярном взаимодействии впервые было введено голландским ученым Ван-дер-Ваальсом, поэтому силы этого взаимодействия называют ван-дер-ваальсовыми. Они обусловлены тремя типами слабого взаимодействия: ориентационным, индукционным, дисперсионным.
Ориентационное взаимодействие возникает при сближении двух полярных молекул, имеющих постоянный дипольный момент, например HCl (μ=1,05 D), SO2 (μ=1,63 D) в жидком и твердом состоянии. Оно тем значительнее, чем больше дипольный момент молекул и меньше расстояние между ними.
Индукционное взаимодействие возникает между полярной и неполярной молекулами, при условии, что неполярная молекула способна поляризоваться под действием полярной молекулы, например, в растворе I2 в спирте. Индукционный эффект возрастает с увеличением поляризуемости молекулы.
Дисперсионное взаимодействие возникает между неполярными молекулами. В неполярных молекулах распределение электронной плотности симметрично и дипольный момент отсутствует. Тем не менее, электронные облака постоянно колеблются относительно ядер, образуя временные или мгновенные диполи. Мгновенный диполь одной молекулы индуцирует мгновенный диполь в другой молекуле. Дипольные моменты обеих молекул направлены в одну сторону, что вызывает притяжение молекул. Дисперсионные взаимодействия присутствуют в молекулах неполярных и полярных веществ. Переход газов (O2, H2, N2 и др.) в жидкое и твердое состояние обусловлен дисперсионным притяжением молекул.
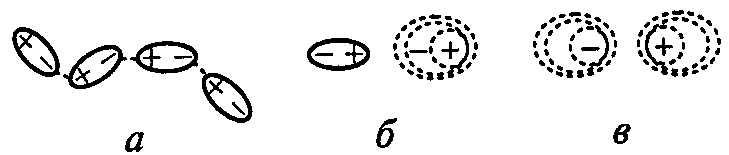
Рис. 14. Типы межмолекулярных взаимодействий:
а – ориентационное, б – индукционное, в – дисперсионное
Силы межмолекулярного взаимодействия по сравнению с обычными валентными силами ненасыщаемы, имеют низкую энергию, действуют на небольших расстояниях. Например, энергия связи Cl-Cl составляет 245 кДж/моль, а энергия связи между молекулами Cl2 в кристалле хлора на порядок ниже и составляет 25 кДж/моль. Сила межмолекулярного взаимодействия возрастает с увеличением размеров молекул.
Пример 4.
Ниже приведены температуры кипения благородных газов:
He Ne Ar Kr Xe Rn
Ткип, 0С -268,7 -245,8 -185,7 -153,1 -108 -61,8
Чем объясняется повышение температуры кипения газов в этом ряду?
Решение: С ростом зарядов ядер атомов благородных газов увеличиваются размеры их электронных оболочек, но структура внешнего электронного слоя сохраняется. Поэтому поляризуемость атомов возрастает при переходе от He к Rn, вследствие чего возрастают и силы дисперсионного взаимодействия между ними. Затраты энергии, необходимой на отрыв атомов друг от друга при переходе вещества из жидкого в газообразное состояние, возрастают. Это и приводит к повышению температуры кипения.
