
- •Общие методические указания
- •Раздел 1 Моль. Количество вещества эквивалента простых и сложных веществ. Закон эквивалентов
- •Задачи для самостоятельного решения
- •Раздел 2 Строение атома. Периодический закон, периодическая система элементов д.И. Менделеева
- •Распределение электронов по уровням при различных степенях окисления элементов vib группы
- •V период Zr Nb Mo
- •VI период Hf Ta w
- •Задачи для самостоятельного решения
- •Раздел 3 Химическая связь и строение молекул. Конденсированное состояние вещества
- •Задачи для самостоятельного решения
- •Раздел 4 Энергетика химических процессов. Термохимические расчеты
- •Стандартные энтальпии образования fH0, энтропии s 0 и энергии Гиббса образования fG0 некоторых веществ
- •Задачи для самостоятельного решения
- •Раздел 5 Химическая кинетика и равновесие
- •Задачи для самостоятельного решения
- •Раздел 6 Способы выражения концентрации раствора
- •Задачи для самостоятельного решения
- •Раздел 7 Свойства разбавленных растворов неэлектролитов
- •Задачи для самостоятельного решения
- •Раздел 8 Ионное произведение воды. Водородный показатель. Произведение растворимости
- •Задачи для самостоятельного решения
- •Раздел 9 Гидролиз солей
- •Задачи для самостоятельного решения
- •Раздел 10 Окислительно-восстановительные реакции
- •Задачи для самостоятельного решения
- •Раздел 11 Комплексные соединения
- •Задачи для самостоятельного решения
- •Раздел 12 Химия неметаллов
- •Задачи для самостоятельного решения
- •Раздел 13 Химия s-, p-металлов
- •Задачи для самостоятельного решения
- •Раздел 14 Химия d-металлов
- •Химические свойства высших оксидов 3p- и 3d-элементов
- •Задачи для самостоятельного решения
- •Список использованной литературы
- •Рекомендуемая литература (основная)
- •Рекомендуемая литература (дополнительная)
Раздел 2 Строение атома. Периодический закон, периодическая система элементов д.И. Менделеева
Электронное строение атома определяется, в первую очередь, энергией электронов и вероятностью их нахождения в каждой точке пространства вблизи ядра. Современная теория строения атома основана на законах квантовой механики.
Во-первых, в квантовой механике энергия электромагнитного излучения (в том числе и электронов) изменяется не непрерывно, а порциями – квантами. Изменение энергии электрона от E1 до E2 сопровождается поглощением света с частотой (ν), определяемой уравнением Планка:
E1 - E2 =hν.
Во-вторых, все микрочастицы обладают свойствами как частицы, так и волны (корпускулярно-волновой дуализм). Масса любой частицы (m) и ее скорость связаны с длиной волны (λ ) уравнением де Бройля:
λ=h/mv,
где h – постоянная Планка.
В-третьих, невозможно одновременно точно определить координату (положение) и импульс микрочастицы, включая электрон (принцип неопределенности Гейзенберга). Погрешности в определении координаты (Δx) и импульса (Δp=mΔv) связаны соотношением:
Δx∙Δp≥ h/2π.
В квантовой механике оперируют понятием вероятности нахождения электрона в данной точке пространства (dV).
Приведенные положения показывают, что движение электрона в атоме нельзя рассматривать как обычное перемещение, привычное в рамках классической механики. Квантовая механика описывает движение электрона в атоме с помощью волновой функции Ψ (пси), которая является функцией координат x, y, z и не зависит от времени. Квадрат волновой функции Ψ2 пропорционален вероятности нахождения электрона в некотором объёме, окружающем точку с координатами x, y, z. Фундаментальным уравнением квантовой механики является уравнение Шредингера, связывающее функцию Ψ(x,y,z) с полной энергией электрона (E), равной сумме потенциальной и кинетической энергии:
ĤΨ=EΨ,
где Ĥ – оператор полной энергии, указывающий определенную последовательность математических действий над функцией Ψ.
Уравнение Шредингера точно решено только для атома водорода и водородоподобных атомов, т.е. для случая одного электрона, находящегося в сферическом поле ядра. Решение уравнения для одноэлектронной системы позволяет найти волновые функции Ψ (x,y,z). При этом выяснено, что для полного определения каждого решения необходимы три целых числа. Эти числа называют квантовыми и обозначают n, l, m.
Совокупность мест пространства, где квадрат волновой функции имеет максимальное значение, называется атомной орбиталью (АО) или электронным облаком. Каждой атомной орбитали соответствует область пространства определенного размера, формы и ориентации, равноценная понятию электронного облака.
Главное квантовое число – n определяет общую энергию электрона на данной орбитали. Это число может принимать любые целочисленные положительные значения: n=1, 2, 3, …, ∞. Чем выше значение n, тем больше размер атомной орбитали, на которой движется электрон. Орбитали с одинаковыми значениям n образуют энергетические уровни или электронные слои.
О рбитальное
или побочное квантовое число –
l
характеризует
различные энергетические состояния
электрона в пределах данного уровня.
Число l
может принимать целочисленные значения:
l=0,
1, 2,…, (n-1).
Величина l
определяет форму атомной орбитали. При
l=0
орбиталь имеет сферическую форму и
назывется s-орбиталью.
При l=1
орбиталь имеет форму гантели и называется
p-орбиталью.
При l=2
форма орбитали четырехлепестковая и
назывется d-
орбиталью (рис. 1). Орбитали с одинаковыми
значениям n
и l
называют подуровнем.
рбитальное
или побочное квантовое число –
l
характеризует
различные энергетические состояния
электрона в пределах данного уровня.
Число l
может принимать целочисленные значения:
l=0,
1, 2,…, (n-1).
Величина l
определяет форму атомной орбитали. При
l=0
орбиталь имеет сферическую форму и
назывется s-орбиталью.
При l=1
орбиталь имеет форму гантели и называется
p-орбиталью.
При l=2
форма орбитали четырехлепестковая и
назывется d-
орбиталью (рис. 1). Орбитали с одинаковыми
значениям n
и l
называют подуровнем.
Рис. 1. Формы s-, p- и d-электронных облаков (орбиталей)
Магнитное квантовое число – m зависит от орбитального квантового числа l и может принимать целочисленные значения:
m=–l, 0, +l. Значение m определяет ориентацию электронного облака относительно произвольно выбранных направлений взаимно перпендикулярных осей (x, y, z) или относительно внешнего магнитного поля. Число возможных значений m равно числу орбиталей в данном подуровне. Например, при: n=2 подуровню l=1 соответствуют орбитали 2px (m=+1), 2py (m=0), 2pz (m=-1). При n=2 подуровню l=2 отвечают пять орбиталей разных ориентаций (рис. 1).
Таблица 1
Значения квантовых чисел и максимальное число электронов на квантовых уровнях и подуровнях
Квантовый |
Магнитное квантовое число
|
Число квантовых состояний (орбиталей) |
Макси-мальное число электронов |
|||||
уровень |
подуровень |
в подуров-не (2/+1) |
в уровне п |
в подуров-не 2(2/+1) |
в уровне 2n2 |
|||
обозна-чение |
главное кванто-вое число п |
обозна-чение |
орби-тальное кванто-вое число/ |
|||||
К |
1 |
s |
0 |
0 |
1 |
1 |
2 |
2 |
L
|
2
|
s |
0 |
0 |
1 |
|
2 |
|
p |
1 |
-1; 0; +1 |
3 |
4 |
6 |
8 |
||
М |
3 |
s |
0 |
1 |
1 |
|
2 |
|
р |
1 |
-1; 0; +1 |
3 |
9 |
6 |
18 |
||
d |
2 |
-2;-1;0;+1;+2 |
5 |
|
10 |
|
||
N
|
4
|
s p d f d
|
0 1 2 3 |
0 -1; 0; +1 -2;-1,0;+1;+2 -3; -2; -1; 0; +1; +2; +3
|
1 3 5 7 |
16 |
2 6 10 14 |
32 |
Изучение тонких эффектов в атомных спектрах показало, что для полного описания электрона в атоме недостаточно трех квантовых чисел. Электрон, обладая электрическим зарядом, проявляет собственное движение, которое приводит к возникновению собственного магнитного момента. Для характеристики этого свойства электрона было введено спиновое квантовое число – s, принимающее два значения +1/2 и -1/2.
Таким образом, состояние электрона в атоме полностью определяется четырьмя квантовыми числами, три из которых (n, l, m) характеризуют атомную орбиталь, а четвертое (s) – собственный магнитный момент электрона.
Однако в атоме обычно присутствуют не один, а несколько электронов. В таких атомах электроны занимают орбитали, аналогичные атому водорода, но энергия орбиталей отличается от энергии АО атома водорода. Это объясняется бoльшим положительным зарядом ядра, экранированием этого ядра заполненными внутренними орбиталями, межэлектронным отталкиванием. Экспериментально установлен (на основании наблюдения атомных спектров, энергий ионизации, расчетов) следующий порядок расположения атомных орбиталей по возрастанию их энергии:
1s<2s<2p<3s<3p<4s~3d<4p<5s~4d<5p<6s~4f~5d<6p<7s~6d~5f<7s
Эта последовательность АО характерна для любого атома. Учитывая ее, а также принцип наименьшей энергии, принцип Паули, и правило Хунда, можно определить электронную конфигурацию произвольного атома.
Согласно принципу наименьшей энергии (или энергетической выгодности) электрон в атоме всегда стремится занять орбиталь с наименьшей энергией.
Например, в приведенной выше энергетической последовательности уровней электрон из 3-х подуровней 3s, 3p, 3d займет низший 3s-подуровень.
В соответствии с принципом Паули в атоме не может быть электронов с одинаковым набором всех 4-х квантовых чисел n, l, m, s (электроны должны отличаться хотя бы одним квантовым числом). Отсюда следует, что на одной орбитали может находиться не более двух электронов, отличающихся спинами. Пользуясь принципом Паули, можно определить максимальное число электронов, которое может находиться на энергетическом уровне.
Из данных таблицы 1 легко сделать вывод о том, что максимальное число электронов в электронном слое составляет Ne=2n2.
Правило Хунда: заполнение вырожденных орбиталей электронами происходит таким образом, чтобы атом имел в данном подуровне максимальное число параллельных спинов (т.е., чтобы ΣS электронов была максимальной для данного значения l). Это значит, что сначала на каждой орбитали данного подуровня располагается по одному электрону, а затем по второму с противоположно направленным спином. Например, заселение d-АО электронами в соответствии с правилом Хунда возможно только способом (в):
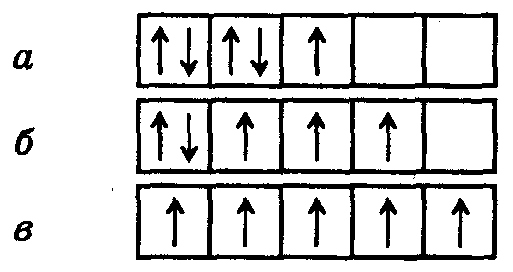
Зная заряд ядра атома (а значит число электронов в электронной оболочке) и порядок заполнения атомных орбиталей электронами, можно определить электронную конфигурацию атома.
Для этого существует два основных способа:
1) электронные формулы,
2) электронографические формулы (или квантовые ячейки).
Электронные формулы атомов или ионов можно записать в полной и сокращенной форме (включив в электронную формулу конфигурацию атома благородного газа):
Na: 1s22s22p63s1 – полная электронная формула
(подчеркнут валентный уровень),
значения квантовых чисел для валентных электронов: n=3, l=0.
Na: 1s22s22p63s1 → [Ne]3s1 - сокращенная электронная формула
[Ne]
Суммарное число электронов в квантовых слоях можно указать так:
2, 8, 18 и т.д. или 2) 8) 18) …
Более полно состояние электронов в атоме описывает электронографическая формула, отражающая все 4 квантовых числа. Каждой ячейке отвечает определенная орбиталь, электрон изображается в виде стрелки, направление которой соответствует значению спинового квантового числа (условно "↑": s=+1/2; "↓": s=-1/2).
Так, для атома азота электронографическая формула имеет вид:
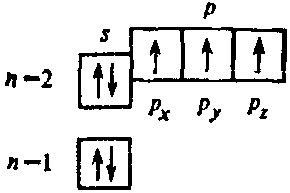
Для 5-ти валентных электронов атома N можно записать следующие наборы квантовых чисел (эту запись удобно представлять в виде таблицы):
№ е |
n |
l |
m |
s |
1 |
2 |
0 |
0 |
+1/2 |
2 |
2 |
0 |
0 |
-1/2 |
3 |
2 |
1 |
+1 |
+1/2 |
4 |
2 |
1 |
0 |
+1/2 |
5 |
2 |
1 |
-1 |
+1/2 |
Полностью или наполовину заполненный подуровень отличается повышенной устойчивостью. Для некоторых атомов, например, Cr и Cu, в связи с небольшой разницей в энергии 3d- и 4s-АО наблюдается “проскок” электрона, т.е. более выгодными оказываются конфигурации:
Cr: [Ar]3d54s1 (вместо [Ar]3d44s2),
Cu: [Ar]3d104s1 (вместо [Ar]3d94s2).
Учение о строении атома является теоретическим обоснованием периодического закона, сформулированного в 1869 г. Д.И. Менделеевым: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от атомных весов элементов. Не вдаваясь в историю открытия закона, отметим, что Д.И. Менделеев считал основной фундаментальной характеристикой элемента его атомную массу. Позже, в 1913 г., английский физик Мозли определил заряды ядер атомов элементов и установил, что порядковый номер элемента в периодической системе соответствует заряду его ядра. Таким образом, оказалось, что основной характеристикой атома является заряд ядра. Вследствие этого в формулировку периодического закона были внесены изменения: свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядер атомов элементов.
Причина периодичности свойств элементов стала понятна только после определения электронного строения атома. Она заключается в сходстве конфигураций внешних электронных орбиталей атомов в невозбужденном состоянии и определяется периодичностью повторения строения внешних электронных уровней. Так, атомы галогенов (F, Cl, Br, I, At), обладающие сходными химическими свойствами, имеют на внешнем электронном уровне семь электронов (ns2np5), щелочные металлы (Li, Na, K, Rb, Cs, Fr) – один электрон (ns1).
Периодическая система элементов является графическим выражением периодического закона. Самое ценное ее свойство заключается в том, что она отражает строение атома любого химического элемента.
Элементы располагаются в таблице в порядке возрастания заряда ядра. Вертикальные столбцы элементов называют группами, а горизонтальные ряды – периодами. Каждая группа подразделяется на две подгруппы – главную и побочную, их обозначают соответственно А и В.
Периоды объединяют элементы, в атомах которых происходит последовательное заполнение одинаковых электронных уровней. Номер периода совпадает с количеством уровней в электронной оболочке атома и со значением главного квантового числа внешнего электронного уровня. Число элементов в периоде соответствует количеству электронов, необходимых для заполнения внешнего электронного уровня.
№ периода |
Число уровней в электронной оболочке атома |
Число заполняемых орбиталей на внешнем уровне |
Элементы |
Кол-во элементов в периоде |
I |
1 |
1 (1s) |
H, He |
2 |
II |
2 |
4 (2s-1АО 2p-3АО) |
Li, Be, B, C, N, O, F, Ne |
8 |
III |
3 |
4 (3s-1АО 3p-3АО, 3d- пустой) |
Na, Mg, Al, Si, P, S, Cl, Ar |
8 |
Различие в энергетической последовательности заполнения внешних и более близких к ядру электронных уровней объясняет причину различной длины периодов: 1-й период содержит 2 элемента, 2-й и 3-й – по 8 элементов, 4-й и 5-й – по 18 элементов,
6-й – 32 элемента.
В вертикальных колонках периодической системы находятся группы элементов, атомы которых имеют одинаковое количество электронов на внешнем (валентном) уровне.
Например, у элементов V группы на внешнем уровне пять электронов: N (2s22p3), P (3s23p3), As (4s24p3), Sb (5s25p3), Bi (6s26p3).
По типу валентных орбиталей все элементы делятся на электронные семейства. Элементы, имеющие конфигурацию внешних орбиталей ns1 и ns2, образуют s-семейство. Элементы, у которых происходит заполнение внешнего p-подуровня, объединяют в p-семейство. Элементы с заполняющимися (n-1)d- и (n-2)f-орбиталями образуют соответственно d- и f-семейства.
Элементы s- и p-семейств составляют главные подгруппы периодической системы, их атомы имеют валентные электроны только на внешнем уровне. Элементы d- и f-семейств образуют побочные подгруппы. Элементы побочных подгрупп называют переходными.
У атомов элементов побочных подгрупп валентными являются электроны не только внешнего, но и предвнешнего уровня. Например:
S и Cl – элементы главных подгрупп: VIА и VIIА соответственно. Валентные электроны атомов S (3s23p4 – шесть электронов) и Cl (3s23p5 – семь электронов) расположены на внешних уровнях.
Cr и Mn – элементы побочных подгрупп: VIB и VIIB соответственно, валентные электроны Cr (3d54s1 – шесть электронов) и Mn (3d54s2 – семь электронов) находятся на внешнем (4s) и предвнешнем подуровнях (3d).
Свойства атомов, хотя и в значительно меньшей степени, но зависят от строения второго снаружи (предвнешнего) уровня, причем влияние структуры предвнешнего уровня тем сильнее, чем меньше электронов на самом внешнем уровне.
Cравним элементы главной и побочной подгрупп VI группы между собой и с характеристическим элементом – серой (табл. 2).
Сопоставление структур электронных оболочек атомов элементов при характерных для них степенях окисления показывает, что в группах периодической системы наблюдается два вида аналогии. В одном из них рассматриваемые элементы имеют однотипные структуры внешних электронных оболочек при любой заданной степени окисления, такие элементы называют полными электронными аналогами. К ним относятся Se и Te. В другом случае однотипность структур наблюдается лишь при некоторых степенях окисления. Таковы, например, по отношению к сере элементы подгруппы Se. Элементы подгруппы Cr также являются полными электронными аналогами по отношению друг к другу. Но в высшей степени окисления (+6) электронными аналогами будут являться сера и элементы подгруппы Cr, имеющие 8е- на внешнем уровне.
Таблица 2
