
- •Розділ 1. Поняття, класифікація, будова та біологічна роль гетероциклічних сполук
- •Поняття та класифікація
- •Класифікація гетероциклічних сполук.
- •Фізичні та хімічні властивості гетероциклів
- •Будова гетероциклічних сполук
- •Розділ 2. Ароматичні гетероциклічні сполуки
- •2.2. Порфірини
- •2.3. П'ятичленні гетероцикли з декількома гетероатомами
- •2.4. Шестичленні гетероцикли з одним гетероатомом
- •При атаці электрофила по (- або (-положению виникає украй нестійкий катіон тоді як при атаці по (-положению він не особливо нестійкий:
- •Розділ 3. Ароматичні з'єднання з конденсуючими ядрами
- •Висновки
- •Список використаних джерел:
При атаці электрофила по (- або (-положению виникає украй нестійкий катіон тоді як при атаці по (-положению він не особливо нестійкий:

Дуже нестійкий

Нестійкий

(6)
(7)
Найбільше значення для піридину мають реакції нуклеофильного заміщення. При нагріванні піридину з амидом натрію утворюється
2-аминопиридин (реакція Чичибабина) :

(9)
2-Аминопиридин (- ((-аминопиридин)
Реакція проходить по наступному механізму:
 (_(М
1)
(_(М
1)

На практиці гідрид натрію далі реагує з (-аминопиридином даючи натрієве похідне амінопіридину:
 (10)
(10)
Збільшення води вивільняє (-амінопиридин:
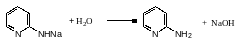
(11)
Сумарно:
(13)
Взаємодія піридину з лугом призводить до утворення 2-гидрокси-пиридина, існуючого, як і (-аминопиридин, в двох таутомерних формах:

(14)
2-Піридинол 2-Піридинон
Пиридиновое, як і бензолове кільце стійке до окислення. Усе три
(, ((і () піколіну окислюються перманганатом калію в пиридинкарбоновые
(, ((і (-пиколиновые) кислоти:
 (17)
(17)
Нікотин може бути окислений в нікотинову кислоту:

(18)
Нікотин Нікотинова кислота
Нікотинову кислоту (вітамін Р) синтетично отримують за наступною схемою:
 (19)
(19)
-(-Пиридинсульфокислота Нікотинова кислота
Піридин відновлюється легше за бензол. Наприклад, натрієм в спирті він відновлюється в піперидин:
ХІНОЛІН. Хінолін і його гомологи містяться в кам'яновугільній смолі. Існує багато синтетичних методів отримання хіноліну. З них найширше використовуваним є метод Скраупа. По методу Скраупа хінолін отримують нагріванням аніліну з гліцерином в концентрованій сірчаній кислоті у присутності м'яко діючого окисника, такого як нітробензол:

(21)
Реакція проходить по наступному механізму:
 ( _ (М 2)
( _ (М 2)






За властивостями хінолін дуже нагадує піридин. Він вступає в реакції електрофільного заміщення. Ці реакції протікають легше чим у разі піридину і здійснюються по бензоловому кільцю:
 (22)
(22)
 (23)
(23)
Реакції нуклеофильного заміщення протікають навпаки по пиридиновому кільцю, причому для амино-, що утворюються, і оксихинолинов можлива таутомерія:

(24)

(25)
Розділ 3. Ароматичні з'єднання з конденсуючими ядрами
Два ароматичні кільця, що мають два загальні вуглецеві атоми називаються такими, що конденсують. Простий представник ароматичних з'єднань з двома ядрами, що конденсують, - нафталін.

Існують ароматичні з'єднання з трьома ядрами, що конденсують, - антрацен, фенантрен. Ми з вами розглянемо хімію простого і найбільш важливого з ароматичних вуглеводнів, що конденсують, - хімію нафталіну.
Нафталін - біла кристалічна речовина з Т пл. 800С, Т кіп. 2180С, легко переганяється, має характерний запах.
Положення вуглецевих атомів в нафталіновій системі позначаються таким чином:

Ізомерія, номенклатура
Для монозаміщеного нафталіну можливі два ізомери -( і -(.

Для дизамещенных можливо вже 10 ізомерів. По систематичній номенклатурі місце розташування заступників означають цифрами. Для деяких дизамещенных збереглися і назви по раціональній номенклатурі.

Структура нафталіну
Ще в 1868 р. були отримані дані, згідно з якими нафталін містить два еквівалентних сконденсованих бензолових кільця, таких, що лежать в одній площині.
Будова нафталіну була доведена за схемою:

Таким чином, було встановлено, що обидва кільця є бензоловими. Згідно з експериментальними даними нафталін за своїми властивостями відноситься до ароматичних з'єднань. З теоретичної точки зору нафталін має структуру, необхідну для того, щоб бути ароматичним з'єднанням, : він містить плоскі шестичленні кільця і розгляд атомних орбіталей показує, що його структура допускає утворення (-облаков, що містять 6 електронів - ароматичний секстет. Десять атомів вуглецю розташовано по кутах двох зчленованих шестикутників. Кожен атом вуглецю пов'язаний з трьома іншими атомами (-связями. Оскільки вони утворюються при перекриванні тригональных sp2 -орбиталей, то усі атоми вуглецю і водню лежать в одній площині. Вище і нижче за цю площину знаходиться ( хмара, що утворюється в результаті перекривання р-орбиталей, має форму вісімки. Рентгеноструктурный аналіз показав, що в нафталіні довжина С-С зв'язків різна. Енергія сполучення 61 ккал/міль.

Способи отримання
Промисловим джерелом отримання нафталіну є кам'яновугільна смола і продукти піролізу нафти (фр. 180-2300)
Синтетично нафталін може бути отриманий:
а) при пропусканні пари бензолу і ацетилену над нагрітим вугіллям при 4000С

б) дегідрогенізацією гомологів бензолу, що містять в бічному ланцюзі не менш 4-х атомів вуглецю

в) із стирилуксусной кислоти

г) різні варіанти диєнового синтезу

Хімічні властивості
Нафталін є ароматичним з'єднанням, за своїми властивостями багато в чому нагадує бензол. Нафталін стійкий до реакцій приєднанням, характерним для ненасичених сполук. Проте ця стійкість проявляється у меншій мірі, чим для бензолу. Нафталін менш ароматний і більш неграничний, ніж бензол.
Для нафталіну типові реакції електрофільного заміщення. (-Электронное хмара є джерелом електронів, доступних для електрофільного реагенту, який приєднується до кільця з утворенням проміжного карбониевого іона, при відщепленні від якого протона відновлюється ароматична система.
Слід зазначити, що зв'язки 1,2 більш схожі на подвійних, чим 2,3. Зв'язки 1,2 і 3,4 в нафталіні в деякій мірі аналогічні зв'язаній системі в 1,3-бутадиене. Це знаходить віддзеркалення як в певній активності (-положений до електрофільних реагентів, так і в реакціях приєднання, характерних для диєнових вуглеводнів. При вступі електрофільного реагенту в (-положение що виникає проміжний (-комплекс більш енергетично вигідний порівняно з (-комплексом, що утворюється при атаці (-положения.

Нафталін вступає в реакції заміщення легше бензолу. При цьому заступники майже завжди вступають в (-положение.
При нітрації нафталіну азотною кислотою в суміші з H2SO4 при 50-600 утворюється майже виключно (-нитронафталин.

Хлорування і бромування нафталіну протікає дуже легко і не вимагає каталізатора

Найбільш важливою реакцією є сульфування, на напрям заміщення чинить вплив температура.

Ця реакція не є ізомеризацією, а протікає через стадію десульфування.
Ацилування по Фриделю-Крафтсу залежно від розчинника призводить до ( або ( ізомеру.

Реакції приєднання до нафталіну протікають легше, ніж у разі бензолу. Відновлення нафталіну здійснюється звичайними відновниками

Каталітичне гідрування призводить до утворення суміші тетраліну і декаліну.
Окислення нафталіну киснем повітря у присутності V2O5 призводить до руйнування одного кільця.

Обережне окислення нафталіну і його гомологів призводить до втрати ароматної з утворенням хинонов (на відміну від гомологів бензолу)

Орієнтація SЕ в нафталіні
Як і у разі ряду бензолу, заступники в нафталіновому кільці чинять вплив на вступ електрофільної частки Крім того робить вплив і різна реакційна здатність ( і ( положень нафталінового кільця.
Электроннодонорный заступник в (-положении орієнтує новий заступник в те ж кільце в положення 4.

Якщо такий заступник знаходиться в (-положении, то орієнтація в орто положення

Якщо в одному з кілець знаходиться електроноакцепторний заступник, то таке кільце дезактивувалося до електрофільного заміщення і нова електрофільна частка вступає в друге кільце

Нафтоли
При сплаві відповідних сульфокислот з лугом утворюються нафтоли.

Нафтоли можна отримувати з нафтиламинов прямим гідролізом (на відміну від ряду бензолу)

-(-Нафтиламин отримують з (-нафтола по реакції Бухерера

-(-Нафтиламин отримують відновленням (-нитронафталина

Антрацен і фенантрен
Джерелом отримання антрацену є кам'яновугільна смола

За своїми властивостями відносяться до ароматичних з'єднань. Молекули плоскі. Характерна ще більша неграничність, чим для нафталіну. Найбільш активними є положення 9, 10. Легко приєднують H2, BF2, малеїновий ангідрид по цих положеннях. Антрацен і фенантрен ще менш стійкі до реакцій окислення і відновлення, ніж нафталін. Окислюються до 9,10-хинонов, відновлюються до 9,10-дигидропроизводных.
Обидва з'єднання легко вступають в реакції електрофільного заміщення, частіше з утворенням суміші ізомерів або полизамещенных. Похідні, за мало чим виключенням, отримують іншим шляхом. Бромування проходить в положення 9 (зазвичай реакція супроводжується приєднанням). Антрацен використовується для синтезу антрахінону.
Найбільш важливими з похідних антрацену є антрахиноны, що є барвниками. Сам антрахінон може бути отриманий при окисленні антрацену

чи циклізацією

Фенантрен, так само як і антрацен легко приєднує в положення 9, 10 H2, BF2. Ці ж положення активніші для електрофільної атаки і легше піддаються дії кисню.

Аналогічно протікають реакції для фенантрену.
Реакція електрофільного заміщення протікає в положення 9, 10 по звичайному двохстадійному механізму. Але як правило реакція приєднання

Стабільність карбониевого іона можлива як за рахунок відщеплення протона, так і за рахунок приєднання частки.
Сам фенантрен застосування не знайшов. Проте похідні його містять скелет фенантрену, що повністю або частково гідрується, широко поширені в тварині і рослинному світі (стероїди, алкалоїди, гормони).
У міру збільшення числа циклів зменшується стійкість до реакцій приєднання, знижується ароматна.
Багатоядерні привертають увагу тим, що можуть стати сировиною для аніліно-фарбової промисловості та ін. З іншого боку деякі з них мають канцерогенну дію і посилено вивчаються у зв'язку з проблемою виникнення і профілактики раки.
Гексафенилетан
У 1900 р. Гомберг дією металами (Zn, Cu, Hg, Ag) на трифенилхлорметан вважав, що отримав ГФЭ.
![]()
Проте нині встановлено, що отриманий вуглеводень має структуру 1 -(дифенилметилен) -4-трифенил-2,5-циклогексадиена

безбарвна кристалічна речовина з т. пл. 2310С, легко вступає в реакції Na, I2, O2.

У розчинах це з'єднання частково диссоціює на вільні радикали, що призводить до зміни безбарвного забарвлення на жовту.

Уперше існування стійкого трифенилметильного радикала було виявлене Гомбергом при рішенні задачі синтезу ГФЭ по реакції Вюрца. Наявність вільних радикалів в розчині встановлена за парамагнітними властивостями цих часток, де спін електрона, що не компенсується, створює магнітне поле навколо вільного радикала.
Фактично з O2, I2 і Na взаємодіють не ГФЭ, а саме радикал трифенилметил. Для дисоціації СН3-СН3 вимагається 85 ккал/міль, а для #003С-С#013 потрібне всього 12 ккал/міль. Причина пониження енергетичного рівня пов'язані з високою стійкістю #023С, яка викликана тим, що неспарений електрон не концентрується на атомі вуглецю, а розосереджений по усіх бензолових ядрах завдяки сполученню. Ця причина стійкості радикала - головна. Проте є і друга - рекомбінація радикалів перешкоджають просторові утруднення.
