
Введение
Углекислотная («сухая») конверсия метана в синтез-газ СО + Н2 - одна из важнейших химических реакций, пригодная для промышленного получения водорода и дающая начало синтезу углеводородов и других технически ценных продуктов. Получаемый в составе синтез-газа водород используется в различных химико-технологических процессах, в том числе как восстановитель . Водород является также одним из перспективных видов моторного топлива.
При углекислотной конверсии получается синтез – газ состава 1:1. Газ такого состава нужен , например , для гидроформилирования, получения поликарбонатов или формальдегида .
Изучение взаимодействия CH4 с СО2 интересно также с точки зрения вовлечения в практику такого неисчерпаемого источника сырья, как диоксид углерода , запасы которого только в атмосфере составляют 7*10 11 т .
2. Цель и задачи работы
Основная цель курсовой работы при помощи полученных знаний по курсу «Общая химическая технология», с использованием научной литературы и аппаратного программного обеспечения изучить термодинамику , кинетику и механизм углекислотной конверсии, а так же физико-химические свойства катализаторов , используемых в промышленности.
Основные задачи:
Анализ влияния соотношения реагентов( CO2 и CH4) на
1.Равновесный выход CO и H2
2.Движущую силу и скорость углекислотной конверсии .
1.Аналитический обзор
1.1 Термодинамика
Углекислотная конверсия метана – эндотермическая реакция.
CH 4 +2 CO 2 =H2 + CO2 (1)
∆Н = +247 кДж/моль
На рис.1 показаны зависимости равновесных селективностей по СО и Н2 и конверсии СН4 от температуры при давлении 0,1 и 2 МПа. Из графика видно, что селективности и конверсии , близкие к 100% достигаются при температурах 1000-1100°С.
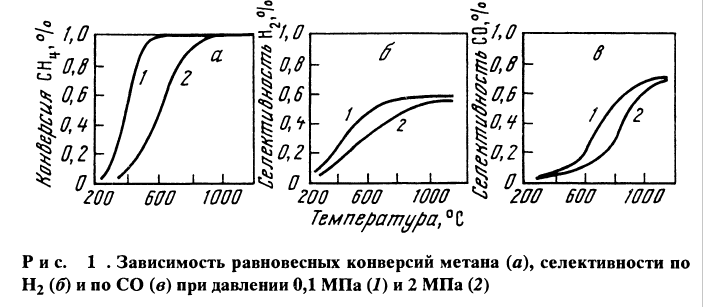
Величина ∆G=0 имеет место при 640 °С . Ниже этой температуры равновесие сдвинуто в сторону исходных веществ CH 4 +2 CO 2 , то есть происходит метанирование CO .
Кроме основной реакции (1) в смеси протекают реакции c образованием углерода:
CH 4 +2 CO 2 =C + 2CO + 2H2O ∆Н=641 кДж/моль (2)
Возможны также следующие реакции:
CH 4 +3 CO 2 = 4CO + 2H2O ∆Н=330,6 кДж/моль (3)
CH 4 +2 CO 2 = C2H6+CO + H2O ∆Н = 16,7 кДж/моль (4)
Все рассмотренные реакции также эндотермические и протекают при высоких температурах . Например при Т=800°С ∆G реакции (2) и (3) отрицательной . Опытное значения константы углекислотной конверсии выражается формулой :
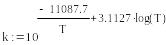
Константы равновесия углекислотной конверсии при различных температурах представлены в таблице:


1.2 Кинетика и механизм углекислотной конверсии метана
Первой работой по кинетике углекислотной конверсии метана была работа, выполненная в лаборатории М.И. Темкина .Основываясь на схеме :
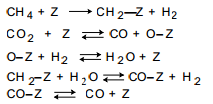 где
Z
– активный центр
где
Z
– активный центр
Было показано, что в случае протекания процесса на никелевой фольге при 800-900 °С реакция описывается таким же кинетическим уравнением, что и паровая конверсия на этом же катализаторе:
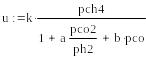
Где a, b и k – константы , pch4, pco2,pco,ph2- парциальные давления метана , углекислого газа, CO и водорода соответственно. Причем в зависимости от температуры a и b принимают различные значения , так при 1070 K a=0.5, b=2; а при 1170 K a=0.2 , b=0 .
В большинстве предлагаемых механизмов углекислотной конверсии метана рассматривается диссоциативная адсорбция CH4 и СО2.Предполагается последовательная диссоциация СН4 на поверхности с образованием частиц СНх и С и их взаимодействие с адсорбированным атомом О. Эти процессы отражает схема:
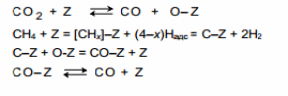
Диоксид углерода может также непосредственно реагировать с поверхностным углеродом по реакции, обратной реакции Будуара :
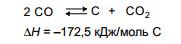
Для процесса на катализаторе Ni/Al2O3 было получено уравнение простое уравнение:
![]()
Исследование кинетики углекислотной конверсии метана на Ni/SiO2 при 700°С и атмосферном давлении позволило получить следующие данные: реакция первого порядка по pСО2 и по pН2, с ростом pСН4 скорость реакции быстро увеличивается и достигает насыщения.
Для описания кинетики предложена следующая схема :
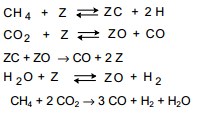
Где лимитирующей стадией является поверхностное взимодействие адсорбированных атомов углерода и кислорода .
Значения энергии активации Еа изменяются в интервале: по расходованию CH4 и CO2 соответственно от 30 до 350 кДж/моль и от 35 до 130 кДж/моль, по выходу CO и H2 соответственно от 38 до 218 кДж/моль и от 38 до 250 кДж/моль. Наиболее выпадающие значения ЕСН4 относятся к реакции на Re/Al2O3 (350 кДж/моль) и Pt (73 кДж/моль). Большинство остальных данных для Ni-катализаторов находятся вблизи значения 239 ± 20 кДж/моль, которое довольно близко к энергии активации диссоциации СН4 на Ni(110) и Ni(111): 233 ± 27 и 221 кДж/моль.
