
- •Часть 1
- •1. Термодинамические параметры. Уравнение состояния идеального газа
- •2. Смеси идеальных газов
- •3. ТеплоЕмкость газов и газовых смесей. Внутренняя энергия и энтальпия идеального газа
- •4. Работа и теплота. Первый закон термодинамики
- •Второй закон термодинамики. Эксергия
- •Термодинамические процессы идеального газа
- •7. Влажный воздух
- •Задачи.
- •8. Термодинамические свойства и процессы воды и водяного пара
- •9. Истечение и дросселирование газов и паров
- •Ответ: фреон-22:
- •Поскольку в процессе адиабатического дросселирования , то потери располагаемой работы определятся разностью
- •10. Компрессоры
- •Библиографический список
- •Термодинамические свойства воды и водяного пара
- •Оглавление
- •1. Термодинамические параметры. 3
Второй закон термодинамики. Эксергия
Второй закон термодинамики определяет направление, в котором протекают процессы, устанавливает условия преобразования тепловой энергии в механическую, а также определяет максимальное значение работы, которая может быть произведена тепловым двигателем.
Математически второй закон термодинамики может быть выражен следующим образом:
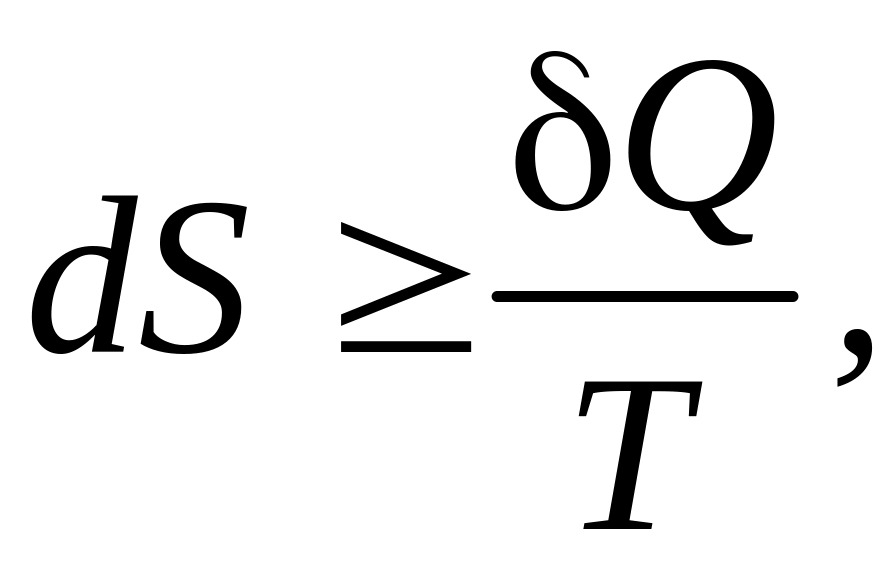 (5.1)
(5.1)
где
![]() – бесконечно малое приращение энтропии
системы;
– бесконечно малое приращение энтропии
системы;
![]() –
бесконечно
малое количество теплоты, полученное
системой от источника теплоты.
–
бесконечно
малое количество теплоты, полученное
системой от источника теплоты.
Знак равенства соответствует обратимым процессам, знак неравенства – необратимым. Чем выше степень необратимости процессов, тем сильнее возрастание энтропии.
Первый и второй законы термодинамики для обратимых процессов могут быть записаны совместно в виде термодинамических тождеств:
![]() ; (5.2)
; (5.2)
![]() . (5.3)
. (5.3)
Эксергия системы – это максимальная работа, которую может совершить система при переходе в состояние равновесия с окружающей средой. Эксергетический анализ работы теплоэнергетических и технологических установок учитывает не только количественные, но и качественные характеристики энергоресурсов в различных элементах установок, а также необратимость протекающих в них процессов.
Эксергия
тепла
термодинамического процесса
![]() ,
Дж находится как
,
Дж находится как
 , (5.4)
, (5.4)
где Q – теплота термодинамического процесса, Дж;
![]() –
изменение
энтропии рабочего тела, Дж/К;
–
изменение
энтропии рабочего тела, Дж/К;
Т0 – температура окружающей среды, К.
Эксергия
является экстенсивной функцией состояния,
поэтому удельная
эксергия тепла
![]() ,
Дж/К определяется как
,
Дж/К определяется как
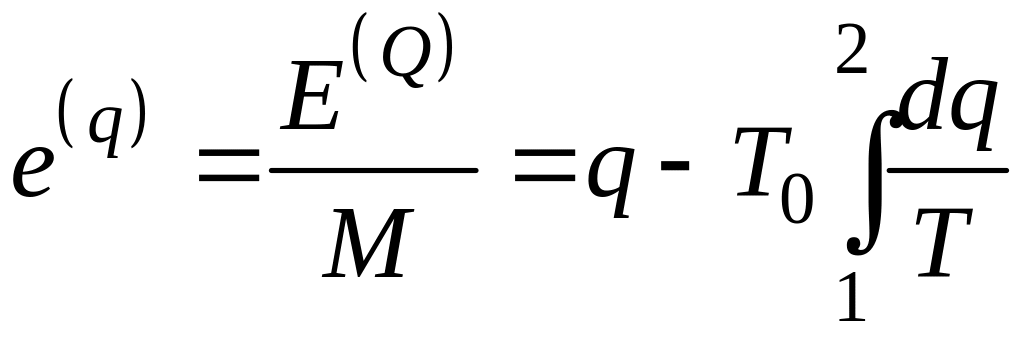 . (5.5)
. (5.5)
Графически
удельная эксергия тепла представлена
на рис 5.1. Общая площадь под кривой
процесса 1–2 соответствует количеству
удельной теплоты процесса q.
Она состоит из эксергии тепла процесса
(площади, заштрихованной вертикальными
линиями) и неработоспособной части
тепла
![]() (площади,
заштрихованной горизонтальными линиями).
(площади,
заштрихованной горизонтальными линиями).

Рис. 5.1. Эксергия тепла термодинамического процесса
Потери
работоспособности
![]() (эксергетические
потери) за
счет необратимости процессов, протекающих
в системе, определяются по формуле
Гюи-Стодолы
(эксергетические
потери) за
счет необратимости процессов, протекающих
в системе, определяются по формуле
Гюи-Стодолы
![]() , (5.6)
, (5.6)
где
![]() – полное приращение энтропии всех
подсистем, входящих в данную систему.
– полное приращение энтропии всех
подсистем, входящих в данную систему.
Если
в исходном состоянии термодинамическая
система имеет параметры U,
S,
V,
а в конечном – находится в равновесии
с окружающей средой и имеет параметры
![]() ,
то эксергия
неподвижной термодинамической системы
E
определяется как
,
то эксергия
неподвижной термодинамической системы
E
определяется как
![]() , (5.7)
, (5.7)
а удельная эксергия e неподвижной системы как
![]() , (5.8)
, (5.8)
где
![]() – параметры окружающей среды.
– параметры окружающей среды.
Для неподвижной системы, совершающей некоторый обратимый процесс 1–2, максимальная работа равна убыли эксергии:
![]() . (5.9)
. (5.9)
Тогда для необратимого процесса уравнение баланса эксергии примет вид
![]() , (5.10)
, (5.10)
то есть при переходе из состояния 1 в состояние 2 эксергия системы расходуется на совершение работы L, а часть работоспособности теряется из-за необратимости процессов.
При
нахождении эксергии потока вещества в
форме Лагранжа система координат
движется вместе с потоком. Если начальные
параметры потока H,
S,
а конечные соответствуют состоянию
равновесия потока с окружающей средой
![]() ,
то выражение для эксергии
потока в форме Лагранжа
,
то выражение для эксергии
потока в форме Лагранжа
![]() имеет вид
имеет вид
![]() , (5.11)
, (5.11)
а
для удельной эксергии потока
![]() :
:
![]() . (5.12)
. (5.12)
Максимальная внешняя работа совершается за счет убыли эксергии потока
![]() . (5.13)
. (5.13)
Эксергетические потери находятся также по формуле Гюи-Стодолы
![]() , (5.14)
, (5.14)
тогда уравнение баланса эксергии потока имеет вид
![]() . (5.15)
. (5.15)
Задачи
5.1. Вычислить эксергию тепла изобарного процесса нагрева воздуха от температуры 20 оС до температуры 900 оС, если теплоемкость воздуха ср = 1 кДж/кг, а температура окружающей среды 15 оС.
Решение
Эксергия тепла термодинамического процесса определяется в соответствии с (5.5) как
![]() .
.
Подставив в это уравнение выражения для количества теплоты и изменения энтропии в изобарном процессе:
 ,
,
получим

5.2. Вычислить эксергию потока водяного пара в форме Лагранжа, если водяной пар находится при давлении 50 бар и температуре 500 оС. Давление окружающей среды 1 бар, температура 27 оС.
Решение
Эксергия потока в форме Лагранжа находится в соответствии с (5.12):
.
Энтальпия и энтропия водяного пара находятся по табл. П.2.2.
– при давлении 50 бар и температуре 500 оС:
![]() ;
;
– при параметрах окружающей среды (давлении 1 бар и температуре 27 оС):
![]() .
.
Тогда эксергия потока водяного пара
![]() .
.
5.3. В регенеративном теплообменнике воздух с начальной температурой 50 оС изобарно нагревается дымовыми газами, поступающими в теплообменник с температурой 700 оС и изобарно охлаждающимися до температуры 200 оС. Расход воздуха 200 кг/с, расход дымовых газов 100 кг/c. Теплоемкости воздуха и дымовых газов 1,0 кДж/(кг∙К) и 1,2 кДж/(кг∙К) соответственно. Температура окружающей среды 27 оС. Вычислить эксергии тепла горячего и холодного теплоносителей в теплообменном аппарате, эксергетические потери и эксергетический КПД теплообменного аппарата. Тепловыми потерями пренебречь.
Ответ:

5.4. Вычислить эксергию углекислого газа CO2, имеющего параметры p = 10 бар, T = 600 К, по отношению к окружающей среде с параметрами p0 = 1 бар, T0 = 293 К.
Ответ: е = 98,9 кДж/кг.
5.5. Определить потерю работоспособности воздуха при его дросселировании от давления p1 = 100 бар до давления p2 = 50 бар. Температура окружающей среды T0 = 300 К.
Решение
Потери работоспособности термодинамической системы определяются формулой Гюи–Стодолы (5.6):
.
Поскольку при дросселировании воздуха (идеального газа) температура его не изменяется, то будем иметь в расчете на 1 кг воздуха

5.6. Определить изменение работоспособности при переходе 1 кг азота N2 из состояния, определяемого давлением p1 = 10 бар и температурой T1 = 770 К, в состояние с параметрами p2 = 2 бар, T2 = 300 К. Параметры окружающей среды T0 = 283 К, po= 1 бар.
Ответ:![]()
5.7. Определить увеличение энтропии и уменьшение работоспособности при смешении 4 кг водорода H2 и 1 кг углекислого газа CO2, находившихся при одинаковых температурах и давлениях, причем полный объем смеси становится равным суммарному объему смешиваемых газов. Температура окружающей среды T0 = 293 К.
Решение
Формула для энтропии смешения двух различных идеальных газов при одинаковых температурах и давлениях приводится к виду

где
 – газовая постоянная,
– газовая постоянная,
![]() – молекулярная масса,
– молекулярная масса,
 – число киломолей.
– число киломолей.
Подставляя численные данные, получаем

Потери работоспособности
![]()
5.8. Как изменится максимальная работоспособность ΔLmax углекислого газа CO2, содержащегося в жестком теплоизолированном баллоне объемом V = 100 л при давлении p = 150 бар и температуре t = 27 оС, при его транспортировке с поверхности Земли на поверхность Венеры?
Параметры атмосферы на поверхности Земли: pЗ = 1 бар, tЗ = 27 оС. Параметры атмосферы на поверхности Венеры: pВ = 90 бар, tВ = 500 оС.
Ответ: увеличится на 520,2 кДж.
5.10. Определить максимальную работоспособность (эксергию) Е1, которую имеют 500 кДж тепла при температуре пламени в котельном агрегате t1 = 1500 оС. Определить, чему будет равна максимальная работоспособность Е2 того же количества теплоты, когда она будет передана влажному водяному пару в барабане котла при давлении p2 = 130 бар. Температура окружающей среды t0 = 20 оС.
Ответ: Е1 = 417,4 кДж, Е2 = 257,5 кДж.
5.11. В регенеративный теплообменник газотурбинной установки поступает воздух после компрессора с температурой tв1 = 140 оС, где он изобарно нагревается за счет продуктов сгорания, поступающих из турбины с температурой tг1 = 340 оС. В теплообменнике продукты сгорания изобарно охлаждаются до температуры tг2 = 210 оС. Определить потерю работоспособности тепла в регенеративном теплообменнике в результате необратимого теплообмена в расчете на 1 кг рабочего тела. Продукты сгорания обладают свойствами воздуха с постоянной теплоемкостью. Температура окружающей среды t0 = 20 оС. Тепловыми потерями пренебречь.
Ответ:![]()
