
- •Часть 1
- •1. Термодинамические параметры. Уравнение состояния идеального газа
- •2. Смеси идеальных газов
- •3. ТеплоЕмкость газов и газовых смесей. Внутренняя энергия и энтальпия идеального газа
- •4. Работа и теплота. Первый закон термодинамики
- •Второй закон термодинамики. Эксергия
- •Термодинамические процессы идеального газа
- •7. Влажный воздух
- •Задачи.
- •8. Термодинамические свойства и процессы воды и водяного пара
- •9. Истечение и дросселирование газов и паров
- •Ответ: фреон-22:
- •Поскольку в процессе адиабатического дросселирования , то потери располагаемой работы определятся разностью
- •10. Компрессоры
- •Библиографический список
- •Термодинамические свойства воды и водяного пара
- •Оглавление
- •1. Термодинамические параметры. 3
3. ТеплоЕмкость газов и газовых смесей. Внутренняя энергия и энтальпия идеального газа
Удельной теплоемкостью называется количество теплоты Q, которое необходимо сообщить единице количества вещества, чтобы изменить его температуру на один градус. В зависимости от способа измерения количества вещества различают:
– удельную массовую теплоемкость, Дж/(кг∙К):
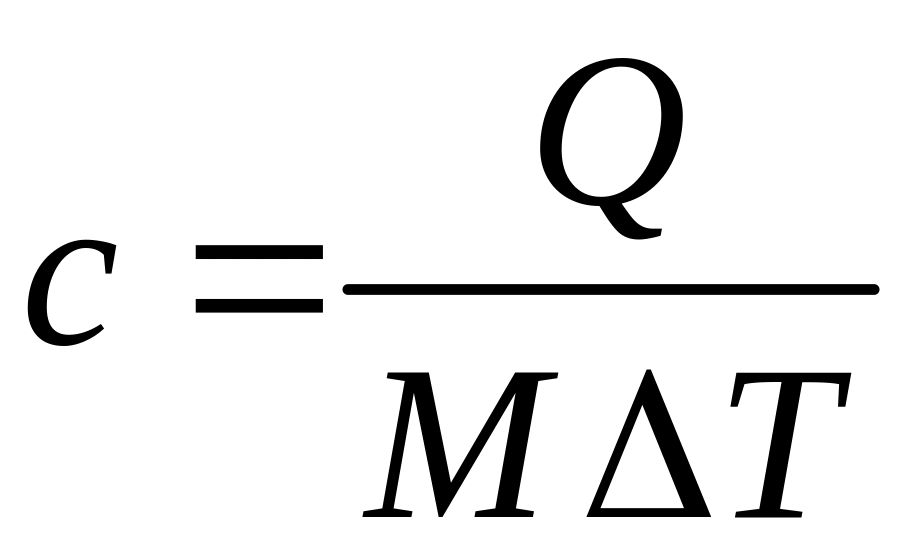 , (3.1)
, (3.1)
где М, кг – масса вещества;
– удельную объемную теплоемкость, Дж/(м3∙К):
 , (3.2)
, (3.2)
где V0 , м3 – объем вещества при нормальных физических условиях (см. разд.1);
– удельную мольную теплоемкость, Дж/(кмоль∙К):
 , (3.3)
, (3.3)
где N, кмоль – количество киломолей вещества.
Различные виды удельных теплоемкостей связаны между собой простыми соотношениями:
 , (3.4)
, (3.4)
где
![]() ,
кг/м3
– плотность газа при н.ф.у;
,
кг/м3
– плотность газа при н.ф.у;
μ, кг/кмоль – молекулярная масса газа.
В зависимости от характера термодинамического процесса подвода тепла различают теплоемкости при постоянном объеме сv и при постоянном давлении сp, связанные между собой формулой Майера
![]() , (3.5)
, (3.5)
где R, Дж/(кг ∙К) – газовая постоянная.
По
классической (молекулярно-кинетической)
теории теплоемкость газов не зависит
от температуры, а определяется только
количеством атомов в молекуле (числом
степеней свободы молекулы f):
 .
Определенные таким образом мольные
теплоемкости газов приводятся в табл.
3.1, массовые и объемные теплоемкости
рассчитываются по выражениям (3.4).
Полученные значения хорошо совпадают
с экспериментальными данными в области
комнатных температур.
.
Определенные таким образом мольные
теплоемкости газов приводятся в табл.
3.1, массовые и объемные теплоемкости
рассчитываются по выражениям (3.4).
Полученные значения хорошо совпадают
с экспериментальными данными в области
комнатных температур.
Отношение теплоемкостей
 (3.6)
(3.6)
называется показателем адиабаты, который для идеального газа также зависит только от количества атомов в молекуле (табл. 3.1).
Таблица 3.1
Значения мольных теплоемкостей газов по классической теории
Вид газа |
Число степеней свободы |
Показатель адиабаты |
Мольные теплоемкости, кДж/(кмоль∙К) |
|
|
|
|||
1-атомный |
3 |
1,67 |
12,47 |
20,79 |
2-атомный |
5 |
1,40 |
20,79 |
29,10 |
3-х и более атомный |
6 |
1,33 |
24,94 |
33,26 |
Эксперимент
показывает, что теплоемкости газов
заметно изменяются с температурой.
Истинной теплоемкостью газа при данной
температуре является величина
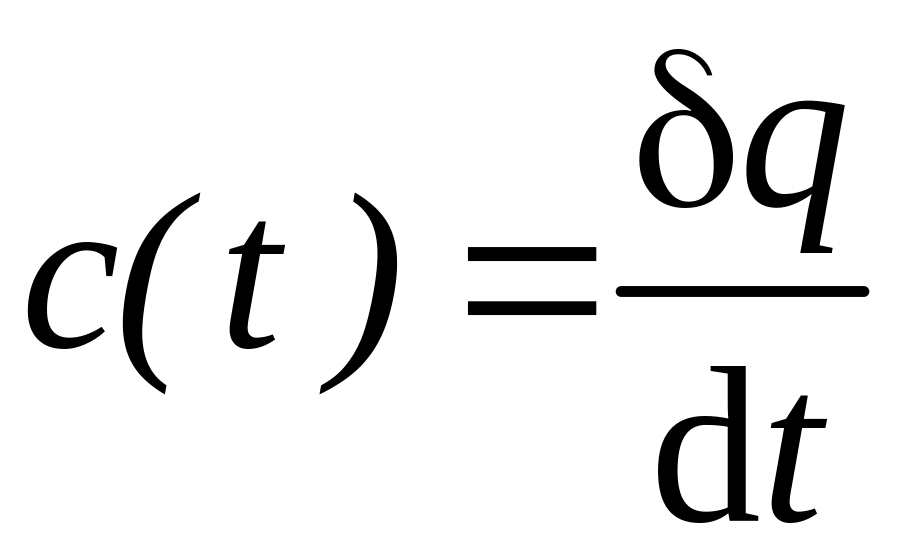 .
Тогда средняя теплоемкость газа в
интервале температур (
.
Тогда средняя теплоемкость газа в
интервале температур (![]() )
находится по формуле
)
находится по формуле
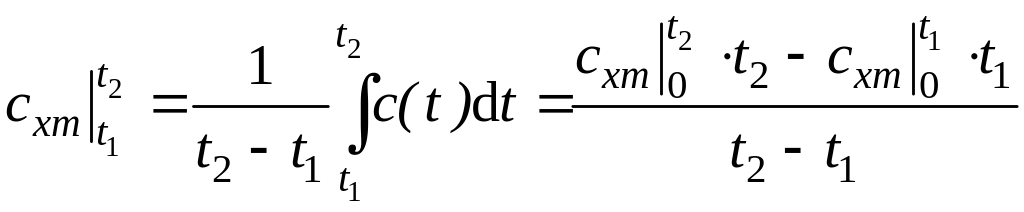 , (3.7)
, (3.7)
где
![]() – средние теплоемкости в интервалах
температур
– средние теплоемкости в интервалах
температур
![]() ,
,
![]() соответственно (берутся из таблиц –
см. прил.1);
соответственно (берутся из таблиц –
см. прил.1);
индекс x – обозначает характер процесса (p = const или v = const).
Средние массовая и объемная теплоемкости смеси газов находятся как
 , (3.8)
, (3.8)
где
![]() – соответственно массовые и объемные
доли компонентов смеси.
– соответственно массовые и объемные
доли компонентов смеси.
Внутренняя
энергия термодинамической системы
U,
Дж – это энергия, связанная с различными
формами движения и взаимодействия ее
структурных частиц (кинетическая
энергия движения молекул, потенциальная
энергия взаимодействия молекул и др.).
Удельная
внутренняя энергия
– это энергия, отнесенная к единице
массы системы
![]() ,
Дж/кг.
,
Дж/кг.
Внутренняя
энергия является однозначной функцией
состояния системы, т. е. зависит только
от параметров термодинамической системы,
например
![]() .
.
Для идеального газа внутренняя энергия зависит только от температуры и находится как:
![]() . (3.9)
. (3.9)
Энтальпия
– это энергия расширенной термодинамической
системы, включающей в себя саму систему
и окружающую среду (оболочку, удерживающую
систему в заданном объеме). Энтальпия
H,
Дж, и удельная
энтальпия
![]() ,
Дж/кг, определяются как:
,
Дж/кг, определяются как:
![]() ; (3.10)
; (3.10)
![]() . (3.11)
. (3.11)
Энтальпия
является однозначной функцией состояния
системы, т. е. зависит только от параметров
термодинамической системы, например
![]() .
.
Энтальпия идеального газа зависит только от температуры:
![]() . (3.12)
. (3.12)
В формулах (3.9), (3.12) теплоемкости газа при постоянном давлении ср и при постоянном объеме сv определяются либо методами молекулярно-кинетической теории по табл. 3.1, либо как средние теплоемкости в интервале температур от Т1 до Т2 по уравнению (3.7).
Задачи
3.1.
Найти среднюю удельную теплоемкость
cp
азота в интервале температур от 1000 оС
до 2000 оС,
если известно, что

Решение
Средняя теплоемкость в интервале температур от t1 до t2 вычисляется согласно формуле (3.7):

3.2. Найти объемную и массовую теплоемкости кислорода при постоянном объеме и постоянном давлении с использованием молекулярно-кинетической теории газов.
Решение
Согласно табл. 3.1 мольные теплоемкости двухатомных газов:
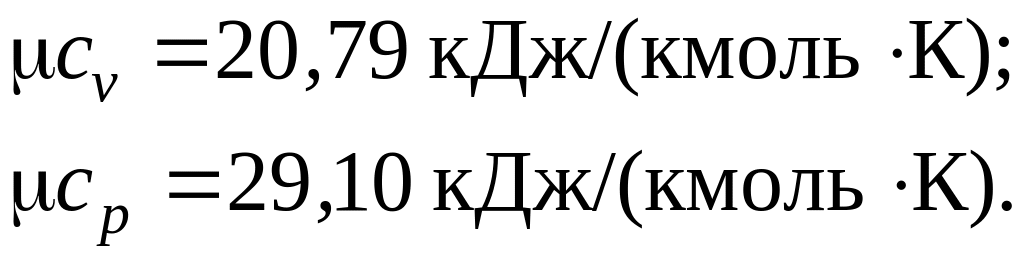
Тогда значения объемных и массовых теплоемкостей для кислорода с учетом (3.4):

3.3. Определить теплоту, необходимую для нагрева смеси газов массой 5 кг при постоянном давлении от температуры 40 оС до температуры 800 оС, если смесь газов имеет следующий массовый состав:. 20 % – азот N2; 80 % – углекислый газ CO2. При расчетах:
а) учесть зависимость теплоемкости от температуры;
б) теплоемкости cv и cp вычислить методами молекулярно- кинетической теории.
Сравнить полученные результаты, определив относительную погрешность в вычислении теплоты.
Решение
Количество теплоты для смеси идеальных газов находится по формуле
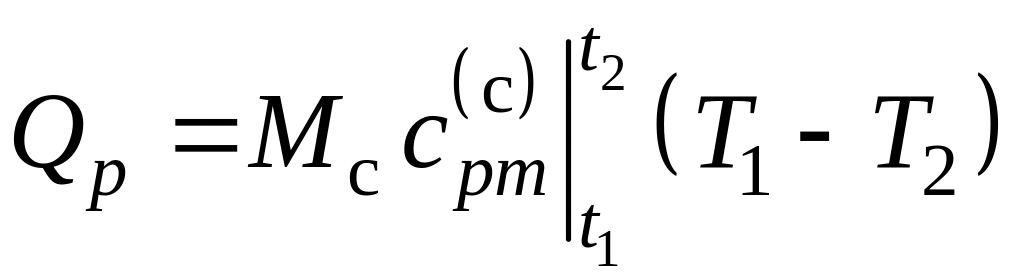 ,
где
,
где
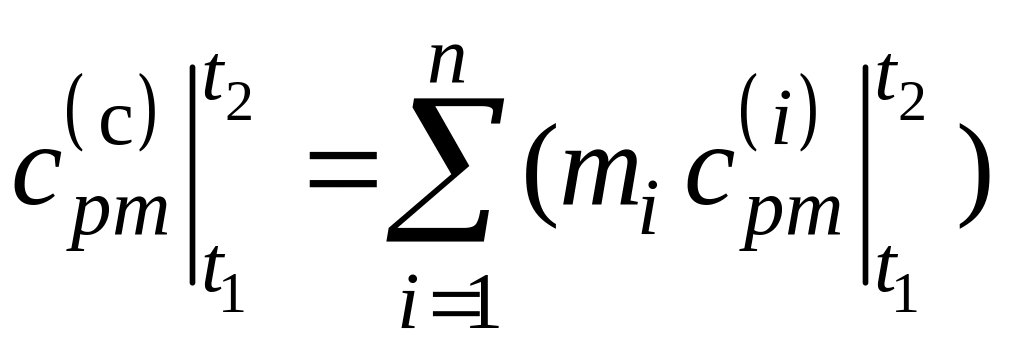 .
.
а) Найдем среднюю удельную теплоемкость каждого компонента смеси в интервале температур (40–800 оС) по формуле 3.7. Для этого необходимо определить средние теплоемкости в интервалах температур (0–40 оС) и (0–800 оС), используя таблицу прил.1.
Поскольку в таблице значения удельных теплоемкостей даются с интервалом 100 оС, теплоемкости в интервале температур (0–40 оС) определяем путем интерполирования. Тогда:
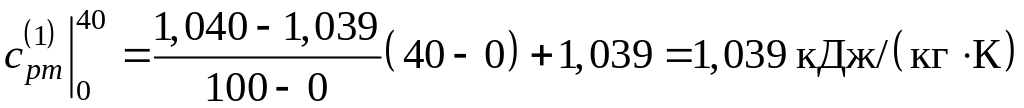 ;
;
 ;
;
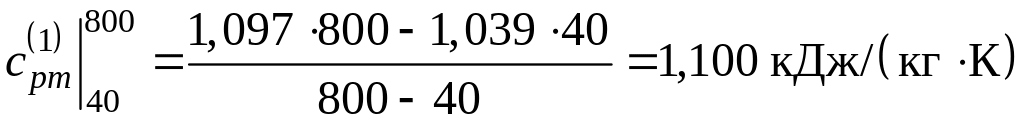 ;
;
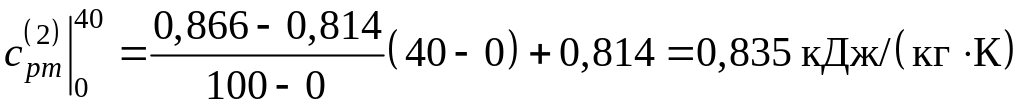 ;
;
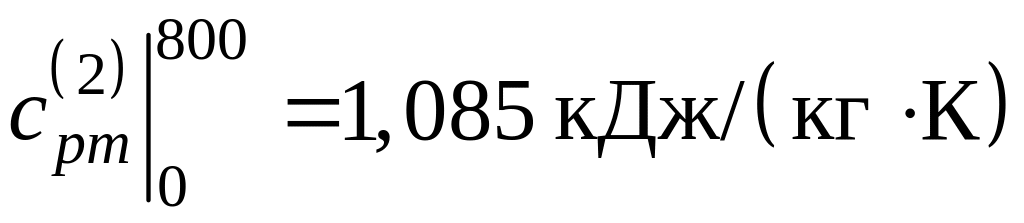 ;
;
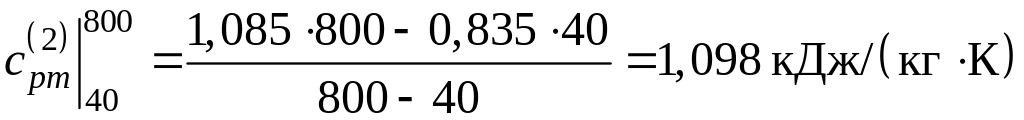 .
.
Смесь газов задана массовым составом, следовательно, массовые доли компонентов: m1 = 0,2 (азот); m2 = 0,8 (углекислый газ).
Тогда средняя удельная теплоемкость смеси газов при постоянном давлении в заданном интервале температур будет равна
 ,
,
а количество теплоты, необходимой для нагрева смеси газов,
![]() .
.
б) Для нахождения удельных массовых теплоемкостей компонентов смеси с помощью молекулярно-кинетической теории газов используем табл. 3.1. При этом учтем, что азот – двухатомный газ, а углекислый газ – трехатомный. Массовые теплоемкости:
 ;
;
 .
.
Средняя теплоемкость смеси и количество необходимой для нагрева теплоты в этом случае будут равны
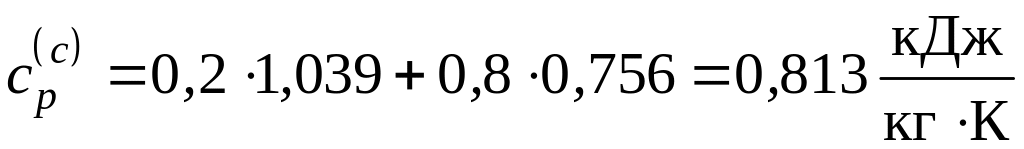 ;
;
![]() .
.
Относительная погрешность в вычислении количества теплоты
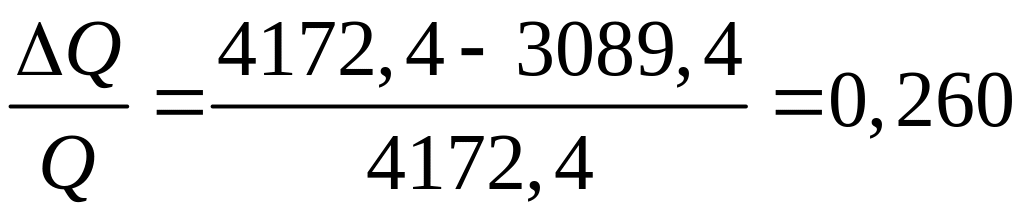 или
26 %.
или
26 %.
3.4. В объеме V1 = 200 м3 при температуре t1 = 100 оС и давлении p1 = 3 бар находится смесь идеальных газов заданного объемного состава: 60 % – азот; 40 % – кислород.
Определить теплоту, необходимую для нагрева смеси газов при постоянном объеме до температуры 500 оС.
Ответ: 173,5 МДж.
3.5. Воздух с температурой 80 оС образуется в результате смешения при постоянном давлении двух потоков: холодного воздуха с температурой 0 оС и горячего воздуха с температурой 900 оС. Определить, сколько горячего и холодного воздуха необходимо взять для получения 1 кг смеси. При расчете теплоемкостей не учитывать их зависимость от температуры.
Ответ: 0,917 кг холодного воздуха и 0,083 кг горячего воздуха.
3.6. Определить средние массовые и объемные теплоемкости при постоянном давлении и постоянном объеме смеси газов в интервале температур от 0 до 1300 оС, если смесь имеет следующий объемный состав: 8 % – двуокись углерода СО2; 2 % – окись углерода СО; 85 % – азот N2; 5 % – водород Н2.
Ответ:


3.7. Определить количество тепла, воспринятого воздухом в регенераторе газовой турбины от смеси газов заданного состава: СО – 2,1 %; СО2 – 12,3 %; SO2 – 1,8 %; N2 – 83,8 % (по массе). Смесь газов охлаждается в регенераторе при постоянном давлении p = 1,2 бар от температуры 427 оС до 120 оС. Расход газов при начальных условиях 12500 м3/ч. КПД регенератора 0,95.
Ответ: Q = 2,36 ГДж/ч.
3.8.
Определить
удельный объем и массовую теплоемкость
при постоянном объеме пара натрия при
давлении p
= 10 бар и температуре t
= 927 оС,
если известно, что при этих параметрах
пар натрия является смесью одно- и
двухатомных молекул следующего мольного
состава: rNa
= 0,8628,
![]() = 0,1372. Найти
парциальные давления одно- и двухатомных
паров натрия. Теплоемкости газов,
составляющих смесь, рассчитать согласно
молекулярно-кинетической теории.
Молекулярная масса натрия μNa
= 23 кг/кмоль.
= 0,1372. Найти
парциальные давления одно- и двухатомных
паров натрия. Теплоемкости газов,
составляющих смесь, рассчитать согласно
молекулярно-кинетической теории.
Молекулярная масса натрия μNa
= 23 кг/кмоль.
Ответ: v = 0,381 м3/кг; сv = 520,44 Дж/(кгК);
pNa
= 8,628 бар;
![]() =
1,372 бар.
=
1,372 бар.
3.9. Определить мольную изобарную теплоемкость воздуха при температурах t1 = 287 oC и t2 = 560 oC, если известна интерполяционная формула для истинной мольной теплоемкости воздуха
![]()
и среднюю мольную изобарную теплоемкость воздуха в интервале температур (t1 – t2).
Результаты сравнить с табличными данными.
Решение
Подставив значения температур t1 = 287 oC и t2 = 560 oC в интерполяционную формулу, получим значения истинных мольных теплоемкостей при данных температурах:

Тогда средняя мольная изобарная теплоемкость воздуха в интервале температур ( t1 – t2) определится как
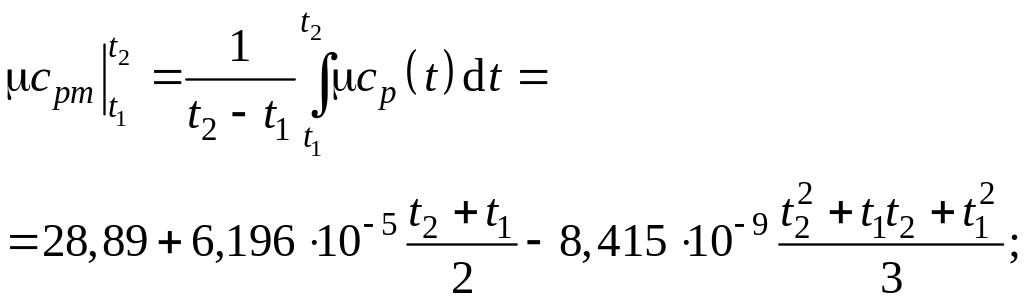
![]()
Рассчитанная с использованием таблиц прил.1 средняя теплоемкость воздуха в том же интервале температур, определяемая по формуле (3.7), оказывается равной
![]()
Расхождение результатов составляет 7,3 %.
3.10.
Определить тепловую мощность
![]() ,
необходимую для нагрева при постоянном
давлении p
= 1,2 бар смеси газов состава:
,
необходимую для нагрева при постоянном
давлении p
= 1,2 бар смеси газов состава:
![]()
от
t1
= 325 оС
до t2
= 800 оС.
Расход смеси по параметрам на входе
равен
![]() .
Вычислить также массовый расход смеси.
.
Вычислить также массовый расход смеси.
Ответ:
![]()
3.11.
Определить истинную изобарную массовую
теплоемкость кислорода при температуре
t
= 1000 оС,
если средняя теплоемкость в интервале
температур (0–t
оС)
задается интерполяционной формулой
![]()
Решение
Из определения средней теплоемкости в каком-либо интервале температур (3.8) следует, что

или

![]()
Используя правила дифференцирования определенного интеграла по переменному верхнему пределу, получаем
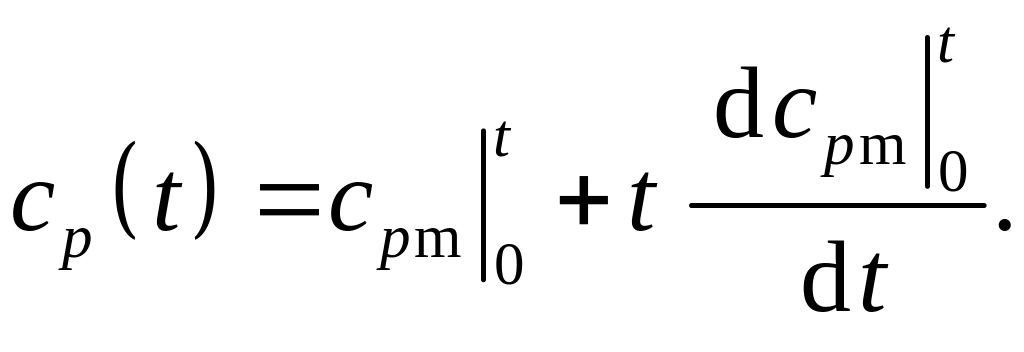
Вычисления дают:

3.12. Зависимость мольной изобарной теплоемкости газообразного фосфата кальция Ca3(PO4)2 от температуры выражается уравнением
![]() .
.
Найти значение мольной изобарной теплоемкости этого газа в интервале температур от 600 К до 900 К.
Решение
В соответствии с понятием определенного интеграла среднее значение теплоемкости в заданном интервале температур вычисляется как

Вычисления дают

3.13. В компрессоре газовой турбины сжимается воздух. Начальная температура воздуха t1 = 30 oC, температура после сжатия t2 = 150 oC. Определить изменение энтальпии и внутренней энергии воздуха в процессе сжатия, учитывая зависимость теплоемкости от температуры.
Ответ:
![]()
