
- •Теоретические основы теплотехники
- •1. Перечислить основные параметры, которыми характеризуется состояние рабочего тела
- •2. Объяснить, что такое идеальный газ
- •3. Перечислить основные законы идеального газа
- •4. Объяснить что такое теплоемкость
- •5. Дать определения внутренней энергии и энтальпии газа
- •6. Назовите первый закон термодинамики
- •7. Перечислить основные термодинамические процессы
- •Политропный процесс
- •8. Объяснить, что такое обратимый и необратимый термодинамический процесс
- •9. Изобразить график и охарактеризовать изобарный процесс Изобарный процесс
- •10. Изобразить график и охарактеризовать изохорный процесс Изохорный процесс
- •11. Изобразить график и охарактеризовать изотермический процесс Изотермический процесс
- •12. Изобразить график и охарактеризовать адиабатный процесс Адиабатный процесс
- •13. Дать определение кругового процесса или цикла
- •14. Написать формулу для определения термодинамического коэффициента полезного действия цикла
- •15. Объяснить, что такое прямой и обратный цикл Карно
- •16. Перечислить основные термодинамические свойства воды и пара
- •17. Изобразить графически цикл Ренкина
- •18. Объяснить, что такое истечении газов
- •19. Объяснить, что такое дросселирование газов
- •21. Объяснить понятия: температурное поле, градиент температуры и тепловой поток
- •22. Теплопроводность при стационарном тепловом режиме
- •23. Написать формулу теплопроводности плоской стенки (трубы). Изобразить графически процесс передачи тепла через плоскую стенку трубы
- •9.4.3.Теплопроводность через плоскую стенку при граничных условиях первого рода
- •24. Перечислить виды движения теплоносителя
- •25. Объяснить, что такое конвективный теплообмен
- •26. Объяснить, чем отличается теплопередача при свободном и вынужденном движении теплоносителя
- •27. Объяснить, чем отличается теплоотдача при движении среды в трубах, теплоотдача при внешнем обтекании труб
- •28. Описать связь конвективного теплообмена с гидравлическим
- •29. Объяснить, как изменяется теплоотдача при изменении агрегатного состояния вещества
- •30. Объяснить, чем отличается теплоотдача при конденсации пара от теплоотдачи при кипении жидкости
- •31. Объяснить, что такое массообмен
- •32. Объяснить, что такое лучистый теплообмен
- •33. Перечислить виды лучистых потоков
- •34. Назвать основные законы теплового излучения
- •35. Описать основные законы теплового излучения
- •36. Объяснить, чем отличается теплопередача через плоскую стенку от теплопередачи через цилиндрическую стенку
- •37. Описать процесс теплопередачи в теплообменных аппаратах
- •38. Объяснить, что такое сложный теплообмен
- •39. Назвать основные принципы расчета теплообменных аппаратов Основы гидравлики
- •2. Назвать основные физические свойства жидкости
- •3. Объяснить, что такое гидравлический удар
- •4. Объяснить, что такое гидравлическое сопротивление, написать формулу для определения гидравлического сопротивления, объяснить, от чего зависит величина гадравлического сопротивления
- •5. Основные сведения о насосах, применяемых в теплотехнике
- •6. Нарисовать схему устройства насоса
- •7. Описать принцип работы насоса
- •8. Понятие о производительности, развиваемом напоре и давление на выходе из насоса
- •9. Назвать примеры, влияющие на производительность насоса
- •10. Перечислить основные рабочие параметры насоса
- •Здесь выражается в кг/л, – л/с, – м, – кВт. Часть потребляемой энергии, которая затрачивается на преодоление различных видов сопротивлений в пределах насоса, описывается выражением 1–h;
- •11. Объяснить, как производится регулирование и совместная работа насосов
- •12. Объяснить, что такое допустимая высота всасывания в чем заключается явление кавитации
- •13. Назвать силы, действующие на насос и способы их уравновешивания
- •14. Объяснить, что такое нестационарные режимы работы
- •15. Объяснить, что такое «срыв» «запаривание» насоса
- •16. Описать конструкцию и принцип действия эжекторной установки
- •17. Описать конструкцию и принцип действия вакуумных насосов
- •18. Назвать факторы, влияющие на конструкцию и работу насоса Физические факторы, влияющие на работу насосов
- •1. Кавитация
- •2. Завихрения
- •3. Вибрация
- •4. Шумы
- •5. Осевые и радиальные нагрузки
- •19. Перечислить критерии выбора насоса для эксплуатации
- •Вентиляционные установки
- •1. Перечислить виды вентиляционных систем
- •Типы вентиляционных систем[править | править вики-текст]
- •Типы систем по способу побуждения движения воздуха[править | править вики-текст] Естественная вентиляция[править | править вики-текст]
- •Механическая вентиляция[править | править вики-текст]
- •2. Описать устройство вентилятора
- •3. Дать классификацию основных типов вентиляторов по конструктивному исполнению
- •Центробежные (радиальные) вентиляторы[править | править вики-текст]
- •Диаметральные (тангенциальные) вентиляторы[править | править вики-текст]
- •Общая электротехника
- •1. Назвать основные законы цепей постоянного тока и записать их формулы
- •1.3. Основные законы цепей постоянного тока
- •Закон Ома для участка цепи
- •Закон Ома для всей цепи
- •Первый закон Кирхгофа
- •Второй закон Кирхгофа
- •2. Объяснить, что такое силы Ампера, Лоренцо
- •3. Сформулировать закон Ампера
- •5. Объяснить, что такое активная, реактивная и полная мощность Активная мощность — среднее за период значение мгновенной мощности переменного тока
- •Полная мощность — величина, равная произведению действующих значений периодического электрического тока I в цепи и напряжения u на её зажимах
- •Реактивная мощность — величина, характеризующая нагрузки, создаваемые в электротехнических устройствах колебаниями энергии электромагнитного поля в цепи синусоидального переменного тока
- •7. Объяснить, что такое фазное и линейное напряжение
- •Описать устройство и принцип действия асинхронного двигателя
- •9. Описать устройство и принци действия электрических двигателей постоянного тока
- •10. Описать в общем устройство электропривода
- •11. Назвать назначение и описать принцип действия трансформаторов
- •Контрольно-измерительные приборы и автоматическое регулирование тепловых процессов
- •1. Объяснить принцип измерения температуры, давления, уровня, расхода
- •Магнитные
- •Емкостные
- •Ртутные
- •Пьезоэлектрические
- •Пьезорезонансные
- •Резистивные
- •2. Описать устройство датчиков измерения температуры, давления, уровня, расхода
- •3. Объяснить, что такое вторичные приборы
- •4. Назвать основные типы вторичных приборов
- •5. Дать определение терминам «Класс точности прибора» и «Погрешность измерения»
- •Дозиметрия и защита от ионизирующего излучения
- •2. Описать биологическое воздействие ионизирующего излучения
- •Единицы измерения
- •Механизмы биологического воздействия
- •Гигиеническое нормирование ионизирующих излучений
- •3. Объяснить, каким образом осуществляется защита от воздействия радиоактивных веществ и ионизирующего излучения
- •4. Назвать основные методы регистрации ионизирующего излучения
- •3. Цитогенетические:
- •2) Источника электрического питания
- •Перечислить основные приборы радиационного контроля
- •Ядерная физика. Основы физики реакторов
- •1. Перечислить и охарактеризовать основные модели строения атома
- •2. Объяснить, что такое а. Е. М.
- •3. Описать строение атома
- •4. Объяснить, что такое энергетический спектр атома
- •5. Объяснить, как происходит превращение атомных ядер
- •6. Объяснить, что такое ядерные силы и охарактеризовать их
- •7. Объяснить, что такое дефект массы
- •8. Объяснить, что такое устойчивость ядер
- •9. Объяснить, что такое радиоактивность
- •10. Объяснить, что такое искусственная радиоактивность
- •11. Перечислить основные типы ядерных реакций и охарактеризовать их
- •12. Описать, как осуществляется цепная реакция деления ядер Цепная реакция деления ядер урана
- •13. Перечислить основные типы ядерных реакторов
- •15. Написать формулу четырех сомножителей, реактивности, периода для реактора, работающего на постоянном уровне мощности
- •16. Объяснить, что такое коэффициент размножения
- •17 Объяснить, что такое реактивность
- •18. Объяснить, период реактора
- •21. Объяснить, что такое температурный и мощностной эффект реактивності
- •Общие сведения
- •Накопление продуктов деления
- •Глубина выгорания]
- •Теоретические основы химии воды
- •2. Назвать факторы, влияющие на растворимость твердых веществ
- •3. Назвать факторы, влияющие на растворимость газов в воде
- •6. Объяснить, что такое электролитическая диссоциация
- •Диссоциация в растворах
- •Диссоциация при плавлении
- •7. Объяснить, что такое водородный показатель
- •8. Объяснить, что такое гидролиз растворов
- •Механический этап[править | править вики-текст]
- •Физико-химический этап[править | править вики-текст]
- •Механизм ионного обмена
- •Теплообменное оборудование аэс
- •1. Назвать назначение, описать классификацию теплообменных аппаратов
- •2. Объяснить классификацию теплообменных аппаратов
- •3. Перечислить требовании, предъявляемые к теплообменному оборудованию аэс
- •Назвать основные конструкционные элементы, принцип действия теплообменников
- •Трубопроводы и оборудование аэс
- •1. Назвать назначение трубопроводов аэ
- •2. Перечислить признаки, по которым различаются трубопроводы аэс
- •3. Назвать назначение энергетической арматуры
- •По функциональному назначению
- •5. Назвать основные типы арматуры, применяемой на аэс
- •6. Перечислить требования к арматуре, применяемой на аэс
- •7. Назвать назначение, описать конструкцию, принцип действия запорной, дроссельной-регулирующей, защитно-предохранительной арматуры
- •Паровые турбины
- •Основные технические характеристики паровых турбин turbopar:
Ответы на вопросы
Теоретические основы теплотехники
1. Перечислить основные параметры, которыми характеризуется состояние рабочего тела
Давление с точки зрения молекулярно-кинетической теории есть средний результат ударов молекул газа, находящихся в непрерывном хаотическом движении, о стенки сосуда, в котором заключен газ, и представляет собой отношение нормальной составляющей силы к поверхности, на которую действует сила: Р = N /F, где N - сила, Н; F - площадь поверхности, м2
Температура с качественной стороны характеризует степень нагретости тела, с количественной стороны температура является мерой интенсивности теплового движения молекул.
Удельный объем (v) – объем единицы массы вещества, м3/ кг, v = V / m, где V – полный объем вещества, м3; m - масса вещества, кг.
2. Объяснить, что такое идеальный газ
Под идеальным газом понимают газ, у которого отсутствуют силы взаимодействия между молекулами, а молекулы не имеют объема, т.е. представляют собой материальные точки.
3. Перечислить основные законы идеального газа
Изопроцессы идеального газа – процессы, при которых один из параметров остаётся неизменным.
Изохорический процесс. Закон Шарля. V = const. Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа при этом изохорическом процессе подчиняется закону Шарля: При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т= const.
![]()
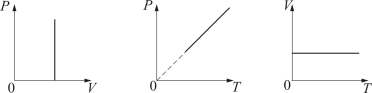
2. Изобарический процесс. Закон Гей-Люссака. Р = const. Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака: При постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
![]()
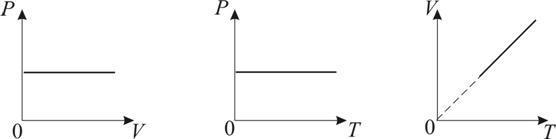
3. Изотермический процесс. Закон Бойля – Мариотта. T = const. Изотермическим процессом называется процесс, протекающий при постоянной температуре Т. Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта: При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
![]()
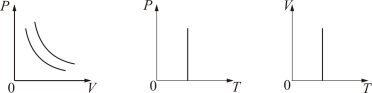
4. Адиабатический процесс (изоэнтропийный): Адиабатический процесс – термодинамический процесс, происходящий без теплообмена с окружающей средой.
5. Политропический процесс. Процесс, при котором теплоёмкость газа остаётся постоянной. Политропический процесс – общий случай всех перечисленных выше процессов.
6. Закон Авогадро. При одинаковых давлениях и одинаковых температурах, в равных объёмах различных идеальных газов содержится одинаковое число молекул. В одном моле различных веществ содержится NA=6,02·1023молекул (число Авогадро).
7. Закон
Дальтона. Давление
смеси идеальных газов равно сумме
парциальных давлений Р, входящих в неё
газов:
![]() Парциальное
давление Pn – давление, которое оказывал
бы данный газ, если бы он один занимал
весь объем.
Парциальное
давление Pn – давление, которое оказывал
бы данный газ, если бы он один занимал
весь объем.
При ![]() ,
давление смеси газов:
,
давление смеси газов:
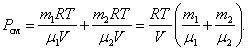
8. Объединённый газовый закон (Закон Клапейрона).
В соответствии с законами
Бойля – Мариотта (1.4.5) и Гей-Люссака
(1.4.3) можно сделать заключение, что для
данной массы газа
![]()
