
- •§ 15. Главные переходные металлы (d-элементы) и их соединения
- •Физические и химические свойства переходных металлов серии
- •2 До 9 являются типичными ион переходного металла / соединение цветные растворы
- •Некоторые Напоминания о Периодической таблицы по пути введения
- •Базовая структура Периодической таблицы и где "переходные металлы"?
- •Типичный Физические характеристики переходных металлов
- •(А) Некоторые Основное Типаж
- •(Б) с высокой температурой плавления и кипения
- •Соединения железа (II), как правило, светло-зеленый и железа (III) соединения, оранжево-коричневый.
- •(Г) (II) Некоторые другие нечетные биты переходного металла химии
- •(Е) каталитические свойства переходных металлов - Использование переходных металлов (1) Металлические элементы сами по себе используются в качестве катализаторов
- •(2) Некоторые соединения переходных металлов, также используются в качестве катализаторов
- •(Е) Подробнее о использованию переходных металлов и их соединений
- •( Г) Что можно сказать о использования непереходных металлов? Просто немного вставки напомнить студентам, что Есть и другие полезные металлы, кроме переходных металлов! Примечание на алюминий
- •Другие металлы без переходов и их применение
- •Назад к переходных металлов и их использование Еще на железо и примеров ч вл металлов могут быть сделаны более полезными
- •Другой переходный металл - титан - Как это производится? Что он используется?
- •Переходных металлов и использовать в сверхпроводниках
Sc - скандия соли, такие как хлорид, SCCL 3, бесцветны и не характерны переходных металлов
Ti - титан хлорид (III), TiCl 3 , фиолетовый
V - ванадий хлорида (III), VCl 3 , зеленый
Cr - хром (III), сульфат, Cr 2 (SO 4 ) 3 , темно-зеленый ( хромат (VI) соли желтый, дихромат (VI) соли оранжевый )
хром образует две положительные ионы, Cr 2+ (синий) и Cr 3+ (зеленый)
и две цветные ионы, Cro 4 2- (желтый) и дихромат Cr 2 O 7 2- (оранжевый)
Mn - соединения марганца
- Манганат калия (VII), KMnO 4 , фиолетовый , из-за фиолетового MnO 4 - иона
марганца (II) соли например MnCl 2 бледно-розовые .
Fe - железо (III) хлорид, FeCl 3 , желто-оранжево-коричневый.
Соединения железа (II), как правило, светло-зеленый и железа (III) соединения, оранжево-коричневый.
Некоторые соединения железа красная кровь по цвету, например, кислорода, несущего молекулу гемоглобина в крови поток!
например, железа (II), ион Fe 2+ ( бледно-зеленый ) в железо (II), сульфат FeSO 4
и железо (III) ионов Fe 3+ ( оранжево-коричневый ) в железо (III) раствор хлорида FeCl 3 (р-р)
Существует еще один хлорид FeCl 3 , и есть три оксиды, FeO , Fe 2 O 3 (ржавчина) и Fe 3 O 4
Со - сульфат кобальта, CoSO 4 , розовато
Ni - хлорид никеля, NiCl 2 , зеленый
Cu - медь (II) сульфат, CuSO 4 , синий.
Наиболее распространенные соединения меди являются синий в их кристаллов или раствора, а иногда и зеленый.
Синий водный ион меди, Cu 2+ (р-р) , на самом деле имеет более сложную структуру:
* [Cu (H 2 O) 6 ] 2+ (водн) , и, когда избыток раствора аммиака добавляют,
после первоначального желатиновые синий медь (II), гидроксид осадок, Cu (OH) 2 ,
она растворяется с образованием глубокий синий царскую ион: * [Cu (H 2 O) 2 (NH 3 ) 4 ] 2+ (р-р) .
* называются сложные ионы и когда цветные типичны переходного металла химии.
Меди (II) оксид, CuO , черный нерастворимое твердое вещество, легко растворяется в кислотах, чтобы дать растворимые соли синие например
медь (II) сульфат, CuSO 4 , с разбавленной серной кислотой,
меди (II), нитрат, Cu (NO 3 ) 2 , из разбавленной азотной кислоте
и зеленоватый-синий меди (II) хлорид, CuCl 2 , с разбавленной соляной кислотой.
Меди (II) гидроксида, Cu (OH) 2 , синий студенистый осадок образуется, когда щелочи добавляют к меди солевых растворов.
Меди (II) карбонат, Cuco 3 , бирюзовый-зеленый нерастворимое твердое вещество, легко растворяется в кислотах, развивается углекислый газ, чтобы дать растворимые соли синие (смотри выше)
Валентность Copper, или комбинируя мощность обычно два, например, соединения, содержащие Cu 2+ ионов.
Однако есть медь (I) соединения, в которых валентность является одним содержащий Cu + ион.
Этот v ariable валентность, следовательно, соединений и тех же элементов, но с различными формулами, является типичным для соединений переходных металлов , например
меди (I), оксид, Cu 2 O, нерастворимый красно-коричневого твердого вещества (CuO черный),
или меди (I), сульфат, Cu 2 SO 4 , белого твердого вещества (кристаллы CuSO 4 синий).
Zn - соли цинка, такие как сульфат цинка, ZnSO 4 , как правило, бесцветный и не характерны для переходных металлов.
(Г) (II) Некоторые другие нечетные биты переходного металла химии
С
 м кислот,
оснований и солей страницу для
приготовления переходной металл солей из
нерастворимых оксидов, гидроксидов
или карбонатов (нерастворимых
оснований).
м кислот,
оснований и солей страницу для
приготовления переходной металл солей из
нерастворимых оксидов, гидроксидов
или карбонатов (нерастворимых
оснований).Многие из переходных металлов карбонатов неустойчивы при нагревании и легко подвергаются термическому разложению .
карбонат металла ==> оксид металла + углекислый газ
например
меди (II), карбонат ==> меди (II), оксид + двуокись углерода
Cuco (3) ==> CuO (ы) + CO 2 (г)
или
карбонат цинка ==> оксид цинка + углекислый газ
ZnCO (3) ==> ZnO (ы) + CO 2 (г)
В целом уравнение ...
MCO (3) ==> MO (ы) + CO 2 (г) , где М может быть Fe, Cu, Mn или Zn
Диоксид углерода может быть подтверждено получив белый молочный осадок с известковой воды.
Иногда эти два твердых показать изменения цвета, например,
для M = Cu: бирюза зеленый карбонат ==> черный меди (II) оксида
для M = Zn: белый карбонат ==> белый оксид цинка, но желтый горячий
М
 ногие
ионы переходных металлов ( например,
в растворимых
солевых растворах) дают цветную гидроксид
осадки при смешивании с водным раствором
гидроксида натрия . Тем
не менее, ионы цинка получением белого
осадка гидроксида
ногие
ионы переходных металлов ( например,
в растворимых
солевых растворах) дают цветную гидроксид
осадки при смешивании с водным раствором
гидроксида натрия . Тем
не менее, ионы цинка получением белого
осадка гидроксидаЭти реакции могут быть использованы, чтобы помочь идентифицировать ионы переходных металлов в растворе.
Реакция осадков происходит, когда два решения (растворимых веществ) смешивают друг с другом и твердый продукт (нерастворимый) выпадает в осадок из смешанного раствора.
Раствор соли переходного металла раствор гидроксида натрия + ==> твердый осадок гидроксида + натриевая соль остается в растворе
ионной то осадки реакции:
ион металла + гидроксид-ионов ==> осадок гидроксида
(1) железа (II), ион Fe 2+ , бледно-зеленого в водном растворе,
который дает темный серо-зеленый студенистый осадок железа (II) гидроксида с раствором гидроксида натрия
,
железа (II) сульфат + натрия гидроксид ==> железа (II) гидроксид + сульфат натрия
FeSO 4 (р-р) + 2NaOH (р-р) ==> Fe (OH) 2 (тв) + Na 2 SO 4 (р-р)
или
(II), хлорид + натрия гидроксид ==> железа гидроксид натрия + хлорид железа (II),
FeCl 2 (р) + 2NaOH (р-р) ==> Fe (OH) 2 (тв) + 2NaCl (водн)
Для этих реакций ионного уравнение ..
Fe 2+ (р-р) + 2OH - (р-р) ==> Fe (OH) 2 (S)
(2) железо (III), ион Fe 3+ :
с получением коричневого железа (III) гидроксида осадок с раствором гидроксида натрия,
железа (III), хлорид + натрия гидроксид ==> железа (III), гидроксид натрия хлорид +
FeCl 3 (р-р) + 3NaOH (ая) ==> Fe (OH) 3 (ы) + 3NaCl (ая)
ионная уравнение ...
Fe 3+ (р) + 3OH - (р-р) ==> Fe (OH) 3 (S)
(3) медь (II), ион Cu 2+ , синий в водном растворе,
что дает синий меди (II) гидроксида осадок с раствором гидроксида натрия.
меди (II), сульфат натрия гидроксид + ==> меди (II), гидроксид натрия сульфат +
CuSO 4 (р-р) + 2NaOH (р-р) ==> Cu (OH) 2 (тв) + Na 2 SO 4 (р-р)
или
меди (II), хлорид + натрия гидроксид ==> меди гидроксида натрия хлорид + (II)
CuCl 2 (р) + 2NaOH (р-р) ==> Cu (OH) 2 (тв) + 2NaCl (водн)
Для этих двух реакций ионной уравнение ..
Cu 2+ (р-р) + 2OH - (р-р) ==> Cu (OH) 2 (S)
Следует отметить, что ион меди может быть также обнаружена по цвету пламени зеленый-синий .
Тест излучения проводится погружением нихрена (дешево) / платины (дорогой) провод в раствор соли меди и размещении конец провода плюс падение в горячей части рыкающий Бунзена пламени, когда вы видите вспышки синего и зеленого цвета ,
(4) ионов цинка Zn 2+ , бесцветный в водном растворе,
который дает белый гидроксида цинка осадок с раствором гидроксида натрия.
сульфат цинка + натрия гидроксид ==> гидроксид цинка + сульфат натрия
ZnSO 4 (р-р) + 2NaOH (р-р) ==> Zn (OH) 2 (тв) + Na 2 SO 4 (р-р)
Для этой реакции ионного уравнение является ..
(4а) Zn 2+ (р-р) + 2OH - (р-р) ==> Zn (OH) 2 (S)
Тем не менее, в отличие от других осадки описано выше, гидроксид цинка растворяется, если избыток раствора гидроксида натрия т.е. добавить много больше, и в результате прозрачный бесцветный раствор другого соединения цинка, образованного дополнительными ионами гидроксида, реагирующих с гидроксидом цинка.
(4b) Zn (OH) 2 (S) + 2OH - (р-р) ==> Zn (OH) 4 ] 2- (р-р)
Вышеуказанные четыре реакции осадок гидроксида показаны на диаграмме ниже.
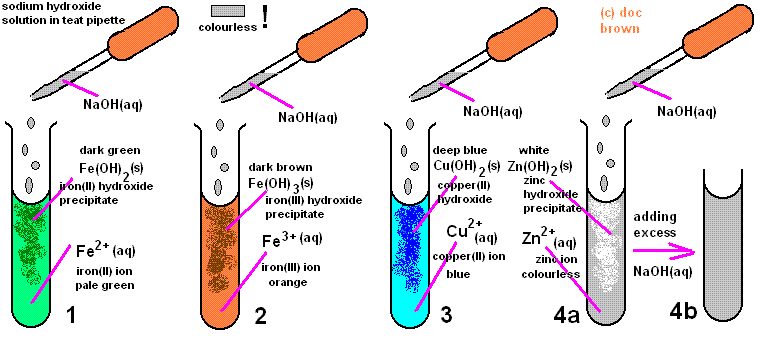
Эти осадки гидроксида переходного металла в основном твердые , но несколько желатиновой природе, потому что они включают много воды в их структуре.
Выше цветной гидроксид осаждается контраст с белым нерастворимого гидроксида дается некоторых ионов непереходных металлов , например
магниевую соль гидроксида натрия + ==> белый осадок гидроксида магния
ионное уравнение: Mg 2+ (р) + 2OH - (р-р) ==> Mg (OH) 2 (S)
Наблюдения будут соответствовать 4а только на схеме выше
кальциевая соль гидроксида натрия + ==> белый осадок гидроксида кальция
ионное уравнение: Са 2+ (р) + 2OH - (р-р) ==> Ca (OH) 2 (S)
Наблюдения будут соответствовать 4а только на схеме выше
соль алюминия + гидроксид натрия ==> белый осадок гидроксида алюминия
ионное уравнение: Al 3+ (р) + 3OH - (р-р) ==> Al (OH) 3 (S)
Гидроксид алюминия растворяется в избытке гидроксида натрия с получением прозрачного бесцветного раствора, но гидроксид магния и гидроксид кальция не ведут себя таким образом.
Наблюдения будут соответствовать 4а плюс 4б на диаграмме выше
Т
 акже
обратите внимание, что железо имеет
два валентности или объединения власти ,
дающие различные формулы соединения. Multiple
валентность, следовательно, многократный
образование соединение, является еще
одной характерной (но не единственный)
особенность переходного металла химии.
акже
обратите внимание, что железо имеет
два валентности или объединения власти ,
дающие различные формулы соединения. Multiple
валентность, следовательно, многократный
образование соединение, является еще
одной характерной (но не единственный)
особенность переходного металла химии.Валентность хлора 1 и железо может иметь сочетающий мощность 2 (II) или 3 (III).
FeCl 2 железа (II) хлорид (когда-то называли хлорид железа )
FeCl 3 железа (III) хлорид (когда-то называли хлорид железа )
Римскими цифрами число валентность или объединения мощности, например,
кислородного валентность 2 и меди, еще один переходный элемент , имеет валентность, равную 1 (I) или 2 (II)
так что мы должны Cu 2 O меди (I) оксид (когда-то назвал оксид меди )
и CuO меди (II), оксид (один раз называется оксид меди ).
Отсюда необходимость для валентности металла металла, которые будут показаны на римскими цифрами.
Есть еще детали и больше тестов на химической идентификации странице (используйте алфавитный список в верхней).
Окрашенный характер многих соединений переходных металлов, также отображается в термическом разложении, например переходных металлов, карбонаты
меди (II), карбонат (с, зеленый) ==> меди (II), оксид (ы, черный) + углекислого газа (г)
Cuco 3 ==> CuO + CO 2
Cuco 3 (с) ==> CuO (ы) + CO 2 (г) (уравнение символ с государственными символами)
Изменение цвета от темно-зеленого карбоната меди в реактивных оксида черный меди отчетливо наблюдается.
железа (II), карбонат (с, темно-зеленый) ==> железа (II), оксид (ы, черный) + двуокись углерода
Fe CO 3 ==> FeO + CO 2
Fe CO 3 (с) ==> FeO (ы) + CO 2 (г) (уравнение символ с государственными символами)
Изменение цвета от темно-зеленого до реагента черного твердого остатка.
марганца (II), карбонат (с, бледно-розовый) ==> марганца (II), оксид (ы, белый) + двуокись углерода
Mn CO 3 ==> MnO + CO 2
Mn CO 3 (с) ==> MnO (ы) + CO 2 (г) (уравнение символ с государственными символами)
Изменение цвета от бледно-розового твердого вещества в виде белого твердого остатка.
Тем не менее, это не изменение цвета для карбоната цинка, который, как уже отмечалось выше, не является типичным переходный металл.
карбонат цинка (с, белый) ==> оксида цинка (S, желтый горячий, белый холодный) + углекислый газ
ZnCO 3 ==> ZnO + CO 2
ZnCO 3 (с) ==> ZnO (ы) + CO 2 (г) (уравнение символ с государственными символами)
Оба карбонат цинка и оксида цинка белые, но оксид цинка желтеет, когда очень жарко, при охлаждении в конце эксперимента в станет белым.
