
- •§ 15. Главные переходные металлы (d-элементы) и их соединения
- •Физические и химические свойства переходных металлов серии
- •2 До 9 являются типичными ион переходного металла / соединение цветные растворы
- •Некоторые Напоминания о Периодической таблицы по пути введения
- •Базовая структура Периодической таблицы и где "переходные металлы"?
- •Типичный Физические характеристики переходных металлов
- •(А) Некоторые Основное Типаж
- •(Б) с высокой температурой плавления и кипения
- •Соединения железа (II), как правило, светло-зеленый и железа (III) соединения, оранжево-коричневый.
- •(Г) (II) Некоторые другие нечетные биты переходного металла химии
- •(Е) каталитические свойства переходных металлов - Использование переходных металлов (1) Металлические элементы сами по себе используются в качестве катализаторов
- •(2) Некоторые соединения переходных металлов, также используются в качестве катализаторов
- •(Е) Подробнее о использованию переходных металлов и их соединений
- •( Г) Что можно сказать о использования непереходных металлов? Просто немного вставки напомнить студентам, что Есть и другие полезные металлы, кроме переходных металлов! Примечание на алюминий
- •Другие металлы без переходов и их применение
- •Назад к переходных металлов и их использование Еще на железо и примеров ч вл металлов могут быть сделаны более полезными
- •Другой переходный металл - титан - Как это производится? Что он используется?
- •Переходных металлов и использовать в сверхпроводниках
§ 15. Главные переходные металлы (d-элементы) и их соединения
Общая характеристика.
Понятие переходный элемент обычно используется для обозначения любого элемента с валентными d- или f-электронами. Эти элементы занимают в периодической таблице переходное положение между электроположительными s-элементами и электроотрицательными p-элементами (см. § 2, 3).
d-Элементы принято называть главными переходными элементами. Их атомы характеризуются внутренней застройкой d-подоболочек. Дело в том, что s-орбиталь их внешней оболочки обычно заполнена уже до того, как начинается заполнение d-орбиталей в предшествующей электронной оболочке. Это означает, что каждый новый электрон, добавляемый в электронную оболочку очередного d-элемента, в соответствии с принципом заполнения (см. § 2), попадает не на внешнюю оболочку, а на предшествующую ей внутреннюю подоболочку. Химические свойства этих элементов определяются участием в реакциях электронов обеих указанных оболочек.
d-Элементы
образуют три переходных ряда — в 4-м,
5-м и 6-м периодах соответственно. Первый
переходный ряд включает 10 элементов,
от скандия до цинка. Он характеризуется
внутренней застройкой ![]() -орбиталей
(табл. 15.1). Орбиталь
-орбиталей
(табл. 15.1). Орбиталь ![]() заполняется
раньше, чем орбиталь
заполняется
раньше, чем орбиталь ![]() ,
потому что имеет меньшую энергию (см.
правило Клечковского, § 2).
,
потому что имеет меньшую энергию (см.
правило Клечковского, § 2).
Следует,
однако, отметить существование двух
аномалий. Хром и медь имеют на
своих ![]() -орбиталях
всего по одному электрону. Дело в том,
что полузаполненные или заполненные
подоболочки обладают большей устойчивостью,
чем частично заполненные подоболочки.
-орбиталях
всего по одному электрону. Дело в том,
что полузаполненные или заполненные
подоболочки обладают большей устойчивостью,
чем частично заполненные подоболочки.
В
атоме хрома на каждой из пяти ![]() -орбиталей,
образующих
-орбиталей,
образующих ![]() -подоболочку,
имеется по одному электрону. Такая
подоболочка является полузаполненной.
В атоме меди на каждой из пяти
-подоболочку,
имеется по одному электрону. Такая
подоболочка является полузаполненной.
В атоме меди на каждой из пяти ![]() -орбиталей
находится по паре электронов. Аналогичная
аномалия наблюдается у серебра.
-орбиталей
находится по паре электронов. Аналогичная
аномалия наблюдается у серебра.
Все ![]() -элементы
являются металлами.
-элементы
являются металлами.
Рассмотрим
химические свойства некоторых наиболее
важных переходных металлов ![]() и
их соединений.
и
их соединений.
Таблица 15.1. Электронные конфигурации элементов четвертого периода от скандия до цинка

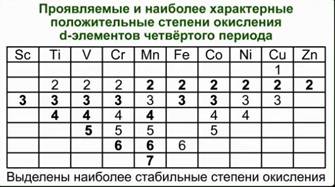
Например, оксид CrO3 близок по свойствам SO3. Оба эти вещества в обычных условиях находятся в твердом состоянии и образуют при взаимодействии с водой кислоты состава H2ЭO4. Точно также – оксиды марганца и хлора. Соответствующие им высшие оксиды – Mn2O7 и Cl2O7. Им соответствуют кислоты состава HЭО4. Подобная близость свойств объясняется тем, что часто элементы главных и побочных подгрупп в высших степенях окисления приобретают сходное электронное строение. Что касается химических свойств d-элементов, то обращает на себя внимание тот факт, что в пределах одной декады переходных элементов число стабильных степеней окисления сначала увеличивается, а потом уменьшается. См. Табл. 1. Химические свойства переходных элементов довольно сложны.
Физические свойства. d-элементы в целом характеризуются высокими температурами плавления и кипения. Их твердость и высокие температуры плавления и кипения объясняются прочными металлическими связями в этих элементах. Наличие прочной металлической связи обусловлено способностью d-элементов поставлять на образование связи электроны не только из внешней, но и из предшествующей ей внутренней подоболочки. Например, металлы первого переходного ряда используют для образования связей одновременно 3d- и 4s-электроны.
Физические свойства d-металлов
Элемент |
Атомный радиус, нм |
ПИ, эВ |
ЭО по Полингу |
Энергия связи, эВ |
ρ, г/см3 |
tпл, оС |
Tкип, оС |
Cr Mn Fe Cu Zn Ag |
0,125 0,124 0,124 0,128 0,133 0,144 |
6,77 7,44 7,87 7,73 9,39 7,58 |
1,6 1,5 1,8 1,9 1,7 1,9 |
4,11 2,91 4,31 3,51 1,35 2,95 |
7,19 7,44 7,87 8,96 7,13 10,5 |
1857 1244 1535 1083 420 962 |
2672 1962 2750 2567 907 2212 |
d-Элементы характеризуются также более высокой плотностью по сравнению с другими металлами. Это объясняется сравнительно малыми радиусами их атомов. Атомные радиусы этих металлов мало изменяются в этом ряду.
d-Элементы — хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s-электрон сверх полузаполненной или заполненной d-оболочки. Металлы с заполненной s-оболочкой обладают меньшей электропроводностью. Например, медь, серебро золото, обладающие внешней электронной конфигурацией d10s1, проводят электрический ток лучше, чем цинк, кадмий и ртуть, обладающие конфигурацией d10s2. Хром, молибден и вольфрам, имеющие конфигурацию d5s1, характеризуются более высокой электропроводностью по сравнению с марганцем, технецием и рением, имеющим конфигурацию d5s2.
Химические свойства. Электроотрицательность и энергии ионизации металлов первого переходного ряда возрастают в направлении от хрома к цинку. Это означает, что металлические свойства элементов первого переходного ряда постепенно ослабевают в указанном направлении. Такое изменение их свойств проявляется и в последовательном возрастании окислительно-восстановительных потенциалов с переходом от отрицательных к положительным значениям.
Стандартные окислительно-восстановительные потенциалы всех металлов первого переходного ряда за исключением меди (и серебра во втором переходном ряду) в системах М2+/М отрицательны. Согласно этим отрицательным значениям, металлы первого переходного ряда должны располагаться в электрохимическом ряду напряжений выше водорода. Поэтому они должны вытеснять водород из минеральных кислот и образовывать водные растворы, содержащие ионы этих металлов. Однако некоторые из них реагируют с кислотами медленно, потому что на поверхности металла образуется защитный слой оксида. Это объясняет пассивность таких металлов, как хром, в коррозионных средах.
Общие черты переходного металла ХИМИИ
Эта страница объясняет, что переходный металл является с точки зрения его электронной структуры, а затем идет на смотреть на общие черты переходного металла химии. К ним относятся состояние переменной окисления (степень окисления), образование сложных ионных, цветные ионы, и каталитическую активность. Вы найдете некоторые из этого покрыта довольно кратко на этой странице с ссылками на другие части сайта, где темы были рассмотрены более подробно.
Электронная структура переходных металлов Что представляет собой переходный металл? Термины переходного металла (или элемент) и d блок элемент иногда используются как будто они означают одно и то же. Они не делают - есть тонкое различие между этими двумя терминами. Мы будем изучать d блоковые элементы сначала: d блочные элементы Вы помните, что когда вы строите Периодической таблицы и работать, куда положить электроны, используя принцип AUFBAU, что-то странное происходит после аргона. В атмосфере аргона 3s и 3p уровней полны, но вместо того, пополнить 3d уровни следующий, 4s уровень заполняет вместо того, чтобы дать калий и затем кальций. Только после этого делают 3d уровни заполнения. |
|||||||||||||||||||||||||||||||
|
Примечание: Если вы не уверены в атомных орбиталей и электронных структур , что вам действительно нужно, чтобы по этой ссылке, прежде чем идти дальше. Это приведет вас на страницу, объясняя атомные орбитали, а затем в других страниц о электронных структур. Если вы по ссылке, используйте кнопку НАЗАД на вашем браузере (или файл История или Go меню), чтобы быстро вернуться на эту страницу.
|
||||||||||||||||||||||||||||||
Элементы периодической таблицы, которые соответствуют заполнения уровней г называются D Block элементы .Первый ряд из них показан в сокращенном виде Периодической таблицы ниже.
Электронные Структуры D Block элементов, показанных являются:
Вы заметите, что картина заполнения не совсем аккуратный!Он разбит на обоих хрома и меди. |
|||||||||||||||||||||||||||||||
|
Примечание: Это то, что вы просто придется принять.Там нет простой объяснение для него, который может использоваться на этом уровне. Любое простое объяснение, которое дается неисправен! Люди иногда говорят, что наполовину заполненный уровень d как в хроме (с одним электроном в каждом орбитальная) стабильна, и поэтому он - иногда ! Но тогда нужно смотреть на , почему она стабильна. Очевидное объяснение в том, что хром принимает эту структуру, потому что разделение электронов минимизирует отталкивания между ними - в противном случае он будет занимать совсем другие структуры. Но вы только посмотрите на электронной конфигурации вольфрама (W), чтобы увидеть, что это, видимо, объясняется просто не всегда работает. Вольфрам имеет такое же число внешних электронов, как хром, но его внешняя структура отличается - 5d 4 6s 2 . Опять электронные отталкивания должны быть сведены к минимуму - в противном случае он не будет занимать эту конфигурацию. Но в данном случае, это не правда, что наполовину заполненной государство является наиболее стабильным - он, кажется, не очень разумно, но это факт!Реальное объяснение будет гораздо сложнее, чем кажется на первый взгляд. Также невозможно использовать утверждение, что полная d уровень (например, в меди случае) является устойчивым, если вы не можете придумать надлежащего объяснения, почему это так. Вы не можете предположить, что, глядя красиво и аккуратно это достаточно хорошая причина! Если вы не можете что-то объяснить должным образом, это намного лучше, просто принять его, чем восполнить неисправные объяснения, которые звучат хорошо на поверхности, но не выдерживает никакой критики!
|
||||||||||||||||||||||||||||||
Переходные металлы Не все d блочные элементы считаются переходными металлами! Есть расхождения между различными программах британского, но большинство используют определение:
|
|||||||||||||||||||||||||||||||
|
Примечание: Самое последнее определение ИЮПАК включает возможность самого элемента, имеющего неполное -орбиталей также. Это вряд ли будет большой проблемой (это только действительно возникает с скандия), но это было бы заплатить вам, чтобы узнать версию Вашего раздела хочет. Обе версии определения используются в настоящее время в различных программах в Великобритании на базе. Если вы работаете в направлении экзамена британской и не получил копию учебного плана , перейдите по этой ссылке, чтобы узнать, как получить один. Используйте кнопку НАЗАД на вашем браузере, чтобы быстро вернуться на эту страницу.
|
||||||||||||||||||||||||||||||
На основании определения, описанной выше, скандий и цинка не считаются переходными металлами - даже при том, что они являются членами D Block. Скандий имеет электронное строение [Ar] 3d 1 4s 2 . Когда он образует ионы, она всегда проигрывает в 3 внешние электроны и заканчивается со структурой аргона. Sc 3+ионов не имеет ни одного d электроны и так не отвечают определению. Цинк имеет электронную структуру [Ar] 3d 10 4s 2 . Когда он образует ионы, она всегда проигрывает два 4s электронов дать 2+ ион с электронной структуры [Ar] 3d 10 . Ионов цинка имеет полные D уровни и не подпадают под определение либо. В отличие от этого, меди, [Ar] 3d 10 4s 1 , образует два иона.В Cu + ион электронная структура [Ar] 3d 10 . Тем не менее, наиболее распространенных Cu 2+ ион имеет структуру [Ar] 3d 9 . Медь, безусловно, переходный металл, потому что ТС 2+ион имеет неполную уровень D.
Ионов переходных металлов Здесь вы столкнулись с одной из самых раздражающих фактов в химии на этом уровне! Когда вы работаете электронной структуры первого переходного ряда (от скандия до цинка) с использованием принципа AUFBAU, вы делаете это на том основании, что 3d-орбитали имеют более высокую энергию, чем 4s орбитальных. Это означает, что вы работаете на предположении, что 3d-электроны добавляются после 4s них. Однако, по всей химии переходных элементов, 4s-орбитальных ведет себя в качестве внешнего, наибольшей энергией орбитального. Когда эти металлы образуют ионы, то 4s электроны всегда теряется в первую очередь. Вы должны помнить об этом:
|
|||||||||||||||||||||||||||||||
|
Примечание: Проблема здесь в том, что принцип Aufbau только действительно может быть использован как способ разработки электронных структур большинства атомов. Это простой способ сделать это, хотя он не с какой-то, как хром или медь, конечно, и вы должны научиться их. Существует, однако, недостаток в теории за ним, который производит проблем, как это. Почему, по-видимому более высокие энергетические 3d электроны не те, которые можно потерять, когда металл ионизирует? Я написал подробное объяснение этого на другой странице под названием порядок заполнения 3d и 4s-орбитали . Если вы учитель или очень уверенно студент, то вы хотели бы по этой ссылке. Если вы не настолько уверены, я предлагаю, чтобы вы его игнорировать. Убедитесь, что вы можете работать, структуры этих атомов с использованием принципа AUFBAU на предположении, что 3d-орбитали заполнить после 4s, и узнать, что когда атомы ионизируют, что 4s электроны всегда теряется в первую очередь. Просто игнорировать противоречия между этими двумя идеями!
|
||||||||||||||||||||||||||||||
Чтобы написать электронное строение для Co 2+ :
2+ ион образуется в результате потери двух 4s электронов. Чтобы написать электронное строение для V 3+ :
В 4s электроны потеряли сначала следуют одной из 3d-электронов. |
|||||||||||||||||||||||||||||||
|
Примечание: Вы найдете больше примеров написанияэлектронных структур для d блок ионов , перейдя по этой ссылке. Используйте кнопку НАЗАД на вашем браузере, чтобы быстро вернуться на эту страницу.
|
||||||||||||||||||||||||||||||
Переменная состояния окисления (количество) Одна из ключевых особенностей переходного металла химии является широкий диапазон степеней окисления (степень окисления), что металлы могут показать. |
|||||||||||||||||||||||||||||||
|
Примечание: Если вы не уверены в степени окисления, что вам действительно нужно, чтобы по этой ссылке, прежде чем идти дальше. Используйте кнопку НАЗАД на вашем браузере, чтобы быстро вернуться на эту страницу.
|
||||||||||||||||||||||||||||||
Было бы неправильно, хотя, чтобы создать впечатление, что только переходные металлы могут иметь переменные состояния окисления. Например, такие элементы, как сера или азот или хлор имеют очень широкий спектр состояний окисления в их соединений - и это, очевидно, не переходные металлы. Тем не менее, эта изменчивость реже в металлах, кроме переходных элементов. Из знакомых металлов из главных групп Периодической таблицы, только свинец, и олово шоу переменная состояния окисления в какой-то степени. Примеры переменных состояниях окисления в переходных металлов Железо Утюг имеет два распространенным степени окисления (+2 и +3) в, например, Fe 2+ и Fe 3+ . Она также имеет менее общее состояние окисления +6 в феррата (VI) иона, FeO 4 2-. Марганца Марганец имеет очень широкий спектр состояний окисления в его соединений. Например:
Другие примеры Вы найдете приведенные выше примеры и другие смотрели на подробно, если вы изучите химию отдельных металлов из меню переходного металла. Существует ссылку на эту меню в нижней части страницы.
Объясняя переменных состояния окисления в переходных металлов Мы будем смотреть на формирование простых ионов, таких как Fe 2+ и Fe 3+ . Когда металл образует ионное соединение, формула соединения, полученного зависит от энергетике процесса. В целом, формируется соединением является тот, в котором высвобождается большая часть энергии. Чем больше энергия, выделяющаяся, тем стабильнее соединение. Есть несколько энергетические условия, чтобы думать об этом, но ключевыми являются:
Чем более взимается ион, тем больше электронов, которые Вы должны удалить и больше энергию ионизации, вы должны будете предоставить. Но зачета это, тем более высоко заряженной ион, тем больше энергии выделяется либо как решетки энтальпии или гидратации энтальпии иона металла. |
|||||||||||||||||||||||||||||||
|
Примечание: То, что я говорю здесь в общих чертах рождаются-Хабер циклов. Вы найдете их покрыты вразделе энергетики из Chemguide, или моим подсчетам химия книге .
|
||||||||||||||||||||||||||||||
Думая о типичном без переходного металла (кальция) Хлорид кальция является CaCl 2 . Почему это? Если вы пытались сделать CaCl, (содержащий Ca + ион), весь процесс немного экзотермической. Делая Ca 2+ ион вместо этого, вы должны поставить больше энергию ионизации, но вы выходите много больше энергии решетки. Существует гораздо больше притяжение между ионов хлора и кальция 2+ ионов, чем есть, если у вас есть только 1+ ион. В целом, процесс является сильно экзотермической. Поскольку формирование CaCl 2 -релизов гораздо больше энергии, чем делает CaCl, то CaCl 2 является более стабильной - и так формы вместо. А как насчет CaCl 3 ? На этот раз вам придется удалить еще один электрон из кальция. Первые два пришли из 4s уровне. Третий происходит от 3p.Это намного ближе к ядру и, следовательно, намного труднее удалить. Существует большой скачок в ионизации энергии между вторым и третьим электрона удалены. Несмотря на то, будет выигрыш в решетке энтальпии, это не что-либо как достаточно, чтобы компенсировать дополнительную энергию ионизации, и в целом процесс очень эндотермической. Это определенно не энергетически целесообразно сделать CaCl 3 ! Думая о типичном переходного металла (железо) Вот изменения в электронной структуре железа, чтобы сделать 2+ или 3+.
В 4s орбитальные и 3d-орбитали имеют очень похожие энергии. Существует не огромный скачок в количестве энергии, которую вы должны удалить третий электрон по сравнению с первым и вторым. Цифры для первых трех энергий ионизации (в кДж -1 ) для железа по сравнению с теми, кальция являются:
Существует увеличение ионизации энергии как вы берете больше электронов от атома, потому что у вас есть такое же количество протонов, привлекающих меньше электронов.Тем не менее, существует гораздо меньше рост, когда вы берете третью электрон из железа, чем от кальция. В случае железа, дополнительная энергия ионизации компенсируется более или менее по дополнительной решетки энтальпии или гидратации энтальпии, выделяющиеся при 3+ соединение производится. Чистый эффект от всего этого является то, что общее изменение энтальпии не сильно отличается ли сделать вас, скажем, FeCl 2 или FeCl 3 . Это означает, что это не слишком сложно конвертировать между двумя соединениями. |
|||||||||||||||||||||||||||||||
This page explains what a transition metal is in terms of its electronic structure, and then goes on to look at the general features of transition metal chemistry. These include variable oxidation state (oxidation number), complex ion formation, coloured ions, and catalytic activity. You will find some of this covered quite briefly on this page with links to other parts of the site where the topics are covered in more detail.
The electronic structures of transition metals What is a transition metal? The terms transition metal (or element) and d block element are sometimes used as if they mean the same thing. They don't - there's a subtle difference between the two terms. We'll explore d block elements first: d block elements You will remember that when you are building the Periodic Table and working out where to put the electrons using the Aufbau Principle, something odd happens after argon. At argon, the 3s and 3p levels are full, but rather than fill up the 3d levels next, the 4s level fills instead to give potassium and then calcium. Only after that do the 3d levels fill. |
|||||||||||||||||||||||||||||||
|
Note: If you aren't sure about atomic orbitals and electronic structures, you really need to follow this link before you go on. It takes you to a page explaining atomic orbitals and then on to other pages about electronic structures. If you do follow the link, use the BACK button on your browser (or the History file or Go menu) to return quickly to this page.
|
||||||||||||||||||||||||||||||
The elements in the Periodic Table which correspond to the d levels filling are called d block elements. The first row of these is shown in the shortened form of the Periodic Table below.
The electronic structures of the d block elements shown are:
You will notice that the pattern of filling isn't entirely tidy! It is broken at both chromium and copper. |
|||||||||||||||||||||||||||||||
|
Note: This is something that you are just going to have to accept. There is no simple explanation for it which is usable at this level. Any simple explanation which is given is faulty! People sometimes say that a half-filled d level as in chromium (with one electron in each orbital) is stable, and so it is - sometimes! But you then have to look at why it is stable. The obvious explanation is that chromium takes up this structure because separating the electrons minimises the repulsions between them - otherwise it would take up some quite different structure. But you only have to look at the electronic configuration of tungsten (W) to see that this apparently simple explanation doesn't always work. Tungsten has the same number of outer electrons as chromium, but its outer structure is different - 5d46s2. Again the electron repulsions must be minimised - otherwise it wouldn't take up this configuration. But in this case, it isn't true that the half-filled state is the most stable - it doesn't seem very reasonable, but it's a fact! The real explanation is going to be much more difficult than it seems at first sight. Neither can you use the statement that a full d level (for example, in the copper case) is stable, unless you can come up with a proper explanation of why that is. You can't assume that looking nice and tidy is a good enough reason! If you can't explain something properly, it is much better just to accept it than to make up faulty explanations which sound OK on the surface but don't stand up to scrutiny!
|
||||||||||||||||||||||||||||||
Transition metals Not all d block elements count as transition metals! There are discrepancies between the various UK-based syllabuses, but the majority use the definition:
|
|||||||||||||||||||||||||||||||
|
Note: The most recent IUPAC definition includes the possibility of the element itself having incomplete d orbitals as well. This is unlikely to be a big problem (it only really arises with scandium), but it would pay you to learn the version your syllabus wants. Both versions of the definition are currently in use in various UK-based syllabuses. If you are working towards a UK-based exam and haven't got a copy of your syllabus, follow this link to find out how to get one. Use the BACK button on your browser to return quickly to this page.
|
||||||||||||||||||||||||||||||
On the basis of the definition outlined above, scandium and zinc don't count as transition metals - even though they are members of the d block. Scandium has the electronic structure [Ar] 3d14s2. When it forms ions, it always loses the 3 outer electrons and ends up with an argon structure. The Sc3+ ion has no d electrons and so doesn't meet the definition. Zinc has the electronic structure [Ar] 3d104s2. When it forms ions, it always loses the two 4s electrons to give a 2+ ion with the electronic structure [Ar] 3d10. The zinc ion has full d levelsand doesn't meet the definition either. By contrast, copper, [Ar] 3d104s1, forms two ions. In the Cu+ ion the electronic structure is [Ar] 3d10. However, the more common Cu2+ ion has the structure [Ar] 3d9. Copper is definitely a transition metal because the Cu2+ ion has an incomplete d level.
Transition metal ions Here you are faced with one of the most irritating facts in chemistry at this level! When you work out the electronic structures of the first transition series (from scandium to zinc) using the Aufbau Principle, you do it on the basis that the 3d orbitals have a higher energy than the 4s orbital. That means that you work on the assumption that the 3d electrons are added after the 4s ones. However, in all the chemistry of the transition elements, the 4s orbital behaves as the outermost, highest energy orbital. When these metals form ions, the 4s electrons are always lost first. You must remember this:
|
|||||||||||||||||||||||||||||||
|
Note: The problem here is that the Aufbau Principle can only really be used as a way of working out the electronic structures of most atoms. It is a simple way of doing that, although it fails with some, like chromium or copper, of course, and you have to learn these. There is, however, a flaw in the theory behind it which produces problems like this. Why are the apparently higher energy 3d electrons not the ones to get lost when the metal ionises? I have written a detailed explanation of this on another page called the order of filling 3d and 4s orbitals. If you are a teacher or a very confident student then you might like to follow this link. If you aren't so confident, I suggest that you ignore it. Make sure that you can work out the structures of these atoms using the Aufbau Principle on the assumption that the 3d orbitals fill after the 4s, and learn that when the atoms ionise, the 4s electrons are always lost first. Just ignore the contradictions between these two ideas!
|
||||||||||||||||||||||||||||||
To write the electronic structure for Co2+:
The 2+ ion is formed by the loss of the two 4s electrons. To write the electronic structure for V3+:
The 4s electrons are lost first followed by one of the 3d electrons. |
|||||||||||||||||||||||||||||||
|
Note: You will find more examples of writing the electronic structures for d block ions, by following this link. Use the BACK button on your browser to return quickly to this page.
|
||||||||||||||||||||||||||||||
Variable oxidation state (number) One of the key features of transition metal chemistry is the wide range of oxidation states (oxidation numbers) that the metals can show. |
|||||||||||||||||||||||||||||||
|
Note: If you aren't sure about oxidation states, you really need to follow this link before you go on. Use the BACK button on your browser to return quickly to this page.
|
||||||||||||||||||||||||||||||
It would be wrong, though, to give the impression that onlytransition metals can have variable oxidation states. For example, elements like sulphur or nitrogen or chlorine have a very wide range of oxidation states in their compounds - and these obviously aren't transition metals. However, this variability is less common in metals apart from the transition elements. Of the familiar metals from the main groups of the Periodic Table, only lead and tin show variable oxidation state to any extent. Examples of variable oxidation states in the transition metals Iron Iron has two common oxidation states (+2 and +3) in, for example, Fe2+ and Fe3+. It also has a less common +6 oxidation state in the ferrate(VI) ion, FeO42-. Manganese Manganese has a very wide range of oxidation states in its compounds. For example:
Other examples You will find the above examples and others looked at in detail if you explore the chemistry of individual metals from the transition metal menu. There is a link to this menu at the bottom of the page.
Explaining the variable oxidation states in the transition metals We'll look at the formation of simple ions like Fe2+ and Fe3+. When a metal forms an ionic compound, the formula of the compound produced depends on the energetics of the process. On the whole, the compound formed is the one in which most energy is released. The more energy released, the more stable the compound. There are several energy terms to think about, but the key ones are:
The more highly charged the ion, the more electrons you have to remove and the more ionisation energy you will have to provide. But off-setting this, the more highly charged the ion, the more energy is released either as lattice enthalpy or the hydration enthalpy of the metal ion. |
|||||||||||||||||||||||||||||||
|
Note: What I am talking about here in a general way are Born-Haber cycles. You will find these covered in theenergetics section of Chemguide, or my chemistry calculations book.
|
||||||||||||||||||||||||||||||
Thinking about a typical non-transition metal (calcium) Calcium chloride is CaCl2. Why is that? If you tried to make CaCl, (containing a Ca+ ion), the overall process is slightly exothermic. By making a Ca2+ ion instead, you have to supply more ionisation energy, but you get out lots more lattice energy. There is much more attraction between chloride ions and Ca2+ ions than there is if you only have a 1+ ion. The overall process is very exothermic. Because the formation of CaCl2 releases much more energy than making CaCl, then CaCl2 is more stable - and so forms instead. What about CaCl3? This time you have to remove yet another electron from calcium. The first two come from the 4s level. The third one comes from the 3p. That is much closer to the nucleus and therefore much more difficult to remove. There is a large jump in ionisation energy between the second and third electron removed. Although there will be a gain in lattice enthalpy, it isn't anything like enough to compensate for the extra ionisation energy, and the overall process is very endothermic. It definitely isn't energetically sensible to make CaCl3! Thinking about a typical transition metal (iron) Here are the changes in the electronic structure of iron to make the 2+ or the 3+ ion.
The 4s orbital and the 3d orbitals have very similar energies. There isn't a huge jump in the amount of energy you need to remove the third electron compared with the first and second. The figures for the first three ionisation energies (in kJ mol-1) for iron compared with those of calcium are:
There is an increase in ionisation energy as you take more electrons off an atom because you have the same number of protons attracting fewer electrons. However, there is much less increase when you take the third electron from iron than from calcium. In the iron case, the extra ionisation energy is compensated more or less by the extra lattice enthalpy or hydration enthalpy evolved when the 3+ compound is made. The net effect of all this is that the overall enthalpy change isn't vastly different whether you make, say, FeCl2 or FeCl3. That means that it isn't too difficult to convert between the two compounds. |
|||||||||||||||||||||||||||||||

