
- •Теорія методу і опис установки.
- •Порядок| виконання роботи
- •Результати вимірювань і обчислень
- •Контрольні питання
- •Лабораторна робота №2 визначення теплоємності газів
- •Теоретична частина
- •Класифікація теплоємностей
- •Порядок|лад| виконання роботи
- •Результати вимірювань
- •Результати обчислення
- •Контрольні питання
- •Лабораторна робота №3 визначення параметрів водяної пари
- •Теоретична частина
- •Порядок|лад| виконання роботи
- •Результати вимірювань
- •Результати обчислення
- •Контрольні питання
- •Порядок|лад| виконання роботи
- •Результати вимірювань та обчислень
- •Контрольні питання
Контрольні питання
Яка пара є вологою насиченою парою?
Що таке „ступінь сухості насиченої пари”?
Яка пара є сухою насиченою парою?
Яка пара є перегрітою водяною парою?
Як записати рівняння Клайперона – Клаузіуса?
Що таке „прихована теплота пароутворення”?
Що називається „фазовою діаграмою”?
Які є методи визначення ступеня сухості вологої насиченої пари?
Як визначається питомий об'єм, ентальпія, внутрішня енергія та ентропія вологої насиченої пари?
Лабораторна робота №4
ВИЗНАЧЕННЯ ВІДНОШЕННЯ|ставлення| ТЕПЛОЕМКОСТЕЙ| ГАЗУ
ЗА МЕТОДОМ КЛЕМАНА-ДЕЗОРМА|
Мета роботи:
Метою|ціллю||теперішньої,даної|
роботи є|з'являється,являється|
вивчення процесів, що відбуваються|походять|
в газі при вимірюванні|вимірі|
відношення|ставлення|
питомих теплоємностей|
![]()
Обладнання:
Теоретична частина
Питомою теплоємністю газу називається кількість тепла, необхідне для нагрівання одиниці маси газу на один градус. Величина теплоємності газів залежить від умов їх нагрівання.
Запишемо перший початок термодинаміки:
-
dQ = dU + dA
(1)
де dQ – кількість тепла, що підводиться до термодинамічної системи і витрачається на збільшення її внутрішньої енергії dU і на роботу dA, що здійснюється|скоюється,чиниться| системою проти|супроти| зовнішніх сил.
За визначенням теплоємності
-
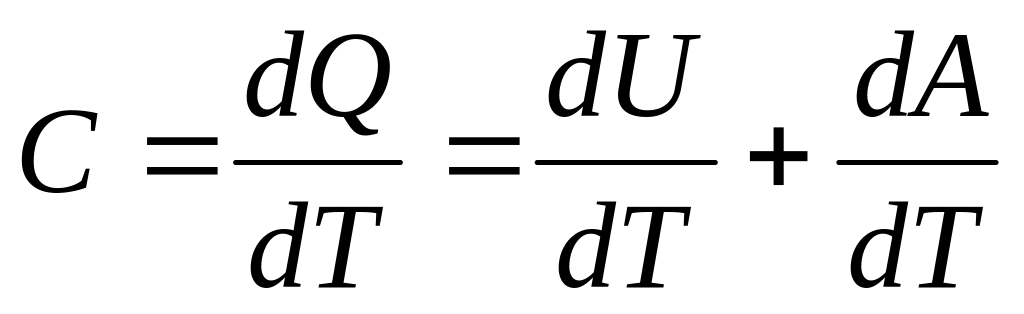
(2)
де елементарна робота dA = pdV
Розглянемо|розгледимо| два випадки:
1. Газ нагрівається при незмінному об'ємі|обсязі| V = const.
В цьому випадку dV = 0 і робота зовнішніх сил рівна нулю dA = pdV = 0, отже, все передане газу ззовні тепло йде на збільшення його внутрішньої енергії dU. Тоді з|із| рівняння (2) виходить, що теплоємність при постійному об'ємі|обсязі| рівна:
-
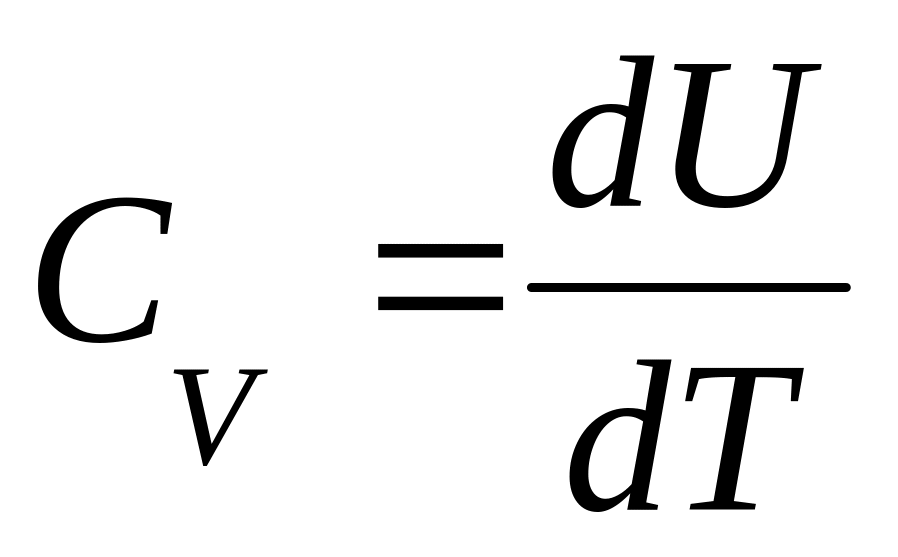 .
.(3)
2. Газ нагрівається при постійному тиску|тисненні| p = const.
В цьому випадку отримане|отримуване| газом ззовні тепло йде не тільки|не лише| на збільшення його внутрішньої енергії dU, але і на здійснення газом роботи dA проти|супроти| зовнішньої сили тиску|тиснення|. Тоді теплоємність при постійному тиску|тисненні| рівна:
-
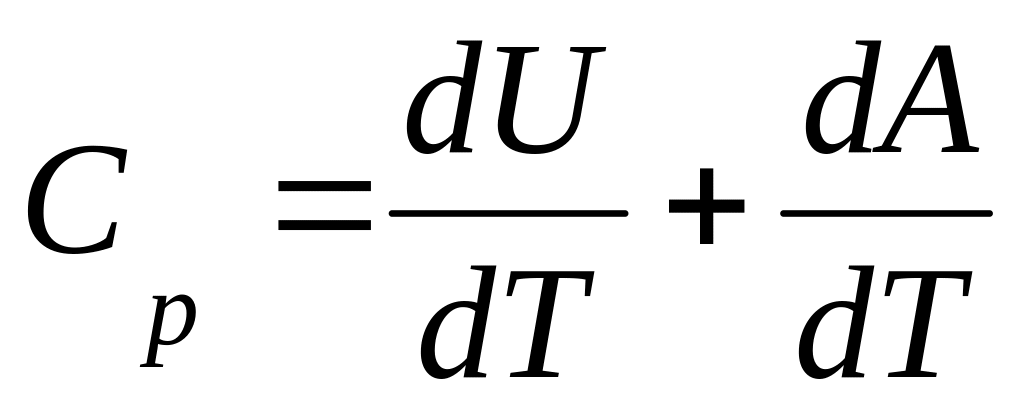 .
.(4)
Отже, для нагрівання одиниці маси газу на один градус при p = const буде потрібно більше тепла, ніж при V = const.
Знайдемо зв'язок між Ср і Сv.
Скориставшись рівнянням стану ідеального газу для одиниці маси ідеального газу, отримаємо|отримаємо|:
-

(5)
При p = const, dp = 0, і тоді
![]()
Підставивши цей вираз в (4) і замінивши dU/dT на Cv згідно (3) (для одиниці маси), отримаємо|отримаємо|:
-
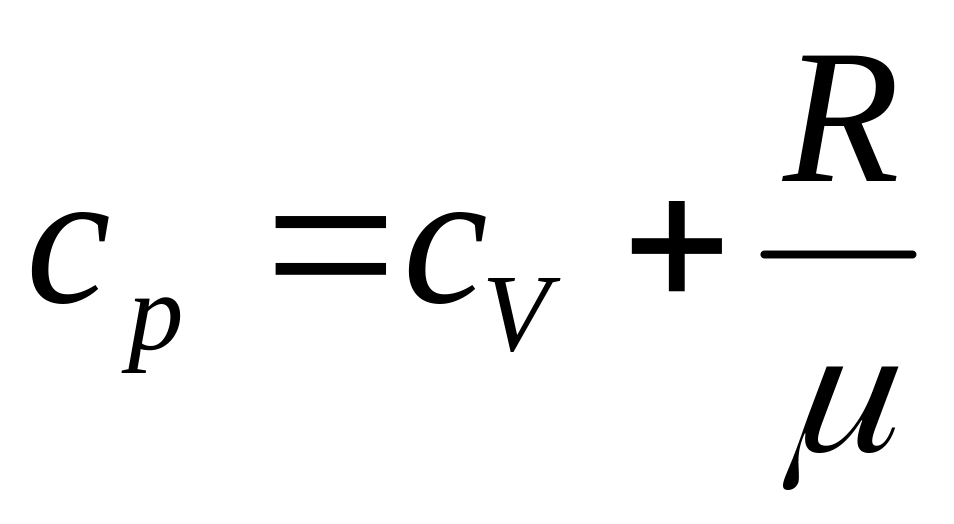
(6)
Таким чином, питома теплоємність Ср більше питомої теплоємності Сv на величину R/μ, яка є роботою, що здійснюється|скоюється,чиниться| одиницею маси газу при розширенні, що відбувається|походить| при постійному тиску|тисненні| в результаті|унаслідок,внаслідок| підвищення його температури на один градус.
Разом з|поряд з,поряд із| питомою теплоємністю с|із|, часто користуються молярною теплоємністю C (теплоємність одного кіломоля речовини). Між ними є|наявний| очевидне співвідношення
![]()
Тоді співвідношення (6) можна записати у вигляді|виді|:
![]()
Згідно закону рівнорозподілення| енергії за ступенями вільності на кожну ступінь вільності молекули ідеального газу доводиться|припадає,приходиться| в середньому однакова енергія, рівна 1/2kT (k – постійна Больцмана). Тому внутрішню енергію одного кіломоля ідеального газу можна знайти за формулою:
![]() ,
,
де NА – число Авогадро, i – число ступенів вільності молекули газу.
Підставивши цей вираз в (3), отримаємо|отримаємо|:
![]()
Число ступенів вільності визначається числом атомів в молекулі і характером|вдачею| зв'язку між ними. Для одноатомного газу i = 3; для двоатомного – i = 5 (жорсткий зв'язок), i = 6 (пружний зв'язок); для трьох і більш атомів в молекулі i = 6 (жорсткий зв'язок, нелінійна молекула).
Оскільки|тому що|
![]() або
або
![]()
то
![]() або
або
![]()
і
![]()
Величини cp і cv можна визначити експериментально. Проте|однак| існує спосіб безпосереднього визначення відношення|ставлення| cp/cv = γ яке залежить тільки|лише| від числа ступенів вільності молекул газу. Це відношення|ставлення| входить у вираз|вираження| закону Пуассона, що описує адіабатичний процес в газах.
-
PV2 = const
(7)
Адіабатичним процесом називається процес, що протікає без теплообміну з|із| навколишнім середовищем.
Такий процес відбуватиметься|походитиме| в системі, оточеній абсолютно|цілком| нетеплопровідними стінками. Оскільки|тому що| абсолютно|цілком| нетеплопровідних стінок не буває, реально процес може лише наближатися до адіабатичного. Якщо процес протікає достатньо|досить| швидко, так що система не встигає|устигає| вступити в теплообмін з|із| навколишнім середовищем, то його можна рахувати практично адіабатичним і за відсутності хорошої|доброї| теплової ізоляції (наприклад, при швидкому стисненні|стискуванні| або розширенні газу).
Перший початок термодинаміки для адіабатичного процесу приймає вигляд|вид|:
-
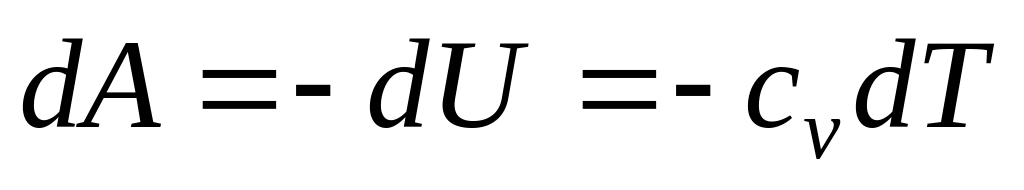
(8)
тобто|цебто| при адіабатичному розширенні робота здійснюється|скоюється,чиниться| газом тільки|лише| в результаті|унаслідок,внаслідок| зміни запасу його внутрішньої енергії. Адіабатичне розширення супроводжується|супроводиться| пониженням температури, а адіабатичне стиснення|стискування| – підвищенням температури.
Виведемо рівняння адіабатичного процесу (рівняння Пуассона).
Оскільки dA = pdV, то, використавши вираз|вираження| (8), знайдемо
-
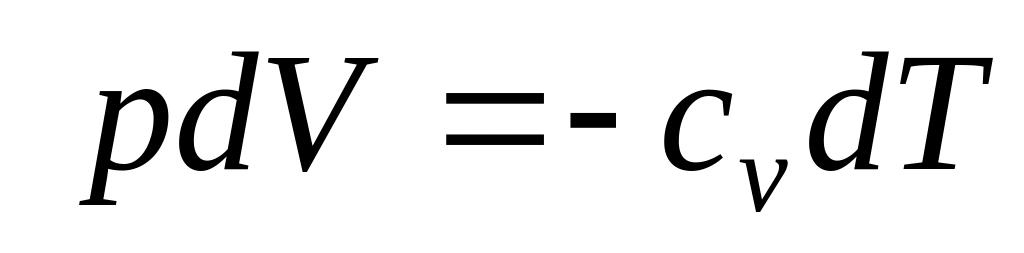 .
.(9)
Поділивши рівняння (5) на (9) і взявши до уваги, отримаємо|отримаємо|
![]()
звідки
-

(10)
де
-
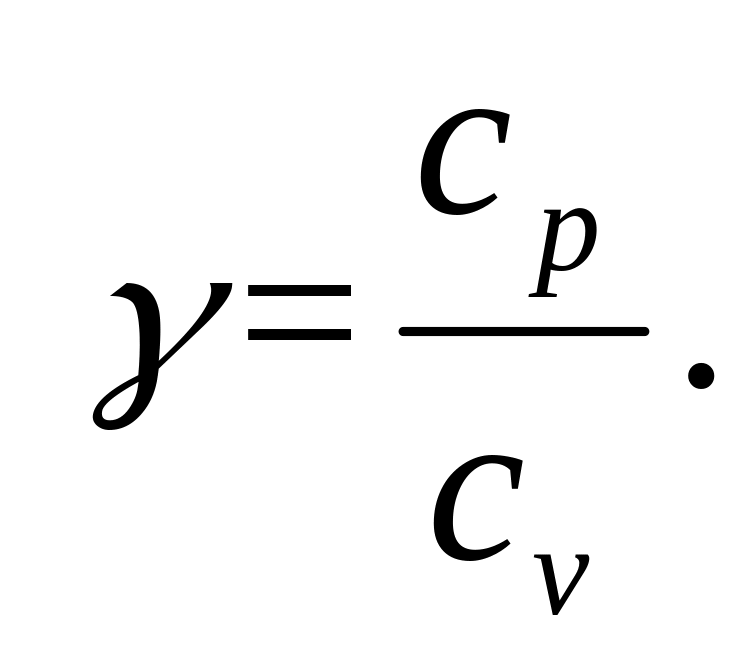
(11)
Після|потім| інтеграції і потенціювання (10) одержимо|отримаємо| рівняння Пуассона
PV2 = const
Прилад Клемана-Дезорма, за допомогою якого можна визначити величину ср/сv (рис4.1). Він є балоном (1) на 10 л з|із| повітрям, яке накачується ручним насосом (2) до деякого тиску|тиснення| p, надлишок якого h = p – p0 над атмосферним p0 визначається по водяному манометру (3), який сполучається з балоном (1) гумовим шлангом (4).
Для здійснення швидкого (адиабатного|) розширення повітря з|із| балона (1) до атмосфери служить клапан (5).

Рис.4.1. Схема установки Клемона – Дезорма для визначення відношення теплоємностей газу
1- балон; 2 – ручний насос; 3 - водяний манометр; 4 – гумовий шланг; 5 – клапан.
Виділимо (у думках) усередині повітря, що знаходиться|перебуває| в балоні (1), деяку масу m і простежимо за зміною її стану під час експерименту|досліду| при одночасній зміні тиску|тиснення| p і температури T.
Якщо клапан (5) відкритий|відчинений|, то тиск|тиснення| в судині|посудині| рівний атмосферному P0; температура повітря в судині|посудині| рівна T0 – температурі навколишнього середовища. Тоді параметрами виділеної в думках маси повітря будуть, V0, T0, P0 де V0 – об'єм|обсяг| даної маси повітря при тиску|тисненні| P0 і температурі T0.
Якщо тепер закрити|зачинити| клапан (5) і накачати за допомогою насоса в судину|посудину| деяку кількість повітря, то маса повітря, що розглядається|розглядується| нами, стиснеться|стискуватиметься|, а температура і тиск|тиснення| її підвищаться. Через деякий час у наслідок|внаслідок| теплообміну з|із| навколишнім середовищем температура повітря в судині|посудині| стане рівною T0. Тиск|тиснення| же буде рівний:
-
 ,
,(12)
де h1 – остаточна (після|потім| встановлення теплової рівноваги з|із| навколишнім середовищем) різниця рівнів рідини в манометрі. Стан даної маси повітря визначається тепер параметрами V1 , P1 , T0 – це I стан виділеної маси повітря; V1 – об'єм|обсяг| даної маси повітря при тиску|тисненні| P1 і температурі T0.
Якщо на короткий час ( 1-2 с|із|) відкрити|відчинити| клапан (5), то повітря, що знаходиться|перебуває| в балоні, швидко (за адіабатою) розшириться і внаслідок цього охолоджується. В кінці|у кінці,наприкінці| цього малого проміжку часу, протягом якого клапан (5) відкритий|відчинений|, і балон сполучається з атмосферою, тиск|тиснення| повітря у середині судини|посудини| стане рівним тиску|тисненню| атмосфери, і стан даної маси повітря визначатиметься у цей момент наступними|такими| параметрами, V2, P0 , T1– це II стан виділеної маси повітря;
V2
–
об'єм|обсяг|
даної маси повітря при тиску|тисненні|
P0
і
температурі T1.
При цьому
![]() <
<
![]() .
.
Коли тиск|тиснення| в судині|посудині| (1) стане|чинитиметься| рівним тиску|тисненню| атмосфери P0 (через 1-2 с|із|), клапан (5) закривають|зачиняють|. Повітря, що знаходиться|перебуває| в балоні (1), починає|розпочинає,зачинає| нагріватися від T1 до T0 у наслідок|внаслідок| отримання|здобуття| тепла від навколишнього середовища, тиск|тиснення| в судині|посудині| починає|розпочинає,зачинає| підвищуватися і стане рівним:
-
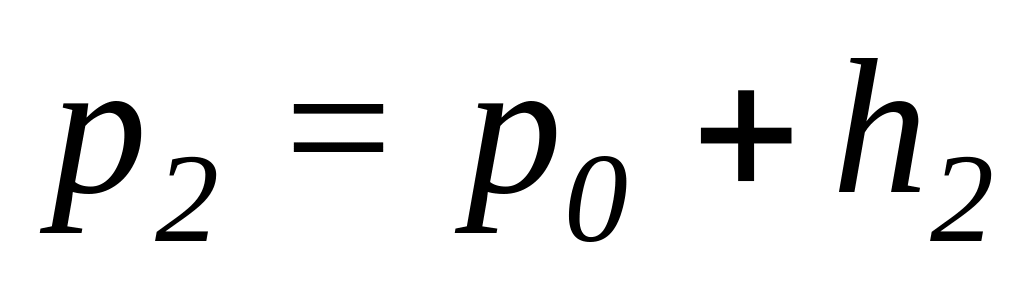 ,
,(13)
де h2 – різниця рівнів рідини в манометрі після того, як температура газу в балоні стане рівній температурі навколишнього середовища.
Дана маса повітря тепер характеризується параметрами V2 , P2 , T0 – це III стан даної маси повітря.
Отже, дана маса повітря під час експерименту знаходилася|перебувала| послідовно в трьох станах:
I. |
V1, |
P1, |
T0 |
II. |
V0, |
P0, |
T1 |
III. |
|
P2, |
T0 |
Перехід із стану I в стан II відбувається адіабатно, із стану II в – стан III – ізохорно.

Рис.4.2 .Графіки процесів.
На Рис4.2. зображені|змальовані| графіки процесів: крива I-II – адіабата, крива II-III – ізохора, крива III-I – ізотерма. Газ в станах I-III має однакову температуру.
Перехід із|із| стану I в стан II описується рівнянням Пуассона:
-

(14)
Параметри станів I і III задовольняють закону Бойля-Маріотта:
-
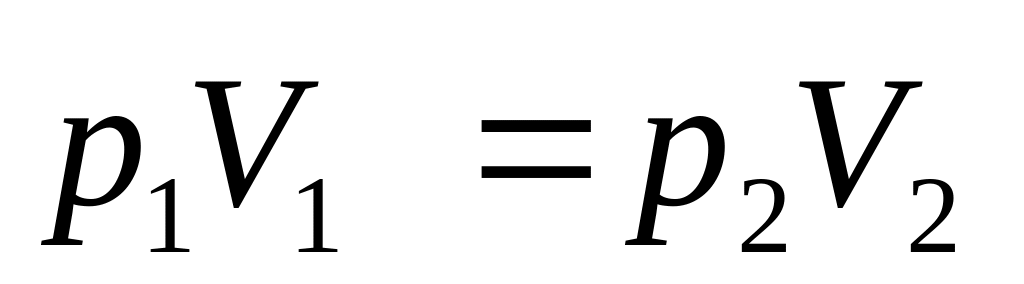 .
.(15)
Піднісши рівняння (15) до ступеня і розділивши його за членами| на (14), отримаємо|отримаємо|:
-
 ,
,
Звідси
-
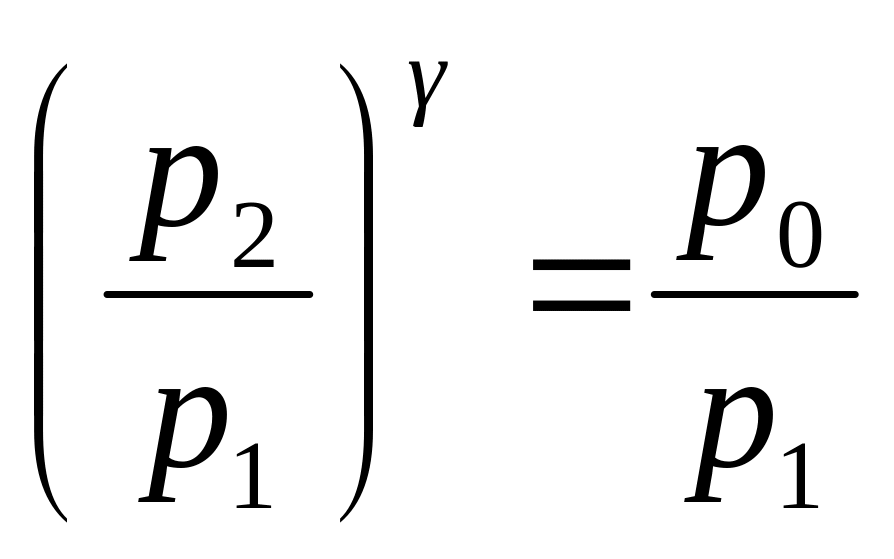 ,
,(16)
Враховуючи рівність (12) і (13), отримаємо|отримуємо|, що
-
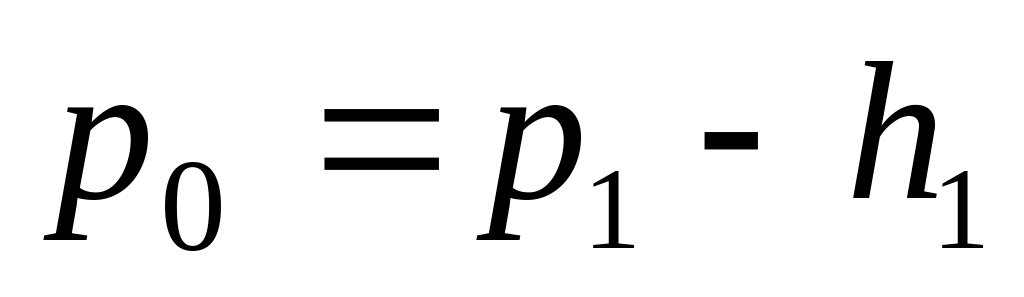 ,
,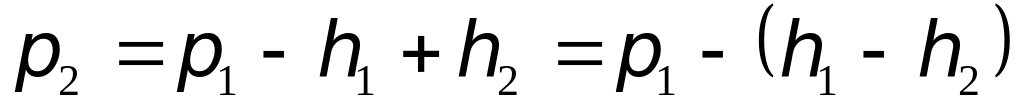
і, підставляючи їх в рівність (16), маємо
-

(17)
Оскільки|тому що| h1 – h2 p1, то, розклавши в ряд|лаву,низку| ліву частину|частку| (17) і обмежившись першим членом розкладання, отримаємо
|отримаємо|
-
 .
.(18)
Прирівнявши праві частини|частки| (17) і (18), отримаємо|отримаємо| наступну|слідуючу| формулу:
-
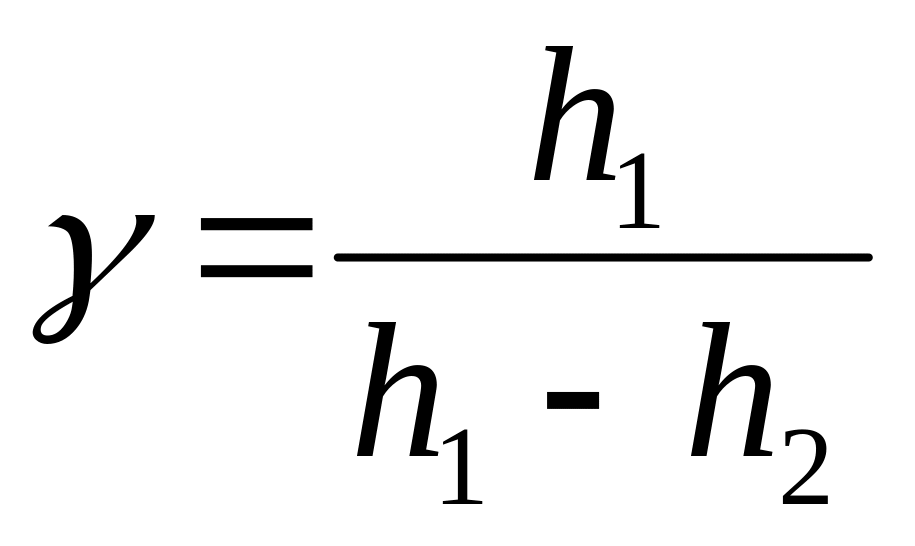
(19)
яка і використовується в цій роботі для експериментального визначення .
