
- •Основы молекулярной физики и термодинамики
- •Основное уравнение молекулярно-кинетической теории идеальных газов
- •Уравнение состояния идеального газа (Клапейрона – Менделеева)
- •Статистические распределения
- •Распределение молекул газа по скоростям (закон Максвелла)
- •Среднее число столкновений и средняя длина свободного пробега молекул. Вакуум
- •Явления переноса в газах: диффузия, теплопроводность, внутреннее трение
Основы молекулярной физики и термодинамики
Два подхода различны, но взаимно дополняют друг друга.
Молекулярная (статистическая) физика использует математический аппарат теории вероятностей и представляет процессы, происходящие в телах как результат осредненного движения атомов и молекул.
Термодинамика основана на общих принципах (началах), которые являются обобщением опытных фактов и используются для описания состояния термодинамической системы в условиях равновесия и процессов перехода из одного состояния в другое.
Молекулярно-кинетическая теория идеальных газов (мкт)
Основное уравнение молекулярно-кинетической теории идеальных газов
В молекулярно-кинетической теории (МКТ) используют модель идеального газа, которая удовлетворяет следующим условиям:
собственный объем молекул газа мал по сравнению с занимаемым этим газом объемом (молекулы –материальные точки);
между молекулами газа отсутствуют силы взаимодействия;
столкновения молекул газа между собой и со стенками абсолютно упругие.
Основное
уравнение МКТ связывает параметры
состояния газа: давление Р,
объем V
и абсолютную температуру Т
с осредненными характеристиками движения
его молекул, т. е. со средней квадратичной
скоростью
![]() и средней кинетической энергией молекул
и средней кинетической энергией молекул
![]() .
.
Для
вывода основного уравнения МКТ рассмотрим
одноатомный идеальный газ, молекулы
которого движутся с постоянной скоростью
![]() ,
а число столкновений между ними малό
по сравнению с числом ударов о стенки
сосуда (столкновения абсолютно упругие).
Хаотическое движение молекул, для
которых равновероятны все направления,
заменим движением вдоль трех
взаимно-перпендикулярных осей x,
y,
z.
,
а число столкновений между ними малό
по сравнению с числом ударов о стенки
сосуда (столкновения абсолютно упругие).
Хаотическое движение молекул, для
которых равновероятны все направления,
заменим движением вдоль трех
взаимно-перпендикулярных осей x,
y,
z.
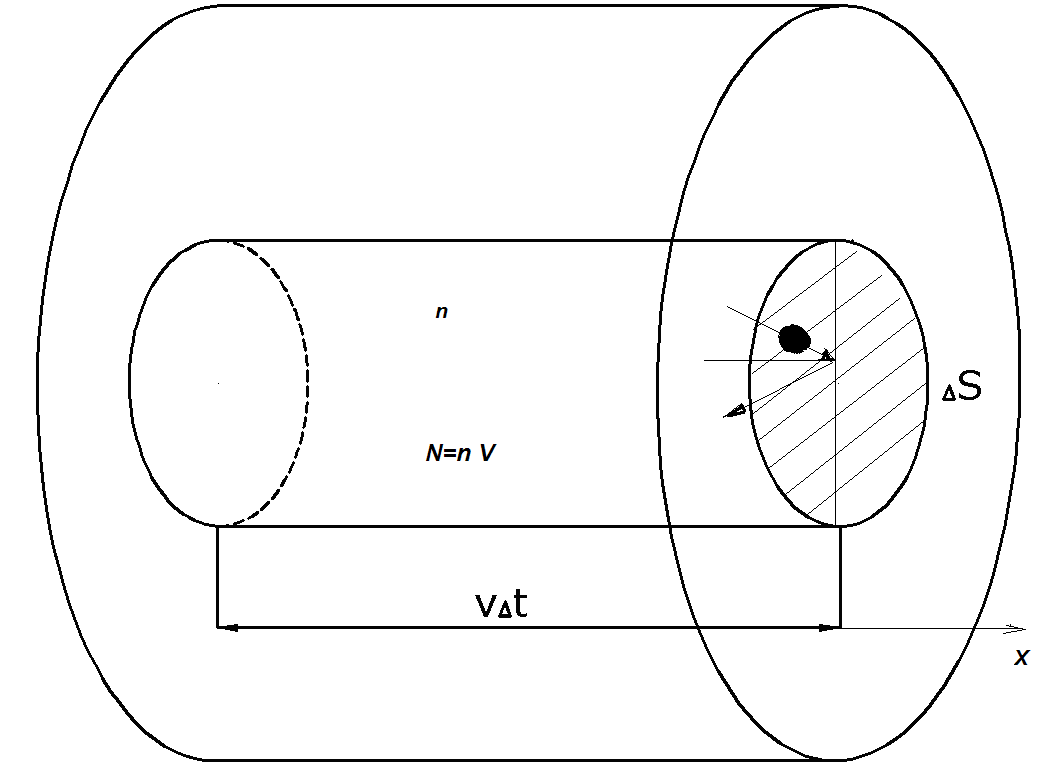
Выделим на стенке сосуда элементарную площадку s и рассчитаем давление, которое оказывает на нее идеальный газ.
При каждом соударении молекула массой mо передает стенке импульс
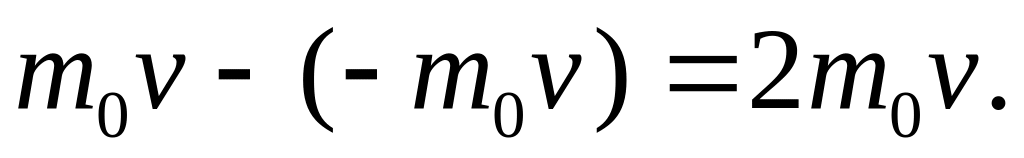
За
время
![]() выделенной площадки
выделенной площадки
![]() могут
достигнуть только те молекулы, которые
заключены в объеме цилиндра с основанием
и высотой
могут
достигнуть только те молекулы, которые
заключены в объеме цилиндра с основанием
и высотой
![]() .
Если принять, что n
– концентрация
молекул, т. е. количество молекул в
единице объема, то общее число молекул,
находящихся в объеме цилиндра, можно
представить как
.
Если принять, что n
– концентрация
молекул, т. е. количество молекул в
единице объема, то общее число молекул,
находящихся в объеме цилиндра, можно
представить как
![]()
в любой момент времени вдоль оси x движется 1/3 всех молекул (1/3 N), находящихся в объеме выделенного цилиндра, а к рассматриваемой площадке – 1/6 N, так как два направления равновероятны.
Следовательно, о площадку ударится 1/6 N или
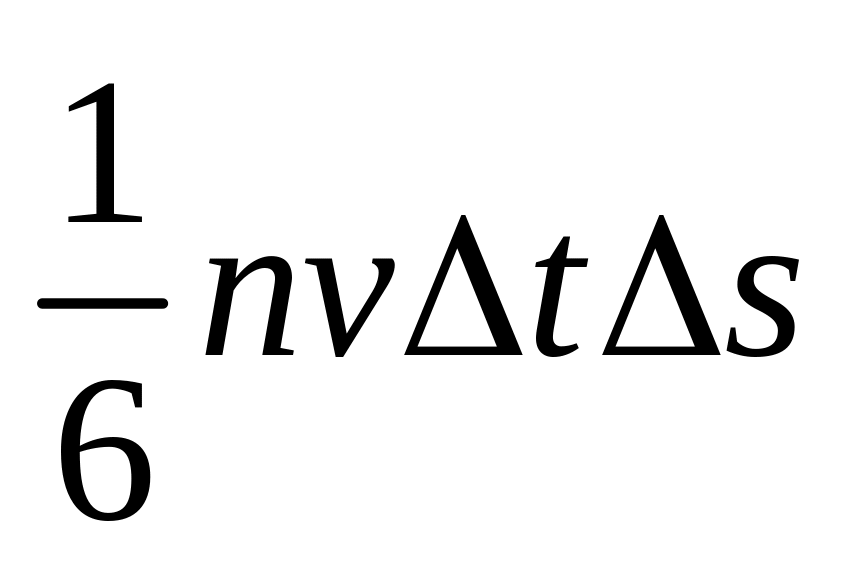 молекул,
которые передадут ей импульс
молекул,
которые передадут ей импульс![]()
![]() .
.
По второму закону Ньютона
![]() .
.
Давление
Р,
оказываемое на площадку, определится
как

![]()
При
выводе уравнения предполагалось, что
скорости молекул одинаковы,
однако, они двигаются с разными скоростями
v1,
v2,
... vn.
Таким образом, всю совокупность молекул
N
характеризует
средняя квадратичная скорость
![]() ,
которая определяется как
,
которая определяется как
![]() .
.
С учетом этого давление
![]()
или
![]()
основное уравнение МКТ.
Связь
термодинамической характеристики газа,
его температуры T,
с осредненной кинетической энергией
теплового движения молекул
![]() была установлена Больцманом и имеет
вид
была установлена Больцманом и имеет
вид
![]()
где
k
– постоянная
Больцмана, равная
![]()
При
Т
= 0 средняя кинетическая энергия теплового
движения молекул
![]() ,
т. е. должно прекратиться тепловое
движение молекул.
,
т. е. должно прекратиться тепловое
движение молекул.
Из основного уравнения МКТ следует, что
![]()
т. е. давление идеального газа прямо пропорционально концентрации его молекул и температуре газа.
