
Лабораторная диагностика.
В практике лабораторной диагностики чумы широко применяются серологические методы: ИФА, РНГА, РНАт, РНАг, РТНГА. Важное значение имеет постановка биологической пробы на морских свинках и белых мышах, позволяющая увеличить вероятность выделения культур и облегчить их идентификацию.
Материалом для исследований служат отделяемое бубонов, содержимое язв или других кожных поражений, мокрота и слизь из зева, кровь, фекалии и СМЖ.
Все мероприятия проводят в специализированных лабораториях с соблюдением условий предохранения от лабораторного заражения (противочумные костюмы, защитные устройства и т.д.). Материал засевают на твёрдые питательные среды и, при необходимости, па жидкую среду накопления. Затем готовят мазки из изолированных колоний. Для экспресс-диагностики используют метод ускоренного роста на средах обогащения, а также ставят РИФ с мечеными AT (выявляет Y. pestis в различных объектах в течение первых 2 ч исследования).
Схема лабораторной диагностики антропозоонозной чумы.
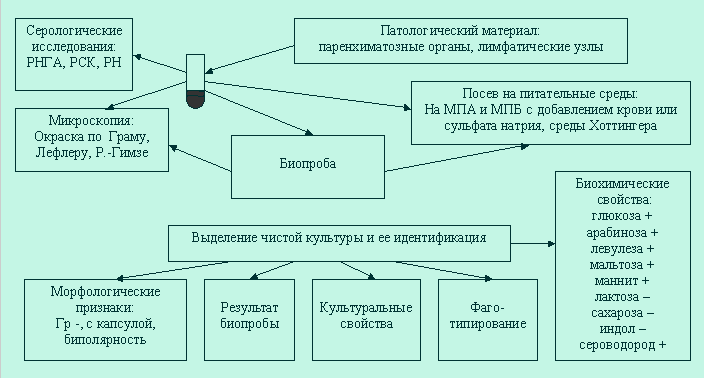
Микроскопическое исследование :
мазки фиксируют погружением полностью в жидкость Никифорова на 20 мин. Окраска по Граму обязательна во всех случаях. Одновременно окрашивают мазок метиленовым синим по Лефлеру, так как этот метод лучше выявляет биполярность. Можно использовать окраску по Романовскому Гимзе.
Бактериологическое исследование - посевы исследуемого материала производят на агар добавлением стимуляторов роста (кровь, сульфит натрия). При исследовании материала, обильно загрязненного посторонней микрофлорой (загнившие трупы, мокрота) к агару добавляют генциановый фиолетовый 1 : 100 000. В случаях подозрения на наличие бактериофага посевы обрабатывают антифаговой сывороткой. Оптимальная температура 28-30oС,срок культивирования 18-20 часов появляются колонии в виде характерных "кружевных платочков". Возбудитель чумы — факультативный анаэроб. Хорошо растет на обычных жидких , питательных средах (мясо-пептонный агар, бульон)
Когда чистая культура выделена путем прямого посева она подлежит идентификации на основании следующих данных:
1) внешний вид колонии на агаре;
- на МПА – блестящие, серо-белые колонии, прозрачные, соответствуют R-форме (вирулентные).
Начало развития колонии обнаруживается в виде появления очень маленьких рыхлых глыбок и затем плоских слоистых образований с неровными краями, напоминающих кружевной платочек серовато-белого с голубоватым оттенком цвета. Колониям присущ полиморфизм. (в первые 24 ч колонии растут в виде «битого стекла», через 48 ч в виде «кружевных платочков».)

(Рост на МПА) (Рост на кровяном агаре)
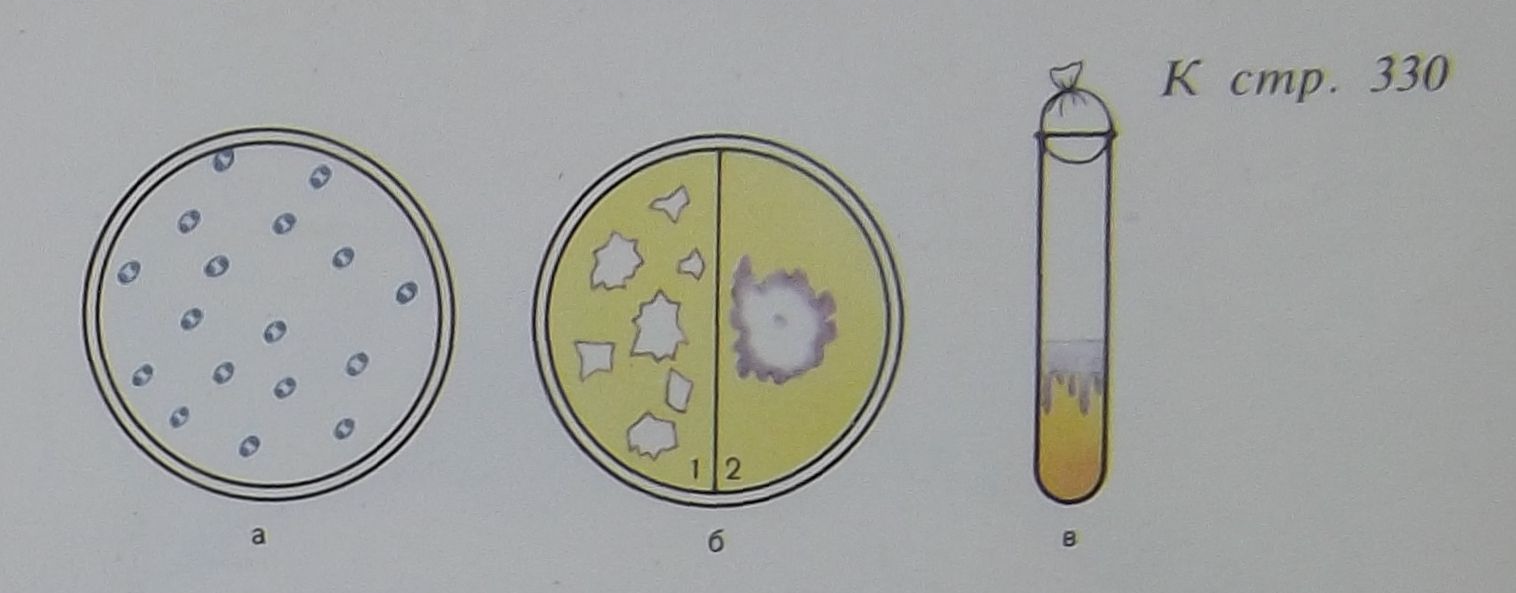
а -бактерии чумы (окраска синим Леффлера); б—рост на МПА: 1 — через 24 ч в виде битого стекла; 2—через 48 ч в виде кружевного платочка: в—рост на МПБ — «сталактитовый».
2) характерный рост на бульоне;
- на МПБ – отмечают агглютинативный рост с поверхностной нежной плёнкой , при малейшем движении падающей на дно в виде сталактитов и образующей рыхлый осадок.
3)типичная морфология микробов в мазках и окраска по Граму;
-микрокартина: полиморфные палочки, располагаются одиночно и в виде цепочки длиною до 1-2 мкм шириной 0,3...0,5 мкм. При окраски метиленовой синью – биполярны. Грамотрицательные, спор не образуют, капсулу образуют на питательных средах, неподвижны.
4) типичная патологоанатомическая у лабораторных животных при заражении их чистой культурой;
5) агглютинация со специфической сывороткой;
- Антигены чумной палочки идентифицируют в РА, РНГА, РП в стандартных агаровых пластинках, РНАТ, ИФА и др.
6) отношение к специфическому бактериофагу.
7) аллергическая проба при чуме постановка кожных проб с пестином (белковый аллерген из культур возбудителя чумы).
8) Обнаружение AT в крови больных чумой выявляют посредством РНГА, ИФА и др
Исследование ферментативных свойств, подвижности и т. п., производят лишь в специальных случаях для дифференциального диагноза с родственными видами бактерий.
Обладают сахаролитическими свойствами ферментируют с образованием пленки глюкозу, левулезу, мальтозу, галактозу, арабинозу, ксилозу и маннит, продуцируют дегидразы и уреазы, восстанавливают нитриты в нитраты. Желатин не разжижают, индол не образуют, могут образовывать сероводород. Мочевину не разлагает, метиленовый синий не редуцирует.
- Биохимическую идентификацию возбудителя чумы проводят в соответствии с принципами, применяемыми в отношении прочих энтеробактерий. В соответствии со способностью ферментировать глицерин и углевод мелибиозу выделяют биовары antigua (+, -) medievalis (+, +) и orientalis (-, -). Первый биовар выделяют в Центральной Азии и Центральной Африке, второй — в Средней Азии и Иране, третий — повсеместно. Отечественная классификация выделяет подвиды pestis (основной подвид), altaica (алтайский подвид), caucasica (кавказский подвид), hissarica (гиссарский подвид) и udegeica (удэгейский подвид).
Для проведения ускоренной диагностики чумы используют чумной бактериофаг. Его высокая специфичность и вирулентность для чумной палочки позволяют применять его для идентификации чумы путём внесения в исследуемый материал — о положительном результате свидетельствует образование негативных колоний бактериофага либо увеличение титра бактериофага в среде.
Метод ускоренного обнаружения возбудителя чумы с помощью бактериофага, внесенного в исследуемый материал, используют для исследования объектов, имеющих основное практическое значение: материал от больного, от трупа, из внешней среды.
Проба с фагом осуществляется на твердых средах путем нанесения капли фага на свежий посев культуры и на жидких путем добавления в бульонную культуру фага в количестве 1/10 объема культуры. Окончательное заключение делают на основании изучения комплекса признаков исследуемой культуры. При этом не следует забывать явлении изменчивости.
Исследуемый материал наносят на 3 агаровые пластины с гемолизированной кровью и генциановым фиолетовым. На первой и второй агаровой пластине в исследуемый материал сразу же вносят чумной бактериофаг (разведенный в 10 раз). На третью чашку бактериофаг не добавляют (контроль).
Результаты начинают читать через 2,5 -- 3 ч после помещения их в термостат. При наличии значительного количества микробов чумы в исследуемом материале уже через 2 ч на фоне начального роста чумного микроба видны мелкие палочки бактериофага. Метод ускоренной диагностики чумы основан на свойстве чумного бактериофага быстро (30-40 мин) размножаться в присутствии микроба чумы.
Биологическую пробу проводят при сильной контаминации материала посторонней микрофлорой. Для пробы используют наиболее чувстительных лабораторных животных морских свинок и белых мышей, заражаемых подкожно, внутрикожно или внутрибрюшинно. Выявление Аг возбудителя в тканях погибших животных проводят при помощи РИГА, ИФА или с использованием AT, меченных флюоресцеинами. При снижении вирулентности или применении малой заражающей дозы перед заражением животным вводят глюкокортикоиды, что позволяет ослабить защитные силы и ускорить получение результата.
В зависимости от способа заражения и степени чувствительности к возбудителю животные погибают от чумы на 3-9-й день после инфицирования изменения во внутренних органах в виде геморрагического воспаления, кровоизлияния: в мазках-отпечатках из органов - множество чумных микроорганизмов; посевы инфицированных органов и крови дают обильный рост возбудителя.
Большого внимания заслуживает люминесцентно-серологическй метод, с помощью которого можно обнаружить возбудитель чумы в воздухе, воде, пищевых продуктах. Реакция нарастания титра фага (в качестве индикаторного фага предложен чумной бактериофаг, выпускаемый институтом "Микроб" в качестве эталонной культуры). Применение реакции нарастания титра фага для индикации чумных микробов основано на экспериментальном исследовании; пользуясь реакцией нарастания титра фага, за 3-31/2 ч удается обнаружить 1 млн. палочек чумы.
В качестве исследуемого материала могут быть использованы вода, кровь, отпечатки из органов, выделения из бубона. Материал сначала подращивают на средах, затем прибавляют генциан фиолетовый (1 мл 0,1 %-ный водно-спиртовой раствор на 100 мл среды), для подавления посторонней микрофлоры, а затем добавляют в пробирки разные концентрации фага.
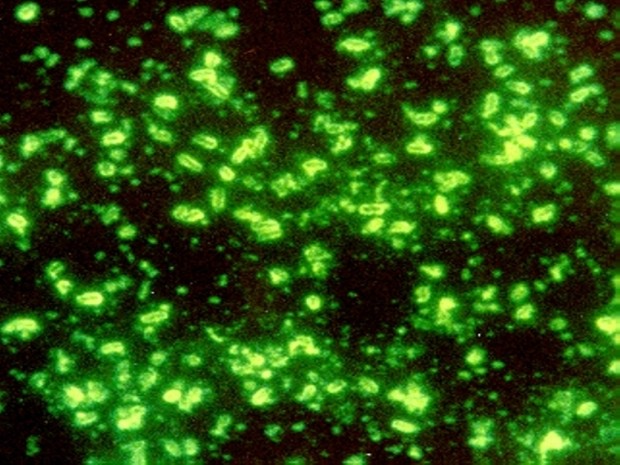
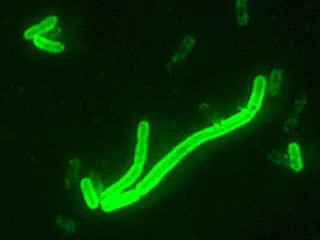
(Флуорисцирующая микроскопия)
.
