
- •Програма навчальної дисципліни “Хімія неорганічна і аналітична”
- •Тема 1. Основні закони хімії як базис хімічних методів аналізу
- •Тема 2. Залежність властивостей речовин від будови атомів та природи хімічних зв’язків
- •Змістовий модуль 2. Розчини. Закономірності протікання хімічних реакцій в розчинах. Класи неорганічних речовин.
- •Тема 3. Класифікація неорганічних сполук. Комплексні сполуки, їх застосування у методах аналізу
- •Тема 4. Молекулярно-йонна рівновага в розчинах
- •Тема 5. Хімічна кінетика і хімічна рівновага.
- •Тема 6. Окисно-відновні реакції, їх застосування в одержанні речовин та у методах аналізу
- •Змістовий модуль 3. Основи якісного і кількісного хімічного аналізу
- •Тема 7. Основи якісного хімічного аналізу сировини та матеріалів
- •Тема 8. Кількісний аналіз. Метрологія хімічного аналізу
- •Змістовий модуль № 4. Основні властивості хімічних елементів і їх сполук.
- •Тема 9. Хімія металів
- •Тема 10. Хімія неметалів
- •Загальні вказівки до виконання лабораторних робіт і правила роботи в лабораторії
- •Список рекомендованої літератури
- •Інформаційні ресурси
- •Лабораторне заняття № 2 Тема: «Основні поняття і закони хімії. Визначення хімічного еквіваленту металу»
- •Практичне заняття № 3 Тема: «Будова атома і систематика хімічних елементів»
- •Практичне заняття № 4 Тема: «Хімічний зв’язок. Будова і властивості молекул. Будова твердих і рідких тіл»
- •Лабораторне заняття № 5 Тема: «Хімічна кінетика. Хімічна рівновага»
- •Лабораторне заняття № 6 Тема: «Розчини. Концентрація і властивості розчинів»
- •Лабораторне заняття № 7 Тема: «Електролітична дисоціація. Гомогенна і гетерогенна рівновага у розчинах електролітів»
- •Лабораторне заняття № 8 Тема: «Дисоціація води. Водневий показник pH. Гідроліз солей»
- •Лабораторне заняття № 9 Тема: «Окиснювально-відновні реакції»
- •Лабораторне заняття № 10 Тема: «Електрохімічні процеси. Гальванічні елементи»
- •Лабораторне заняття № 11 Тема: «Комплексні сполуки»
- •12.1.2. Приготування 0,1 н. Розчину хлоридної кислоти
- •Методика приготування
- •100 Г розчину – 37 г
- •Лабораторне заняття № 13 Тема: «Стандартизація робочих розчинів у методі нейтралізації»
- •13.1. Стандартизація хлоридної кислоти за натрій тетраборатом
- •Методика визначення
- •Лабораторне заняття № 14 Тема: «Визначення масової частки натрій карбонату у технічному зразку»
- •14.1. Визначення вмісту натрій карбонату у технічній соді
- •Методика визначення
- •Лабораторне заняття № 15 Тема: «Методи окиснення-відновлення. Йодометрія»
- •15.1. Йодометрія
- •15.1.1. Стандартизація розчину натрій тіосульфату за калій біхроматом
- •Методика визначення
- •15.1.2. Визначення солей купруму (іі)
- •Методика визначення
- •Лабораторне заняття № 16 Тема: «Методи осадження. Аргентометрія»
- •16.1. Аргентометрія
- •16.1.1. Стандартизація розчину арґентум нітрату за натрій хлоридом
- •Методика визначення
- •17.1. Комплексонометричне титрування
- •17.2. Приготування стандартного розчину едта
- •17.3. Визначення загальної твердості води
- •17.4. Визначення тимчасової (карбонатної) і постійної (хлоридно-сульфатної) твердості води
- •Індивідуальне завдання № 1 Приклади розв’язування типових задач
- •Умови завдання
- •Індивідуальне завдання № 2 Приклади розв’язування типових задач
- •Умови задач
- •Індивідуальне завдання № 3 Умови завдань
- •Індивідуальне завдання № 4 Приклади розв’язування типових задач Розрахунки в титриметричному аналізі
- •Завдання
- •Завдання контрольної роботи
- •Варіанти контрольних завдань
Лабораторне заняття № 6 Тема: «Розчини. Концентрація і властивості розчинів»
Питання для самостійної підготовки
Які системи називають істинними розчинами?
Від яких факторів залежить розчинність речовин? Теплові ефекти при розчиненні.
Способи вираження концентрації розчинів: масова частка, молярність, нормальність, моляльність, титр, мольна доля.
Фізичні властивості розчинів неелектролітів: ебуліо- і кріоскопія, осмос.
Визначити масову частку розчиненої речовини в 2 М розчині
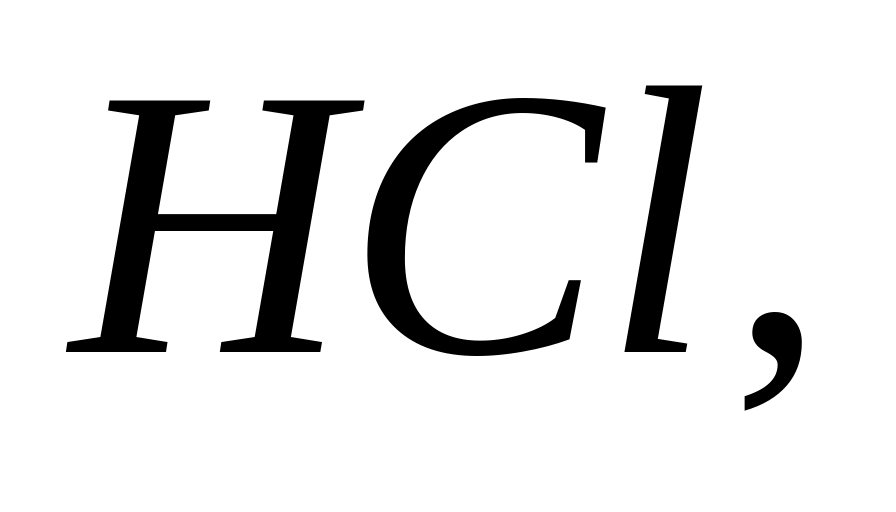 якщо густина цього розчину становить
1,035 г/см3.
якщо густина цього розчину становить
1,035 г/см3.Визначити молярність, нормальність, моляльність і титр розчину сульфатної кислоти з масовою часткою розчиненої речовини 20 %, густина якого 1,14 г/см3.
Який об’єм гідроген хлориду, виміряний при 7 0С і тиску 0,8 атм, слід розчинити в 450 мл води, щоб отримати розчин кислоти з масовою часткою 10 %?
У 7 л розчину міститься 24,4 г неелектроліту. Осмотичний тиск розчину при 0 0С рівний 1,3 атм. Знайти молярну масу неелектроліту.
Деяку речовину масою 5 г розчинили у 200 мл води. Температура кипіння цього розчину становить 100,432 0С. Обчислити молярну масу розчиненої речовини.
Дослід 6.1. Приготування розчину з заданою масовою часткою із наважки твердої речовини
Отримати у викладача завдання для приготування розчину речовини з заданою масовою часткою. Провести розрахунки необхідної кількості твердої речовини і води. Результати розрахунків записати в зошиті.
На технічній вазі у бюксі зважити з точністю до 0,1 г речовину і за допомогою мірного циліндра відміряти необхідний об’єм води. У приготовлену колбу через воронку перенести наважку речовини, ополоснути бюкс і воронку невеликою кількістю води, виміряною для розчинення. Вміст колби перемішувати до повного розчинення речовини, поступово доливаючи виміряну воду. Якщо при розчиненні речовини пройшло помітне нагрівання чи охолодження розчину, слід охолодити чи нагріти його до кімнатної температури, а потів ареометром виміряти густину. За довідником перевірити правильність приготування розчину, порівнявши експериментально знайдену за густиною концентрацію і розраховану попередньо. Визначити абсолютну і відносну похибки експерименту.
Дослід 6.2. Приготування розчину заданої концентрації з більш концентрованого розчину
За допомогою ареометра виміряти густину розчину і в довіднику знайти його масову частку. Розрахувати об’єм вихідного розчину і води, необхідних для приготування заданої кількості розчину. Приготувати розчин і розрахувати його молярність і нормальність.
Дослід 6.3. „Силікатний сад”
Налити в стакан 300-400 мл 10 %-ного розчину натрій силікату і 50-60мл хлоридної кислоти (1:3). Внести у розчин великі кристали солей кобальт, ферум, купрум і нікол хлоридів. Через деякий час у стакані утворюються різні за формою і забарвленням „рослини”.
Пояснити явища, що спостерігаються, беручи до уваги, що на поверхні кристалів солей кобальту, заліза, міді і нікелю утворюються тонкі плівки їх силікатів, які є проникні для молекул води, але не проникні для гідратованих йонів.
