
- •Водородный показатель
- •Парциальное давление углекислого газа
- •Концентрация бикарбонат-ионов
- •Концентрация буферных оснований
- •Избыток буферных оснований
- •Величина рН формирует активность клеток
- •Кислород-связанные показатели
- •Быстрая компенсация сдвигов рН
- •Бикарбонатная буферная система
- •Фосфатная буферная система
- •Белковая буферная система
- •Гемоглобиновая буферная система
- •Длительная стабилизация сдвигов рН
- •Дыхательная система
- •Костная ткань
- •Реабсорбция бикарбонат-ионов
- •Процесс реабсорбции бикарбонат-ионов
- •Ацидогенез
- •Процесс ацидогенеза в почечных канальцах
- •Аммониегенез
- •Процесс аммониегенеза в дистальных канальцах
- •Основа рака - кислая среда.
- •Кислотно-щелочной фактор географии:)
- •Продукты, окисляющие или ощелачивающие организм (по н.В. Уокеру и р.Д. Поупу)
ЩЕЛОЧНАЯ СИСТЕМА ОЗДОРОВЛЕНИЯ ПРИЛОЖЕНИЕ 1
КИСЛОТНО-ЩЕЛОЧНОЕ РАВНОВЕСИЕ. Во-первых, здесь из разных источников собрана информация по кислотно-щелочному равновесию. С разных сторон, разным языком, под разными углами зрения, порой просто короткие факты. А во-вторых, разумеется, здесь же я собираю и всё, что касается нарушения этого равновесия - все факторы, которые его нарушают в ту или иную сторону. В основном это, конечно проблема закисления - ацидоза. ВСЁ ПО НАУКЕ:) Первым делом - о рН строго научно. Из курсов лекций по биохимии для студентов-медиков. И тут мы, кстати, можем увидеть роль бикарбоната натрия вообще в обмене веществ. Ведь существует целая система, основанная на бикарбонате натрия, и называется - "буфер бикарбоната натрия"! И чтобы увидеть как это всё работает мы тут коснемся не только этого буфера, но и других буферных систем крови - систем, которые участвуют в поддержании кислотно-щелочного равновесия (которое на этом - строго научном языке - называется кислотно-основное состояние).
Показатели кислотно-основного состояния
Кислотно-основное
состояние крови является важнейшим
показателем для жизни организма.
В
настоящее время исследование
кислотно-основного состояния крови
проводится на газовых анализаторах,
которые с учетом температуры крови и
давления напрямую определяют концентрацию
ионов Н+ (величину рН) и показатель
pCO2 (количество
СО2).
Остальные
параметры рассчитываются, исходя из
уравнения Гендерсона-Гассельбаха:
![]() где
рК' – константа диссоциации угольной
кислоты (рК'=6,1)
где
рК' – константа диссоциации угольной
кислоты (рК'=6,1)
Водородный показатель
Водородный показатель (рН) – отрицательный десятичный логарифм активности (или концентрации) водородных ионов в растворе. Он является основной количественной характеристикой кислотности водных растворов:
рН = –lg[H+]
В случае равенства концентраций ионов H+ и ОН– величина рН среды соответствует 7,0, т.е. среда нейтральная. Именно таковой и является простая вода - Н2О В растворах кислот и щелочей концентрация ионов H+ не равна концентрации ионов ОН– и рН соответственно меньше или больше 7. Повышение концентрации ионов Н+ вызывает соответствующее уменьшение концентрации ионов ОН–, и наоборот.
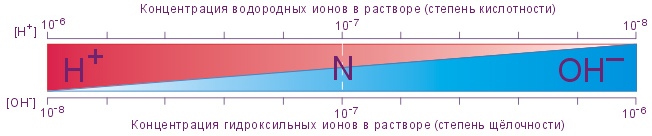
В норме концентрация ионов Н+ колеблется от 36 до 45 нмоль/л, в среднем она составляет 40 нмоль/л, что соответствует рН 7,4. Снижение величины рН или накопление ионов Н+ называется ацидоз (закисление) , увеличение рН или дефицит ионов Н+ – алкалоз (защелачивание).
Водородный показатель является главным и его значение определяет диагноз ацидоза или алкалоза. Изменение показателя происходит при накоплении кислотных или щелочных эквивалентов.
Парциальное давление углекислого газа
Парциальное давление или напряжение углекислого газа (рСО2) – давление СО2 в газовой смеси, находящейся в равновесии с плазмой артериальной крови при температуре 38°С. Показатель является критерием концентрации углекислоты в крови. Изменение показателя рСО2 играет ведущую роль при респираторных нарушениях кислотно-основного состояния (респираторного ацидоза и респираторного алкалоза) При респираторном ацидозе рСО2 увеличивается из-за нарушения вентиляции легких, что и вызывает накопление угольной кислоты, При респираторном алкалозе рСО2 снижается в результате гипервентиляции легких, которая приводит к повышенному выведению из организма углекислоты и перещелачиванию крови. При нереспираторных (метаболических) азидозах/алкалозах показатель рСО2 не изменяется. Если налицо такие сдвиги рН и показатель pCO2 не в норме, то имеются вторичные (или компенсаторные) изменения. При клинической оценке сдвига показателя рСО2 важно установить, являются ли изменения причинными или компенсаторными! Таким образом, повышение показателя pCO2 происходит при респираторных ацидозах и компенсированном метаболическом алкалозе, а снижение– при респираторных алкалозах и компенсации метаболического ацидоза. Колебания величины рСО2 при патологических состояниях находятся в диапазоне от 10 до 130 мм рт.ст. При респираторных нарушениях направление сдвига величины рН крови противоположно сдвигу рСО2, при метаболических нарушениях – сдвиги однонаправлены.
Концентрация бикарбонат-ионов
Концентрация бикарбонатов (ионов HCO3-) в плазме крови является третьим основным показателем кислотно-основного состояния. На практике различают показатели актуальных (истинных) бикарбонатов и стандартных бикарбонатов. Актуальные бикарбонаты (AB, АБ) – это концентрация ионов HCO3– в исследуемой крови при 38°С и реальных значениях pH и pCO2. Стандартные бикарбонаты (SB, СБ) – это концентрация ионов HCO3– в исследуемой крови при приведении ее в стандартные условия: полное насыщение кислородом крови, уравновешивание при 38°С с газовой смесью, в которой pCO2 равно 40 мм рт.ст. У здоровых людей концентрация актуальных и стандартных бикарбонатов практически одинакова.
Диагностическое значение концентрации бикарбонатов в крови состоит, прежде всего, в определении характера нарушений кислотно-основного состояния (метаболического или респираторного). Показатель в первую очередь изменяется при метаболических нарушениях: • при метаболическом ацидозе показатель HCO3– снижается, т.к. расходуется на нейтрализацию кислых веществ (буферная система) • при метаболическом алкалозе – повышается Так как угольная кислота очень плохо диссоциирует и ее накопление в крови практически не отражается на концентрации HCO3–, то при первичных респираторных нарушениях изменение бикарбонатов невелико. При компенсации метаболического алкалоза бикарбонаты накапливаются вследствие урежения дыхания, при компенсации метаболического ацидоза – в результате усиления их почечной реабсорбции.
