
- •Конспект лекций по общей и неорганической химии Строение атома и периодическая система д.И. Менделеева
- •Лекция : Комплексные соединения Состав комплексных соединений.
- •Номенклатура комплексных соединений.
- •Химическая связь в комплексных соединениях.
- •Равновесие в системах, содержащих комплексные соединения. Устойчивость комплексных соединений.
- •Основные типы комплексных соединений.
- •Получение комплексных соединений.
- •Скорость химической реакции.
- •Факторы, влияющие на скорость химической реакции.
- •Скорость гетерогенных реакций.
- •Степень окисления.
- •Основные понятия о-в реакций
- •Классификация окислительно-восстановительных реакций.
- •Составление уравнений реакций окисления-восстановления.
- •Правила стяжения.
- •Направление протекания окислительно-восстановительных реакций.
Факторы, влияющие на скорость химической реакции.
Скорость химической реакций зависит от природы реагирующих веществ и условий протекания реакции: концентрации, температуры, присутствия катализатора, давления, а также от степени измельчения веществ, облучения, среды, в которой протекает реакция и т.д. Рассмотрим зависимость скорости реакции от некоторых важнейших факторов.
Зависимость скорости реакции от концентрации реагирующих веществ.
Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действия масс, сформулированным в 1867 году норвежскими учеными Гульбергом и Вааге:
Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ.
Закон действия масса может быть выражен кинетическим уравнением,
Тай, для реакции
![]()
кинетическое уравнение имеет вид:

где – скорость реакции;
К – коэффициент пропорциональности;
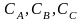 – концентрация
веществ А, В, С;
– концентрация
веществ А, В, С;
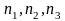 – показатель
степеней, в которые
необходимо возвести
концентрации веществ.
– показатель
степеней, в которые
необходимо возвести
концентрации веществ.
В кинетическом уравнении вместо концентраций реагирующих веществ можно использовать величины, от них зависящие. Так, если в реакции участвует газообразное вещество, то вместо концентрации газообразного вещества ставится его парциальное давление. Например, вещество А из трех реагирующих веществ А, В, С является газом, тогда кинетическое уравнение может быть записано

Коэффициент пропорциональности ( К ) называют константой скорости.
Если концентрации каждого из реагирующих веществ равны единице

то
![]()
т.е. константа скорости химической реакции численно равна скорости реакции при концентрации каждого из реагирующих веществ равной единице.
Константа скорости зависит от природы реагирующих веществ и температуры и не зависит от концентрации реагирующих веществ.
Показатели
степеней (
), в
которые возводятся концентрации
веществ, называются частными
порядками реакции
по соответствующему веществу. Например,
по веществу А указанная реакция
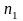 порядка,
а по веществу В реакция
порядка,
а по веществу В реакция
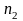 порядка, к т.д. Сумму частных порядков
(
порядка, к т.д. Сумму частных порядков
(
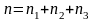 ) называют
общим порядком
реакции.
) называют
общим порядком
реакции.
Порядки реакций определяют экспериментально при изучении механизма реакций путем исследования зависимости скорости реакции от концентрации каждого из реагирующих веществ.
Под механизмом реакции понимают совокупность элементарных стадий (реакционных актов), которые имеют место в ходе протекания реакции. Совокупность элементарных стадий представляет собой цепь превращений, в результате которых из исходных веществ образуются продукты реакции.
В элементарной стадии могут принимать участие различные реакционные частицы: молекулы, атомы, ионы, свободные радикала и др. В ходе элементарной стадии реакционные частицы одного вида превращаются в другие.
Число реакционных частиц одновременно взаимодействующих в одной элементарной стадии, называют молекулярностью стадии. Если участвует одна частица, то такую стадию называют мономолекулярной, две – бимолекулярной, три – тримолекулярной. Стадии с более высокой молекулярностью практически не существуют.
Если реакция протекает в одну стадию, то общий порядок реакции определяется её молекулярностью, а частичные порядки равны стехиометрическим коэффициентам. Так, бимолекулярная реакция

является реакцией первого порядка по водороду и первого порядка по йоду, а общий порядок равен двум. Кинетическое уравнение в этой реакции имеет вид

Если реакция протекает в несколько стадий, то закон действия масс применим к каждой стадии в отдельности и не применим к реакции в целом. Общий порядок такой реакции определяется молекулярностью самой медленной стадий. Например, реакция разложения оксида азота (V) протекает в две стадии;

Скорость реакции определяется первой медленной стадией, и порядок реакции равен её молекулярности. Поэтому реакция в целом является реакцией первого порядка, а кинетическое уравнение может быть записано
![]()
Реакция взаимодействия йодоводородной кислоты с перекисью водорода
![]()
также протекает в две стадии:

Скорость
определяется первой стадией, т.е. эта
реакция является
реакцией первого
порядка no
HJ
и первого порядка
по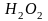 .
В целом реакция второго порядка и
кинетическое уравнение имеет вид
.
В целом реакция второго порядка и
кинетическое уравнение имеет вид

