
- •Конспект лекций по общей и неорганической химии Строение атома и периодическая система д.И. Менделеева
- •Лекция : Комплексные соединения Состав комплексных соединений.
- •Номенклатура комплексных соединений.
- •Химическая связь в комплексных соединениях.
- •Равновесие в системах, содержащих комплексные соединения. Устойчивость комплексных соединений.
- •Основные типы комплексных соединений.
- •Получение комплексных соединений.
- •Скорость химической реакции.
- •Факторы, влияющие на скорость химической реакции.
- •Скорость гетерогенных реакций.
- •Степень окисления.
- •Основные понятия о-в реакций
- •Классификация окислительно-восстановительных реакций.
- •Составление уравнений реакций окисления-восстановления.
- •Правила стяжения.
- •Направление протекания окислительно-восстановительных реакций.
Номенклатура комплексных соединений.
Названия комплексных соединений составляются из названия аниона, употребляемое в именительном падеже и названия катиона - в родительном падеже. Внутренняя сфера комплекса записывается в следующем порядке: первым пишется символ комплексообразователя, затем символы, составляющие обозначения лигандов, сначала электроотрицательных затем нейтральных. Причем, сначала записываются символы более простых, а затем более сложных лигандов, Называют внутреннюю сферу в обратном порядке.
Первыми
называют нейтральные лиганды, которые
обозначаются определенными терминами,
например:
-
аква,
-
аммин,
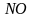 -
нитрозил,
- карбонил,
-
нитрозил,
- карбонил,
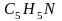 -
пиридин (вместо формулы принято писать
-
пиридин (вместо формулы принято писать
 )
и др. Затем называют отрицательно
заряженные лиганды с добавлением
соединительной гласной “о” например:
-
хлоро- ,
)
и др. Затем называют отрицательно
заряженные лиганды с добавлением
соединительной гласной “о” например:
-
хлоро- ,
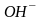 -
гидроксо- ,
-
гидроксо- ,
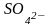 -
сульфато- ,
-
сульфато- ,
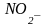 -
нитро- ,
-
нитро- ,
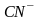 -
циано - и др.
-
циано - и др.
Число лигандов каждого вида обозначается греческими числительными (1 – моно, 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта, 8 – окта и т.д.), которые ставятся перед обозначением соответствующих лигандов.
После названия лигандов называют комплексообразователь.
В комплексном анионе название комплексообразователя составляется из корня латинского названия его с добавлением суффикса “ат”. Перед обозначением комплексообразователя указывается степень его окисления в скобках. Например:

Название комплексообразователя в комплексном катионе составляется из русского названия его в родительном падеже с добавлением после названия степени окисления в скобках.

В нейтральном комплексе название комплексообразователя составляется из русского названия его в именительном падеже без указаний степени окисления.
Например
![]()
Если элемент, выступающий в роли комплексообразователя, имеет постоянную степень окисления, то в названии комплексного соединения степень окисления можно не указывать.
При написании названия комплексного соединения каждый из лигандов и комплексообразователь можно отделять друг от друга черточкой.
ПРИМЕР 8. Назвать следующие комплексные соединения:

Решение:

ПРИМЕР 9. Написать формулы следующих комплексных соединений:
диамин-нитро-трихлоро-платина,
нитрат пентаммин-родано-кобальта (III),
гидроксо-пентахлоро-(IV) рутенат калия,
гексациано-(III) кобальтат гексаммин-кобальта (III).
Решение:

Химическая связь в комплексных соединениях.
Для объяснения образования, строения и свойств комплексных соединений применяют в настоящее время четыре теории: теорию (метод) валентных связей, теорию кристаллического поля, метод молекулярных орбиталей и теорию поля лигандов. Каждая из этих теорий основывается на представлениях квантовой химии.
Метод валентных связей, как и все другие квантовомеханические теории, приближенны. Однако он явился первой квантовомеханической теорией, которая позволила исследовать химические связи и пространственную конфигурацию комплексных соединений. Метод валентных связей основан на предположении, что химическая связь всегда является двухэлектронной связью. Этот метод основывается также на методе о гибридизации орбиталей комплексообразователя. Во время присоединения лигандов происходит гибридизация близких по энергии орбиталей комплексообразователя, в результате чего все гибридный орбитали становятся одинаковыми (в случае одинаковых лигандов) и отличаются только направленностью. Наиболее часто встречающиеся виды гибридизации и конфигурации образующихся комплексов приведены в таблице 2.
Рассмотрим образование комплексных соединений элементами второго периода на примерах комплексных соединений бора и бериллия.
Изобразим в виде энергетических ячеек электронную структуру внешнего энергетического уровня атома бора

В возбужденном состоянии происходит распаривание электронов s-подуровня, и на внешнем энергетическом уровне бора теперь имеется три неспаренных валентных электрона, способных участвовать в образовании ковалентных -связей.
![]()
При
взаимодействии атома бора с тремя
атомами фтора образуется молекула
трифторида бора
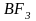 по обменному механизму образования
ковалентной связи
по обменному механизму образования
ковалентной связи

Образовавшаяся молекула имеет свободную орбиталь и может участвовать как акцептор в образовании ковалентной -связи по донорно-акцепторному механизму.

При
образовании иона
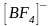 происходит
–
гибридизация орбиталей атома бора.
Четыре гибридные орбитали направлены
в углы тетраэдра, т.е. ион
имеет тетраэдрическое строение (табл.
2).
происходит
–
гибридизация орбиталей атома бора.
Четыре гибридные орбитали направлены
в углы тетраэдра, т.е. ион
имеет тетраэдрическое строение (табл.
2).
При изучении природы химической связи в комплексных соединениях обычно принимают допущение, что все связи между комплексообразователями и лигандами имеют донорно-акцепторный механизм образования. Рассмотрим с этих позиций строение некоторых комплексных соединений.
Образование
тетраэдрического комплексного иона
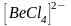 можно объяснить
–
гибридизацией орбиталей иона
можно объяснить
–
гибридизацией орбиталей иона
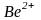
.

Тетраэдрические
комплексы за счет
–
гибридизации образуют и другие элементы
второго периода. Комплексы с координационным
числом более чем четыре элементы второго
периода не образуют, так как не имеют
d-подуровня. У элементов
второго периода в образовании связей
принимают участие только четыре орбитали
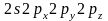 .
.
Тетраэдрические
комплексы с
–
гибридизацией образуют сравнительно
легко элементы третьего периода
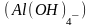 ,
а также металлы подгруппы цинка
,
а также металлы подгруппы цинка
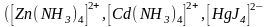 и др.).
и др.).
Элементы
третьего периода, имеющие в отличии от
элементов второго периода свободные
d-орбитали, за счет
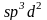 -гибридизации
могут образовывать октаэдрические
комплексы с координационным числом
шесть (табл. 2). Примером могут служить
ионы
-гибридизации
могут образовывать октаэдрические
комплексы с координационным числом
шесть (табл. 2). Примером могут служить
ионы
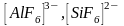 и
и
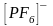 .
Рассмотрим
.
Рассмотрим
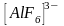

Однако такие соединения образуются весьма редко, так как орбитали 3d резко отличаются по энергии от орбиталей 3s и 3p. Гибридизация, как известно, легко происходит, когда орбитали близки по энергии.
Октаэдрические
комплексы с координационным числом 6
легко образуют переходные металлы 4, 5
и 6-го периодов. Эти элементы имеют
свободные d-орбитали
предвнешнего энергетического уровня,
которые близки со энергия с s-
и p-орбиталями
внешнего энергетического уровня; поэтому
легко осуществляется
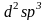 -гибридизация.
В качестве примера рассмотрим образование
октаэдрического комплекса
-гибридизация.
В качестве примера рассмотрим образование
октаэдрического комплекса
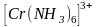


Гибридизация
с увеличением предвнешнего d-орбиталей
возможно даже тогда, когда эти орбитали
заняты неспаренными электронами. При
этом неспаренные электроны спариваются
и в результате освобождается необходимое
количество d-орбиталей.
Это можно проследить на примере
образования комплекса
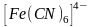
.
ПРИМЕР
10. Определить гибридные орбитали и
пространственную структуру комплексного
иона
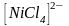 ,
если установлено, что он содержит два
неспаренных электрона.
,
если установлено, что он содержит два
неспаренных электрона.
Решение:
Изобразим
электронно-графическую формулу свободного
иона
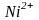 .
.

По
условию задачи комплексный ион
имеет два неспаренных электрона
следовательно структура иона
с двумя неспаренными электронами
сохраняется в комплексном ионе, а в
образовании связей о ионами
участвуют свободные орбитали
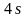 и
и
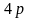 .
.

Пространственная
структура иона
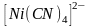 -тетраэдр.
-тетраэдр.
ПРИМЕР 11. определить гибридные орбитали и пространственную структуру комплексного иона , если известно, что в нем нет неспаренных электронов.
Решение:
Изобразим электронно-графическую формулу свободного иона .

В
комплексе нет неспаренных электронов,
следовательно, под действием ионов
электроны
размещаются на четырех 3d
орбиталях, а принимает участие в
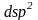 -гибридизации.
-гибридизации.

Пространственная структура иона -квадрат.
