
Теплоэнергетика
Лекция 5 Реальные газы. Водяной пар. Влажный воздух
1 Термодинамика водяного пара
Водяной пар — наиболее широко распространенное в различных областях техники рабочее тело и наиболее часто используемый теплоноситель. В металлургии водяной пар применяют в системах испарительного охлаждения металлургических печей, в котлах-утилизаторах, на заводских ТЭЦ. Его широко используют для обогрева мазутопроводов, для распыливания мазута, применяют водяной пар и для технологических целей — для создания защитных атмосфер, продувки (в смеси с другими газами) расплавленного металла. Наконец, водяной пар является основным рабочим телом, используемым в большой энергетике — на тепловых и атомных электростанциях.
Столь широкое применение водяного пара объясняется, во-первых, практически неисчерпаемыми запасами воды на Земле, и, во-вторых, физико-химическими свойствами – малой агрессивностью и сравнительно низкой температурой насыщения (кипения).
Водяной пар используется в промышленности в таких условиях, которые не слишком далеки от условий насыщения, а потому его поведение не может описываться законами, справедливыми для идеального газа. В частности, уравнение состояния идеального газа (1.3) неприменимо для расчетов состояния водяного пара. Несколько лучшие результаты дает уравнение Ван-дер-Ваальса, однако и оно пригодно лишь для оценочных расчетов. В связи с этим для практических расчетов состояний воды и водяного пара используют таблицы, построенные по экспериментальным данным.
В промышленности водяной пар получают в паровых котлах и системах испарительного охлаждения печей при практически постоянном давлении. Поэтому и в дальнейшем будем рассматривать лишь изобарные процессы при нагреве воды до температуры насыщения, кипении при этой температуре и перегреве полученного пара.
Вначале рассмотрим эти процессы, пользуясь диаграммой р – υ (рис. 3.7). Пусть в исходном состоянии (точка а) имеем воду при температуре 0°С и при некотором давлении р1. Сообщая воде (1 кг воды или пара) определенное количество теплоты, доведем ее до кипения (точка b). При этом температура воды равна температуре насыщения (кипения) Тs, а удельный объем υ' > υа, поскольку при повышении температуры происходит расширение жидкости. Итак, в точке b рассматриваемая система представляет собой воду при температуре насыщения. Дальнейший подвод теплоты не приводит к повышению температуры, а лишь к увеличению количества пара и, следовательно, к росту удельного объема. Отрезок bc, таким образом, представляет собой не только изобару, но одновременно и изотерму.
Между точками b и с, т. е. в любой точке п, система представляет собой смесь кипящей воды с насыщенным паром и называется влажным насыщенным паром. Наконец, в точке с вся вода превращена в пар с удельным объемом υ", находящийся при температуре насыщения и называемый сухим насыщенным паром. Дальнейший подвод теплоты приводит к тому, что температура пара оказывается выше температуры насыщения, и удельный объем также увеличивается. Такой пар (точка d) называется перегретым.

3.7. Процессы парообразования на диаграмме р – υ
В качестве характеристики состава влажного пара используется величина, представляющая массовую долю сухого насыщенного пара в этой смеси, называемая степенью сухости и обозначаемая х.
Поскольку увеличение удельного объема влажного насыщенного пара от υ' (точка b) до υ" (точка с) обусловлено только повышением содержания сухого пара в смеси, т. е. только увеличением степени сухости, и так как в точке b значение х = 0, а в точке с значение x = 1, понятно, что точка п, соответствующая состоянию влажного насыщенного пара, делит отрезок bc в пропорции, соответствующей степени сухости, т.е. х=bn/bc. Заметим, что площадь, расположенная между отрезком bc и осью абсцисс, соответствует работе расширения от объема υ' до объема υ".
Если процессы нагрева воды, парообразования и перегрева происходят при давлении р2 > p1, то абсцисса точки а, т.е. удельный объем холодной воды, не изменится, так как вода практически несжимаема. Однако температура насыщения с увеличением давления возрастает. Поэтому точка b´ соответствующая началу кипения при этом давлении, сдвинется вправо по отношению к точке b, поскольку с ростом температуры увеличивается и удельный объем воды. Что касается точки с', соответствующей состоянию сухого насыщенного пара при давлении p2, то она по отношению к точке с сдвинется влево, так как с увеличением давления удельный объем сухого насыщенного пара уменьшается.
Дальнейшее увеличение давления приведет, естественно, к дальнейшему сближению точек b и с, которые в конце концов, при некотором давлении, называемом критическим, сольются в одну точку, которая называется критической. В этой точке свойства воды и насыщенного пара неразличимы; в ней происходит мгновенный переход от воды к перегретому пару.
На диаграмме, представленной на рис. 3.7, штриховой линией показана изотерма критической температуры. При температурах, превышающих критическую, т. е. в области, расположенной правее и выше этой кривой, ни при каких, как угодно больших давлениях, пар не может быть переведен в жидкое состояние. Для воды критическое давление равно 22,1 МПа, критическая температура 374,12 °С.
Соединяя все точки b, получим кривую Kb, представляющую собой геометрическое место точек, соответствующих началу кипения, и называемую нижней пограничной кривой. Точно так же, соединяя все точки с получим кривую Kc, геометрическое место точек, соответствующих состоянию сухого насыщенного пара, которая называется верхней пограничной кривой.
Область I диаграммы, расположенная слева от нижней пограничной кривой, соответствует воде в жидком (или твердом) состоянии, область II между пограничными кривыми — влажному насыщенному пару, область III справа от верхней пограничной кривой — перегретому пару.
На пограничных кривых состояние системы однозначно определяется одним параметром, например, давлением или температурой. В других областях диаграммы для однозначного определения состояния системы необходимо задать два параметра состояния.
На диаграмме Т– s представлено графическое изображение рассмотренных процессов парообразования (рис. 3.8). Точка а, соответствующая воде при температуре 0°С, расположена на оси ординат, так как энтропия воды при этой температуре принята равной нулю. При подводе теплоты температура воды возрастает вплоть до температуры насыщения Тs в точке b. Дальнейший подвод теплоты, т.е. повышение энтропии, не изменяет температуру Тs и состояние системы изменяется вдоль отрезка прямой bc до точки с, в которой система представляет собой сухой насыщенный пар. Продолжая подвод теплоты, получим перегретый пар (точка d) с температурой, превышающей Тs.
Площадь, расположенная между отрезком bc и осью абсцисс, соответствует теплоте, которая необходима для полного превращения 1 кг воды в сухой насыщенный пар при температуре насыщения, т. е. скрытой теплоте парообразования r (Дж/кг). Эта теплота затрачивается на совершение работы расширения, изображенной на диаграмме р – υ (рис. 3.7), и на разрыв межмолекулярных связей, существующих в жидкости.
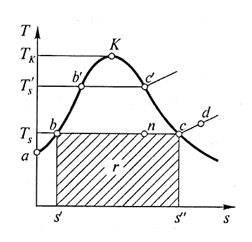
Рис. 3.8. Процессы парообразования на диаграмме Т – s
На диаграмме Т – s, так же как и на диаграмме р – υ, точка п, соответствующая любому состоянию влажного насыщенного пара, делит отрезок bc в пропорции, соответствующей степени сухости пара или его влажности.
Если процессы парообразования проводятся при давлении р2>p1, то температура насыщения повысится. Соответственно увеличится и энтропия кипящей воды s', так как для нагрева воды до большей температуры необходимо большее количество теплоты. Следовательно, точка b' сдвинется вправо по отношению к точке b. С другой стороны, скрытая теплота парообразования при повышении давления уменьшается, поскольку уменьшается работа расширения, как мы это видели, рассматривая диаграмму р – υ, а кроме того уменьшается и энергия, необходимая для разрыва межмолекулярных связей, так как возрастает запас внутренней энергии воды, нагретой до более высокой температуры насыщения. Следовательно, точка с' переместится влево по отношению к точке с.
Понятно, что дальнейшее повышение давления, при котором проводятся процессы парообразования, приведет к дальнейшему сближению точек b и с. В конце концов, при критических давлении и температуре эти точки сольются в одну критическую точку K.
Таким образом, и на диаграмме Т – s мы получим смыкающиеся в критической точке нижнюю Kb и верхнюю Kc пограничные кривые и те же области, что и на диаграмме р – υ. Из этой диаграммы видно, что при температуре, превышающей критическую, получить из перегретого пара жидкую воду невозможно.
Из приведенных рассуждений ясно, что каждому характерному состоянию системы (точки b, с, n и d) соответствует определенное количество теплоты, которое должно быть сообщено холодной воде, чтобы привести систему в данное состояние. Понятно, что при этом соответствующим образом будет изменяться и энтропия. В связи с тем что все рассматриваемые процессы являются изобарными, количество теплоты равно изменению энтальпии. А так как энтальпия (а также энтропия) в исходном состоянии, т. е. в точке а, равна нулю, следовательно, искомые количества теплоты будут равняться абсолютным значениям энтальпии в указанных характерных состояниях, а изменения энтропии для этих состояний по сравнению с исходным — ее абсолютным значениям.
Энтальпию кипящей воды в точке b, т. е. ее изменение между точками а и b, равное количеству теплоты, необходимому для нагрева 1 кг воды от 0°С до температуры насыщения Тs, найдем, пользуясь формулой (2.8), Дж/кг:
 , (3.16)
, (3.16)
где
 —
средняя теплоемкость воды.
—
средняя теплоемкость воды.
Для нахождения значения энтропии в этой точке, т. е. ее изменения между состояниями а и b, используем формулу (2.12), Дж/(кг·К):
 . (3.17)
. (3.17)
Энтальпия сухого насыщенного пара (точка с) отличается от ее значения в точке b на величину скрытой теплоты парообразования, т. е.
 . (3.18)
. (3.18)
Изменение энтропии между состояниями b и с, очевидно, равно s" – s' = r/Ts, следовательно, энтропия сухого насыщенного пара
 . (3.19)
. (3.19)
В соответствии с определением скрытой теплоты парообразования количество теплоты, необходимое для получения влажного насыщенного пара со степенью сухости x (точка n) из кипящей воды (точка b), равно rx, поэтому энтальпия влажного насыщенного пара равна
 , (3.20)
, (3.20)
а энтропия
 . (3.21)
. (3.21)
Количество теплоты, необходимое для получения перегретого пара с температурой Td (точка d) из сухого насыщенного пара, имеющего температуру Тs, выражается формулой (2.8). Поэтому энтальпия перегретого пара будет равна
 ,
(3.22)
,
(3.22)
где
 —
средняя изобарная теплоемкость пара.
—
средняя изобарная теплоемкость пара.
Используя для изменения энтропии между состояниями b и d формулу (2.12), получим значение энтропии перегретого пара
 . (3.23)
. (3.23)
При расчетах термодинамических процессов водяного пара наиболее важной задачей является определение количества теплоты, необходимого для получения пара с заданными параметрами. Как было показано выше, эта величина равна соответствующему изменению энтальпии. В связи с этим для исследования и расчетов процессов водяного пара применяют диаграмму h – s, на которой по оси абсцисс откладывают энтропию, а по оси ординат — энтальпию. Однако для практических расчетов этих процессов чаще всего пользуются уже упоминавшимися термодинамическими таблицами воды и водяного пара.
