
- •Занятие 1 Белки. Ферменты. Медицинская энзимология.
- •1.1.Функции белков, строение, классификация и свойства аминокислот.
- •1.2 Фолдинг белков
- •1.3 Локализация ферментов в клетке, органоспецифические и маркерные ферменты.
- •1.4 Регуляция активности ферментов. Роль гормонов, цАмф, активаторов, ингибиторов. Регуляция активности ферментов
- •1.5. Энзимопатии.Определение. Классификация. Степень клинических проявлений энзимопатий.
- •1.6. Энзимодиагностика, принципы и объекты энзимодиагностики.
- •Занятие 2 Биологическое окисление. Биоэнергетика. Митохондриальная медицина.
- •2.1. Субстраты бо. Схема образования субстратов из ув, липидов, белков.
- •2.2 Цтк(цикл Кребса)
- •2.3 Пути утилизации o2 в организме.
- •2.4 Окислительное фосфорилирование.Хемиосмотическая теория сопряжения окислительного фосфорилирования п. Митчелла
- •2.5 Митохондриальные болезни. Классификация. Типы клинические проявления
- •2.6 Михондрии как пусковой механизм апоптоза
- •Занятие 3 Углеводный обмен в норме и при патологии. Гормональная регуляция метаболизма.
- •3.1 Переваривание и всасывание углеводов в жкт в норме и при патологии.
- •3.2. Значение фосфорилирования глюкозы. Пути обмена г-6-ф. Схема углеводного обмена в организме.
- •3.3. Энергетический баланс окисления углеводов
- •3.4. Регуляция уровня глюкозы в крови. Нормо- гипо- и гипергликемии
- •3.5 Основные клинические проявления диабета их связь с нарушением метаболизма
- •3.6. Принципы организации нейро-эндокринной системы
- •Занятие 4 Липидный и белковый обмен в норме и при патологии.
- •4.1 Липопротеиды строение, классификация, хим. Состав, функциональная роль.
- •4.2 Переваривание и всасывание липидов в жкт в норме и при патологии
- •4.3 Механизмы регуляции липидного обмена
- •4.4 Дислипопротеидемия
- •4.5 Энзимопатии цсм, виды и основные клинические проявления.
- •4.6. Патология обмена азотистых оснований и нуклеиновых кислот
- •Занятие 5 Биохимия крови и органов гомеостаза
- •5.1. Белки плазмы крови, их классификация
- •Белковые компоненты плазмы крови
- •Альбумины
- •Функции альбуминов
- •Глобулины
- •Белки-ферменты плазмы крови.
- •5.2.Механизмы регуляции кос
- •5.3. Гемоглобин: строение, свойства, производные, виды
- •5.4. Метаболизм железа.
- •5.5 Нарушение обмена при острой и хронической почечной недостаточности
- •5.6 Печень. Клеточный состав, метаболическая гетерогенность гепатоцитов
- •Занятие 6 Биохимия мышечной ткани и миокарда. Основы радиационной биохимии. Биохимия канцерогенеза.
- •6.1. Ограничение двигательной активности(гипокинезия) Гипокинетический синдром, основы патогенеза
- •Патогенез гкс (1-й этап)
- •Патогенез гкс (2-й этап)
- •Патогенез гкс (вывод)
- •6.2 Особенности метаболизма мышечной ткани
- •6.3.Биохимическое обоснование лечения сердечной недостаточности
- •6.4. Химический канцерогенез
- •6.5. Радиационный канцерогенез
- •6.6.Вирусный канцерогенез. Hpv- вирус папилломы человека, hsv – вирус простого герпеса
Занятие 1 Белки. Ферменты. Медицинская энзимология.
1.1.Функции белков, строение, классификация и свойства аминокислот.
Функции белков
Каталитическая функция. Свыше 2000 ферментов - биологических катализаторов выделено к настоящему времени. Практически все они являются белками. Все химические реакции, лежащие в основе процессов жизнедеятельности, катализируются ферментами.
Сократительная функция. Важным признаком живого является подвижность. В основе ее лежит сократительная функция белков. Это относится не только к мышечным сокращениям, но и изменениям формы клеток, субклеточных частиц.
Структурная функция. Существуют специальные белки, выполняющие структурную функцию, например, главный белок соединительной ткани - коллаген. Структурная функция присуща и белкам, выпоняющим другие функции.
Транспортная функция. Белки обладают исключительными возможностями по специфическому связыванию различных соединений, что позволяет им выполнять транспорт веществ по крови и в пределах клетки.
Защитная функция. Как уже указывалось выше, каждый организм биохимически индивидуален, поэтому в процессе эволюции выработаны механизмы узнавания и связывания "чужих" молекул. Это успешно умеют делать белки (антитела).
Регуляторная функция. Среди молекул-регуляторов важное место занимают и регуляторы белковой природы, например, гормоны гипофиза. Белки участвуют также в регуляции важных констант крови: осмотическое давление, рН и т.д.
Энергетическая функция. Эндогенные (непищевые) белки, точнее, продукты их ферментативного внутриклеточного гидролиза, служат источником энергии только в особых условиях (длительное голодание, интенсивная длительная мышечная работа).
Аминокислоты - главные составные части белков
Физико-химические и биологические свойства белков определяются их аминокислотным составом. Аминокислоты - это аминопроизводные класса карбоновых кислот. Аминокислоты входят не только в состав белков. Многие из них выполняют специальные функции. Поэтому в живых организмах различают аминокислоты протеиногенные (кодируются генетически) и непротеиногенные (не кодируются генетически). Протеиногенных аминокислот 20. 19 из них являются -аминокислотами. Это означает, что аминогруппа у них присоединена к -углеродному атому той карбоновой кислоты, производным которой они являются. Общая формула этих аминокислот выглядит следующим образом:
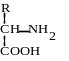
Только одна аминокислота - пролин не соответствует этой общей формуле. Ее относят к иминокислотам.
углеродный атом аминокислот является ассимметричным (исключение составляет аминопроизводное уксусной килоты - глицин). Это означает, что у каждой аминокислоты имеются, как минимум, 2 оптически активных антипода. Природа выбрала для создания белков L-форму. Поэтому природные белки построены из L-- аминокислот.
Классификация аминокислот проводится по строению их радикала. Существуют разные подходы к классификации. Большая часть аминокислот - это алифатические соединения. 2 аминокислоты являются представителями ароматического ряда и 2 - гетероциклического.
Аминокислоты можно разделить, по их свойствам, на основные, нейтральные и кислые. Они отличаются числом амино- и карбоксильных групп в молекуле. Нейтральные - содержат по одной амино- и одной карбоксильной группе (моноаминомонокарбоновые). Кислые имеют 2 карбоксильные и одну аминогруппу (моноаминодикарбоновые), основные -2 аминогруппы и одну карбоксильную (диаминомонокарбоновые).
1. Собственно алифатическими можно назвать 5 аминокислот. Глицин явл. единственной оптически неактивной аминокислотой. Глицин используется не только для синтеза белков. Его атомы входят в состав нуклеотидов, гема, он входит в состав важного трипептида - глутатиона.
Аланин (Ала), при работе с компьютером - (А) - -аминопропионовая кислота. Аланин нередко используется в организме для синтеза глюкозы.
По структуре все аминокислоты, за исключением глицина, можно рассматривать как производные аланина, у которого один или несколько атомов водорода в составе радикала замещены различными функциональными группами.
Валин (Вал), при работе с компьютером (V) - аминоизовалериановая кислота. Лейцин (Лей, L) - аминоизокапроновая кислота. Изолейцин (Иле, I) - -амино--этил--метилпропионовая кислота. Эти три аминокислоты, обладая выраженными гидрофобными свойствами, играют важную роль в формировании пространственной структуры белковой молекулы.
2. Гидроксиаминокислоты. Серин (Сер, S) - -амино--гидроксипропионовая кислота и треонин (Тре, T) - -амино--гидроксимасляная кислота играют важную роль в процессах ковалентной модификации структуры белков. Их гидроксильная группа легко взаимодействует с фосфорной кислотой, что бывает необходимым для изменения функциональной активности белков.
3. Серусодержащие аминокислоты. Цистеин (Цис, C) --амино--тиопропионовая кислота. Специальным свойством цистеина является способность к окислению (в присутствии кислорода) и взаимодействию с другой молекулой цистеина с образованием дисульфидной связи и нового соединения - цистина. Эта аминокислота благодаря активной -SH группе легко вступает в окислительно-восстановительные реакции, защищая клетку от действия окислителей, участвует в образовании дисульфидных мостиков, стабилизирующих структуру белков, входит в состав активного центра ферментов.
Метионин (Мет, M) --амино-тиометилмасляная кислота. Выполняет функцию донора подвижной метильной группы, необходимой для синтеза биологически активных соединений: холина, нуклеотидов и т.д. Это гидрофобная аминокислота.
4. Дикарбоновые аминокислоты. Глутаминовая (Глу, E) - -аминоглутаровая кислота и аспарагиновая кислота (Асп, D) --аминоянтарная кислота. Это наиболее распространенные аминокислоты белков животных организмов. Обладая дополнительной карбоксильной группой в радикале, эти аминокислоты способствуют ионному взаимодействию, придают заряд белковой молекуле. Эти аминокислоты могут образовывать амиды.
5. Амиды дикарбоновых аминокислот. Глутамин (Глн, Q) и аспарагин (Асн, N). Эти аминокислоты выполняют важную функцию в обезвреживании и транспорте аммиака в организме. Амидная связь в их составе частично имеет характер двойной. За счет этого амидная группа обладает частичным положительным зарядом и не будет диссоциировать.
6. Циклические аминокислоты имеют в своем радикале ароматическое или гетероциклическое ядро. Фенилаланин (Фен, F) - -амино--фенилпропионовая кислота. Тирозин (Тир, Y) - -амино--параоксифе-нилпропионовая кислота. Эти 2 аминокислоты образуют взаимосвязанную пару, выполняющую важные функции в организме, среди которых следует отметить использование их клетками для синтеза ряда биологически активных веществ (адреналина, тироксина).
Триптофан (Три, W) -амино--индолилпропионовая кислота. Используется для синтеза витамина PP, серотонина, гормонов эпифиза.
Гистидин (Гис, H) - -амино--имидазолилпропионовая кислота. Может использоваться при образовании гистамина, регулирующего проницаемость тканей и проявляющего свое действие при аллергии.
7. Диаминомонокарбоновые аминокислоты. Лизин (Лиз, K) - диаминокапроновая кислота. Аргинин (Арг, R) --амино--гуанидин-валериановая кислота. Эти аминокислоты имеют дополнительную аминогруппу, которая придает основные свойства белкам, содержащим много таких аминокислот. Образование аргинина является частью метаболического пути обезвреживания аммиака (синтез мочевины).
8. Иминокислота - пролин (Про, P). Отличается от других аминокислот по строению. Её радикал образует с -аминогруппой единую циклическую структуру. Благодаря этой особенности вокруг связи между -аминогруппой и -углеродным атомом невозможно никакое вращение. У всех других аминокислот возможность вращения вокруг этой связи имеется. Вдобавок в состав пролина входит вторичная аминогруппа (с азотом азота связан только один атом водорода), которая отличается, по своим химическим характеристикам от первичной аминогруппы (-NH2) в составе других аминокислот. Особое место отводится этой аминокислоте в структуре коллагена, где пролин, в процессе синтеза коллагена, может превращаться в гидроксипролин.
В скобках указаны сокращенные обозначения аминокислот, которые образуются из первых трех букв их тривиального названия. В последнее время для записи первичной структуры используются и однобуквенные символы, что важно при использовании ЭВМ в работе с белками.
Химические и физико-химические свойства аминокислот обусловлены тем, что они имеют радикал и 2 функциональные группы с противоположными свойствами: кислую карбоксильную и основную аминогруппу. Поэтому в водном растворе аминокислоты существуют в виде равновесной смеси биполярного иона, катионной и анионной форм молекулы. Равновесие зависит от pH среды.
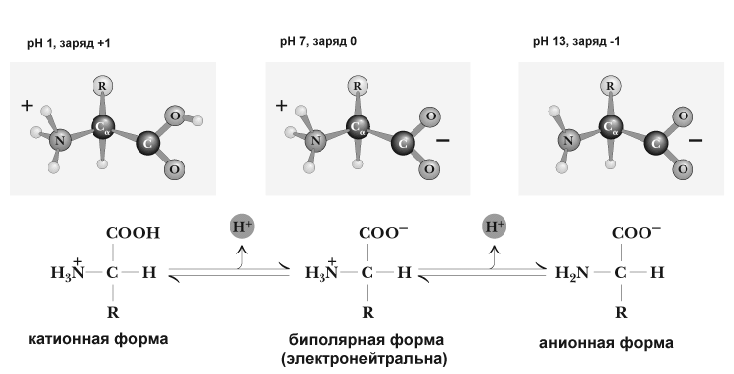
Нейтральные аминокислоты в воде не имеют заряда. Иначе ведут себя дикарбоновые аминокислоты. Обе их карбоксильные группы диссоциируют, отдавая 2 протона, но поскольку у них только одна аминогруппа, принимающая один протон, то такие аминокислоты ведут себя как кислоты, и раствор их имеет кислую реакцию. Возникающий при этой диссоциации ион имеет избыток отрицательного заряда.
Основные аминокислоты реагируют в водном растворе как слабые основания. Это связано с тем, что один протон, который освобождается при диссоциации карбоксильной группы таких аминокислот, связывается с одной из аминогрупп, а вторая аминогруппа связывает протон из водного окружения, увеличивая тем самым количество OH групп и повышая pH. Заряд иона таких аминокислот будет положительным.
