
- •1.Актуальність теми і мети курсової роботи.
- •2.Загальна характеристика напівсинтетичних цефалоспоринів,як проти-
- •3.Особливості хімічної структури молекул,номенклатура,методи одержання,інактивація цефалоспоринів.
- •4.Цефалоспорини I I II поколінь.Їх властивості,аналіз за аналітико-функціональними групами в молекулах,застосування у медицині,побічні дії.
- •Побічні ефекти
- •6.Порівняльна характеристика протимікробної активності антибіотиків різних поколінь цефалоспоринів.
План
1.Актуальність теми і мети курсової роботи.
2.Загальна характеристика напівсинтетичних цефалоспоринів,як проти-
мікробних засобів.Історія їх відкриття і розвитку.
3.Особливості хімічної структури молекул,номенклатура,методи одержання,інактивація цефалоспоринів.
4.Цефалоспорини I i II поколінь.Їх властивості,аналіз за аналітико-функціональними групами в молекулах,застосування у медицині,побічні дії.
5.Цефалоспоринові антибіотики Ш і IV поколінь.Їх властивості,аналіз за аналітико-функціональними групами в молекулах,застосування у меди-
цині,побічні дії.
6.Порівняльна характеристика протимікробної активності антибіотиків різних поколінь цефалоспоринів.
7.Висновки.
1.Актуальність теми і мети курсової роботи.
Антибіотики широко застосовуються в медицині для лікування та профілактики інфекції. Ефективність їх безперечна. Призначення антибіотиків хворим з гострою та хронічною інфекцією в більшості випадків є конче потрібним заходом.
Ліки з цієї групи широко використовуються для лікування різних інфекційних хвороб, які загрожують з раннього дитячого віку. Тому про антибіотики знають майже всі і не стільки з книжок, скільки із власного життєвого досвіду.
Вважають, що антибіотики – це універсальні протимікробні засоби, здатні при введенні в організм знищувати мікроорганізми при різних інфекціях,починаючи із звичайної простуди і кінчаючи холерою. Протимікробна дія антибіотиків пояснюється тим, що вони впливають на ріст і розмноження мікроорганізмів (пригнічують). Частина антибіотиків порушує процес поділу (мікроорганізми
розмножуються поділом), а частина – функцію мікробної клітини.Ефективність їх залежить від характеру інфекції та адекватності вибору режиму лікування.
Антибіотики діють лише на певні види мікроорганізмів тому їх класифікують за спектром дії:
-Вузького спектру дії (бензилпеніциліни, макроліти, поліміксини).
-Широкого спекту дії (цефалоспорини, тетрацикліни, левоміцетини,аміноглікозиди).
Антибіотиків є багато. всі вони розрізняються по спектру дії або по хімічній будові. І звичайно потрібно враховувати їх небезпеку для організму. Найменш токсичними є пеніциліни, а потім цефалоспорини.Цефалоспорини можуть викликати порушення функції нирок, дисбактеріоз, диспепсичні розлади, при в/в можуть виникати тромбофлебіти.
2.Загальна характеристика напівсинтетичних цефалоспоринів,як проти-
мікробних засобів.Історія їх відкриття і розвитку.
Антибактеріальна активність цефалоспоринів , як і інших бета- лактамних антибіотиків , принаймні частково , обумовлена гальмуванням синтезу пептидоглікану - структурної основи мікробної стінки . Пептидоглікани являють собою довгі полісахаридні ланцюги зі своєрідною сітчастою просторовою конформацією , в яких чергуються залишки N- ацетилглюкозаміну ( NAG ) і N- ацетилмурамінової кислоти ( NAM ) . НАГ - і NAM - пентапептидні залишки пептидогліканів синтезуються в цитоплазмі мікробної клітини і транспортуються через цитоплазматичну мембрану. Далі ці залишки вбудовуються в існуючу пептидогліканову мережу ( в процесі росту і поділу клітини ) з участю різних ензимів - транспептидаз , карбоксипептидаз , ендопептидаз . Власне ці ензими , що знаходяться в цитоплазматичній мембрані , є місцем реалізації антибактеріальної активності ( мішенями ) бета- лактамних антибіотиків , у тому числі цефалоспоринів ; вони отримали назву " пеніцилін зв'язуючі білки " (пеніцилін -зв'язуючі білки - РВР ) . В результаті утворення " тривалого " ковалентного зв'язку бета- лактами та РВР останні інактивуються . При цьому ефект призначуваного бета- лактаму залежить від того, які РВР інактивуються і яку роль вони відіграють у синтезі пептидоглікану і виживання мікробної клітини. Важливо також підкреслити , що бактерицидний ефект цефалоспоринів реалізується тільки в процесі росту і розмноження мікроорганізмів , тоді як " покояться " клітини невразливі для дії антибіотиків .
Механізми формування резистентності до цефалоспоринів
Стійкість мікроорганізмів до дії цефалоспоринів може бути пов'язана з одним із наступних механізмів : а) з видозміною (модифікація) РВР зі зниженням афінності (спорідненості ) до них цефалоспоринів ; б)з гідролізною інактивацією антибіотика (
бета- лактамазами ) ; в) з порушенням проникності зовнішніх структур мікробної клітини для антибіотика і утрудненням його зв'язування з "мішенню" - РВР .
У грампозитивних мікроорганізмів цитоплазматична мембрана порізно і безпосередньо прилягає до пептидоглікану матриксу , у зв'язку з чим цефалоспорини досить легко досягають РВР . На противагу цьому , зовнішня мембрана грамнегативних
мікроорганізмів має істотно більш складну " конструкцію " : складається з ліпідів ,
полісахаридів і білків , що є перешкодою для проникнення цефалоспоринів в пери плазму мікробної клітини ( рис. 3 ) . Цефалоспорини "проходять " крізь зовнішню мембрану мікробної клітини через так звані поринові канали. У зв'язку з цим , очевидно , зменшення проникності порінових каналів може призвести до формування антибіотикорезистентності .
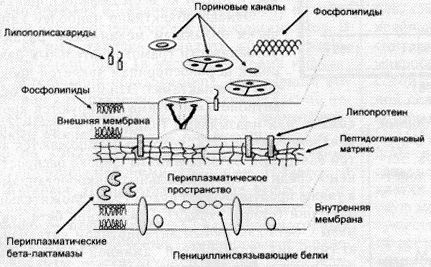
Рис.3. Схема будови бактеріальної стінки грамнегативних мікроорганізмів
(За P.A.James, 1996)
Зниження спорідненості РВР до бета- лактамних антибіотиків розглядають як провідний механізм формування резистентності Neisseria гонорея і пневмокок до пеніциліну. Метицилінрезистентні штами золотистого стафілокока (MRSA ) продукують РВР2 ( РВР2а ), які характеризуються значним зниженням афінності до пеніцилінорезистентних пеніцилінів і цефалоспоринів . Здатність цих "нових" РВР2а до заміщення есенціальних РВР (з більш високою спорідненістю до бета-лактамів ) зрештою , призводить до формування стійкості MRSA до всіх цефалоспоринів .
Однак об'єктивно найбільш клінічно значущим механізмом розвитку стійкості грамнегативних бактерій до цефалоспоринів є продукція бета- лактамаз. Ці інактивуючі антибіотики ензими кодуються хромосомами або плазмідами ( плазміди - фрагменти позахромосомних ДНК , які розмножуються всередині бактерій) . Бета- лактамази широко поширені серед грамнегативних мікроорганізмів , а також продукуються поруч грампозитивних бактерій ( стафілококи) . Зв'язування бета- лактамази з бета- лактамним антибіотиком каталізує гідроліз " критичного" амінного зв'язку лактамного кільця , що й призводить до інактивації антибіотика.
Грампозитивні мікроорганізми вивільняють бета- лактамази безпосередньо в навколишній їх позаклітинний простір. При цьому відомо , що більшість цефалоспоринів ( за винятком, мабуть , цефалоридина ) досить стійкі до гідролізу дії стафілококової бета- лактамази. У зв'язку з цим антистафілококова активність цефалоспоринів залежить головним чином від їх спорідненості до есенціальних стафилококкових РВР . Так , наприклад , цефаміцини і цефтазидим , будучи досить бета- лактамазостабільними , демонструють низьку антистафілококову активність внаслідок низької спорідненості до РВР S.aureus .
Бета- лактамазна резистентність грамнегативних бактерій до цефалоспоринів має складніший характер. У цих мікроорганізмів бета- лактамази " укладені" в периплазму . Важливо підкреслити , що підвищення продукції бета- лактамаз або новоутворення ензимів з підвищеною спорідненістю до антибіотика є основною причиною поширення цефалоспоринрезистентних штамів серед грамнегативних мікроорганізмів. При цьому високий рівень продукції TEM - я або SHV - I * ( Найчастіше в назвах бета- лактамаз враховуються основні субстрати - антибіотики , прізвища дослідників чи пацієнтів. Так , наприклад , термін " ТИМ " стали використовувати для позначення плазмідних ензимів , спочатку виділених з мікроорганізмів у хворого Temorina , SHV - англомовна абревіатура терміну " сульфгідрильна варіабельність " ), двох найбільш часто зустрічаються плазмідосоційованих бета- лактамаз бактерій родини ентеробактерій (кишкова паличка , сальмонела , шигели SPP , Klebsiella SPP , Enterobacter SPP та ін . ) , асоціюється з формуванням резистентності не тільки до пеніцилінів - інгібіторів бета- лактамаз , але і до цефалотину , цефамандолу , цефоперазону.
Окремі представники сімейства ентеробактерій ( Enterobacter SPP . , Citrobacter freundii , Morganella morganii , Serratia marcescens , Провиденсия SPP . ) , А також синьогнійної палички демонструють здатність до продукції " індуцібельних " хромосомних цефалоспориназ , що характеризуються високою спорідненістю до цефаміціни і цефалоспоринів 3-го покоління. Індукція або стабільне "дерепресування" цих хромосомних бета-лактамаз в період "тиску" (застосування) цефаміцинів або цефалоспоринів 3-го покоління в підсумку призведе до формування резистентності до всіх доступних цефалоспоринів. Поширення даної форми резистентності збільшується у випадках лікування інфекцій, насамперед викликаються Enterobacter cloaceae і синьогнійна паличка, цефалоспоринами широкого спектру дії.
Останнім часом були відкриті і так звані бета-лактамази розширеного спектру дії, які кодуються плазмідами (розширеного спектру бета-лактамази - БЛРС). ESBL походять з ТИМ-1, ТЕМ-2 або SHV-1 внаслідок точкової мутації в активному центрі ензимів і продукуються переважно Klebsiella пневмонії. Продукція ESBL асоціюється з високим рівнем резистентності до азтреонаму і цефалоспоринів 3-го покоління - цефтазідіму та ін.
Створення та впровадження в клінічну практику антибіотиків класу цефалоспоринів стало , безумовно , одним з найважливіших подією в історії хіміотерапії бактеріальних інфекції. В даний час , очевидно , що по ряду найважливіших параметрів: спектру антибактеріальної дії , фармакокінетики , безпеки та ін , цефалоспорини перевершують антибіотики багатьох інших класів , чим і пояснюється їх статус антибактеріальних засобів , найбільш широко застосовуються в багатьох країнах світу .
Історія відкриття. Уперше цефалоспорини (далі ЦС) були відкриті Джузеппе Бротзу (D. Brotzu) в середині минулого сторіччя. Цефалоспорини були вперше виділені з культур Cephalosporium acremonium в 1948 році італійським вченим Джузеппе Бротзу, [2] який помітив, що культури продукували речовини, ефективно знищували Salmonella typhi, збудника тифу, яка мала активний фермент бета-лактамазу. Дослідники з університету Оксфорда виділили цефалоспорин C. Перший антибіотик з групи цефалоспоринів - цефалотин був отриманий Елі Ліллі в 1964 році.
В хімічно чистому вигляді виділені з гриба Cephalosporіum aeromonіum, звідки й пішла родова назва даної групи препаратів. Перший представник цього класу антибіотиків власне і мав назву цефалоспорин С.
Народження цефалоспоринів справедливо пов'язують з роботами G.Brotzu , який припустив на початку 40 -х років , що періодичне самоочищення стічних вод в Сардинії обумовлено інгібуючою активністю особливих мікроорганізмів. У 1945 р. йому вдалося виділити гриб Cephalosporium Acremonium (нині іменований Acremonium сьгузо ) , що володів вираженою антибактеріальною активністю по відношенню до грампозитивних і грамнегативних мікроорганізмів . Наступним етапом (з 1955 по 1962 р.) Прийшло детальне вивчення С.acremonium робочими групами H.Florey і EPAbraham . З продуктів обміну речовин цього гриба вдалося виділити бактерицидну субстанцію - цефалоспорин С, що стала вихідною речовиною для отримання 7 - аміноцефалоспоранової кислоти - структурної основи цефалоспоринів .
У 1962 р. в клінічну практику був введений перший антибіотик класу цефалоспоринів - цефалоридин , проте широке клінічне застосування цефалоспоринів почалося тільки в кінці 70 -х років. В даний час налічується більше 50 цефалоспоринів (рис. 1 ) , тому немає нічого дивного в тому , що лікар відчуває чималі труднощі при виборі потрібного препарату відповідно до показань .
механізм дії
Цефалоспорини проявляють бактерицидну дію. Механізм цієї дії пов'язаний з пошкодженням клітинної мембрани бактерій (придушення синтезу пептидогліканового шару), що знаходяться в стадії розмноження, і вивільненням аутолітичних ферментів, що призводить до їх загибелі.

Рис.1. "Дерево" цефалоспоринів (по Periti, 1996)
