
- •1.Еквівалент. Закон еквівалентів
- •2.Використання стахіометричних законів для розрахунків.
- •1.Закономірності зміни властивостей елементів у періодичній системі.
- •2.Загальнонаукове та філософське значеня періодичного закону.
- •1.Утворення двохатомних гомоядерних молекул елементів другого періоду за методом ммо
- •2.Водневий зв'язок. Природа й енергія водневого зв’язку.
- •3.Міжчасткові взаємодії. Вандерваальсова взаємодія молекул.
- •1.Структура комплексних сполук
- •2.Комплексоутворюючі і ліганди
- •3.Номенклатура і класифікація комплексних сполук
- •4.Ізомерія комплексних сполук
- •4.1. Изомерия лигандов
- •4.2. Геометрическая изомерия
- •4.3. Оптическая изомерия
- •4.4. Сольватная (гидратная) изомерия
- •4.5. Ионная изомерия
- •5.Дисоціація комплексних сполук
- •1.Агрегатний стан речовини
- •2.Плазма
- •3.Газопоібний стан
- •4.Рідкий стан
- •5.Кристалічний та аморфний стан
- •6.Рідкокристалічний стан
Самостійна робота №1
Вступ
1.Еквівалент. Закон еквівалентів
Закон еквівалентів — маси речовин, які вступають у реакцію та утворюються після неї, пропорційні їхнім еквівалентам.
![]()
Із закону сталості складу випливає, що речовини взаємодіють між собою і утворюють продукти у певних, чітко визначених (еквівалентних) кількостях.
Еквівалент (Е) — еквівалентом елемента називають таку його кількість, яка взаємодіє з 1 м.ч. Н або 8 м.ч. О або заміщує таку кількість хімічних реакцій.
Еквівалент - це частина атому, молекули або йону яка припадає на одну зміної валентності або ступеню окиснення. Наприклад, в сполуках HCl, H2S, NH3, CH4 еквівалент хлора, сірки, нітрогену, вуглеця дорівнює відповідно 1 моль, 1/2 моль, 1/3 моль, 1/4 моль.
Еквівалент речовини – це реальна або умовна частка цієї речовини, яка в кислотно-основній реакції звільняє один гідроген (1+)- іон або сполучається з ним, а в окисно-відновній реакції приєднує або звільняє один електрон.
Еквівалент речовини змінний і залежить від реакції, у якій ця речовина бере участь.
Маса одного еквіваленту називається його еквівалентною масою. Так, в наведених вище прикладах еквівалентні маси хлору, сірки, нітрогену та вуглецю відповідно дорівнюють 34,45 г/моль, 32/2=16 г/моль, 14/3=4,67 г/моль, 12/4=3 г/моль.
Число, яку показує, яка частка реальної частинки речовини X еквівалентна одному гідроген (1+)- іону в даній кислотно-основній реакції, називається фактором еквівалентності речовини X. Фактор еквівалентності — це величина безрозмірна.
2.Використання стахіометричних законів для розрахунків.
Стехіометрія — розділ хімії про співвідношення реагентів в хімічних реакціях.
Дозволяє теоретично обчислювати необхідні маси та об'єми реагентів.
В основі стехіометрії лежать закони збереження маси , еквівалентів , Авогадро , Гей-Люссака , сталості складу , кратних відносин .
Всі закони стехіометрії обумовлені атомно-молекулярною будовою речовини.
Термін " стехіометрія " ввів І. Ріхтер в 1793 році.
Відносини кількостей реагентів , рівні відносинам коефіцієнтів у стехіометричному рівнянні реакції , називаються стехіометричними . Якщо речовини реагують у співвідношенні 1:1 , то їхні відповідні кількості називають еквімолярними.
Речовини, для яких спостерігаються відхилення від законів стехіометрії , звуться нестехіометричними . Відхилення від законів стехіометрії спостерігаються для конденсованих фаз і пов'язані з утворенням твердих розчинів (для кристалічних речовин), з розчиненням в рідині надлишку компонента реакції або термічною дисоціацією з'єднання, що утворюється (в рідкій фазі, в розплаві) . Закони стехіометрії використовують у розрахунках, пов'язаних з формулами речовин і знаходженням теоретично можливого виходу продуктів реакції.
Самостійна робота №2
Періодичний закон і періодична система хімічних елементів
1.Закономірності зміни властивостей елементів у періодичній системі.
Хімічні властивості елементів (а вже тим більше їх сполук!) Безпосередньо залежать від будови атома.
Не треба вчити напам'ять хімічні властивості кожного атома, не треба зазубрювати хімічні реакції ... відповідь на будь-яке питання з хімії знаходиться в періодичною системою елементів.

Зміни властивостей хімічних елементів та їх сполук в групах:
У групах всі елементи мають подібне електронне будова.
Відмінностей в наповненні зовнішнього енергетичного рівня електронами немає.
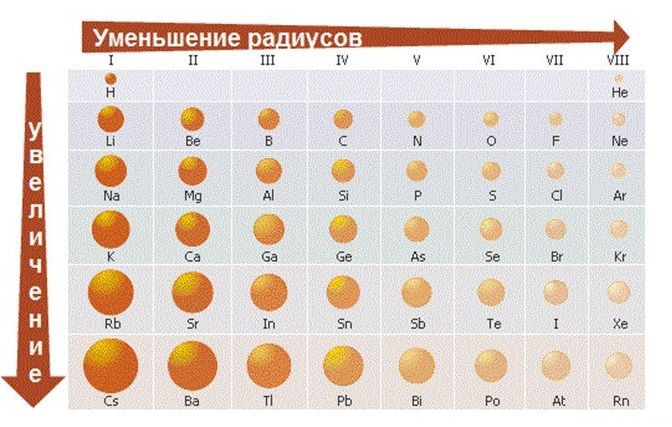
Змінюється розмір атома - зверху вниз в групі радіуси атомів збільшуються!
1) зовнішні електрони все слабше притягуються до ядра атома;
2) зростає здатність атома віддавати електрони.
3) здатність віддавати електрони = металеві властивості, тобто
закономірність зміни хімічних властивостей елементів і їх сполук в групах:
У групах зверху вниз зростають металеві властивості елементів
посилюються основні властивості їх сполук
Зміни хімічних властивостей елементів і їх сполук в періодах:
В періодах спостерігається дещо інша картина:
1) Зліва направо в періодах радіуси атомів зменшуються;
2) кількість електронів на зовнішньому шарі при цьому збільшується;
3) електронегативність елементів = неметалеві властивості збільшується
закономірності зміни хімічних властивостей елементів і їх сполук в періодах:
В періодах зліва направо зростають неметалеві властивості елементів, електронегативність;
посилюються кислотні властивості їх сполук

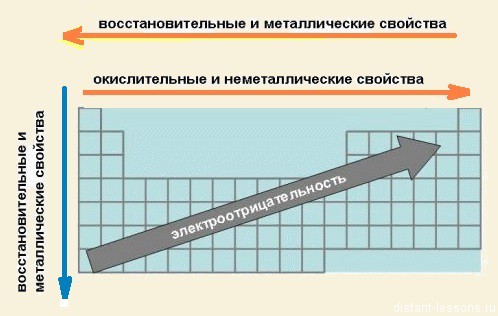
Виходячи з цих міркувань виходить, що звання «Король неметалла» у нас присуджується ... (барабанний дріб) ... F! Поруч з ним навіть кисень (O) проявляє позитивну ступінь окислення: OF2 - безбарвний отруйний газ з неприємним запахом.
Отже, підведемо підсумок:
Із збільшенням заряду ядра атомів спостерігається поступове закономірне зміна властивостей елементів і їх сполук від металевих до типово неметаллическим, що пов'язано зі збільшенням числа електронів на зовнішньому енергетичному рівні.
Є ще елементи, які утворюють так звані амфотарні з'єднання. Вони проявляють як металеві, так і неметалеві властивості.
