
- •Кафедра загальної хімії
- •„Медична хімія”
- •Тема 4 Величини, що характеризують кількісний склад розчинів. Приготування розчинів
- •Тема 5 Кислотно-основна рівновага в організмі. Водневий показник біологічних рідин.
- •Тема 7 Буферні системи, класифікація та механізм дії
- •Тема 8 Визначення буферної ємності. Роль буферів в біосистемах
- •Тема 9 Колігативні властивості розчинів
- •Література до модуля 1
- •Змістовий модуль 2. Кислотно-основні рівноваги в біологічних рідинах
Яка молярна концентрація еквівалента сульфатної кислоти в 25 мл розчину на титрування якого витрачено 15,49 мл розчину калій гідроксиду з молярною концентрацією еквівалента 0,01 моль/л:
|
|
|
|
Тема 7 Буферні системи, класифікація та механізм дії
1. Органи, що беруть участь в регуляції кислотно-основної рівноваги в організмі людини:
а. легені, залози внутрішньої секреції, печінка, мозок, серце, нирки;
б. легені, шкіра, кишково- шлунковий тракт, мозок;
в. печінка, кишково- шлунковий тракт, легені, серце;
г.легені, нирки, кишково-шлунковий тракт, печінка, залози внутрішньої секреції, шкіра.
2. Із наведених пар речовин виберіть компоненти ацетатного буфера:
а. CH3COONH4, CH3COOH; б. CH3COONa, CH3COOH;
в. CH3COOH, (CH3COO)2Mg; г. (CH3COO)2Zn, CH3COOH.
3. Із наведених пар речовин виберіть компоненти гідрогенкарбонатного буфера:
а. Na2CO3, NaHCO3; б. Na2CO3, NaOH;
в. NaHCO3, CO2∙H2O; г. H2CO3, Na2CO3.
4. Із наведених пар речовин виберіть компоненти фосфатного буфера:
а. NaH2PO4, Na3PO4; б. Na2HPO4, NaH2PO4;
в. Na2HPO4, Na3PO4; г. Na3PO4, NaOH.
5. Із наведених пар речовин виберіть компоненти аміачного буфера:
а. NH3∙H2O, NH4NO2; б. NH4NO3, NH4Cl;
в. NH3∙H2O, NH4Cl; г. NH4OH, (NH4)2CO3.
6. . Із наведених пар речовин виберіть компоненти гемоглобінового буфера:
а. HHb, KHb; б. HHb, Mg(Hb)2;
в. KHb, NaHbO2; г. KHb, HHbO2.
7. Із наведених пар речовин виберіть компоненти оксигемоглобінового буфера:
а. NaHbO2 , HHb; б. HHbO2 , HHb;
в. HHbO2, KHbO2; г. NaHb, KHbO2.
8. Фізіологічне значення вмісту гідрогенкарбонату в крові людини
с(HCO3-) становить(ммоль/л):
а. 12 – 15; б. 18 – 19; в. 25 – 26; г. 29 – 30.
9. Кислотно-основна рівновага крові людини визначається величинами:
а. рН, с(HCO3-), рСО2; б. рН, с(CO32-), рСО2;
в. рН, рСО2, с(H2РO4-); г. рОН, рСО2, с(HРO42-).
10. Користуючись величинами Кд слабких електролітів, виберіть оптимальний буфер для проведення дослідів при рН 7,40:
а. рКд (СН3СООН) = 4,76; б. рКд1 (СО2∙Н2О) = 6,35;
в. рКд (Н2РО4–) = 7,20; г. рКд (NH3∙H2O) = 4,74.
11.
Співвідношення молярних концентрацій
компонентів гідрогенкарбонатного
буфера
![]()
 в плазмі крові при рН 7,4 має бути :
в плазмі крові при рН 7,4 має бути :
а. 18 : 2; б. 20 : 1; в. 15 : 1; г. 18 : 3.
12.
Співвідношення молярних концентрацій
компонентів фосфатного буфера
![]() в плазмі крові при рН 7,4 має бути:
в плазмі крові при рН 7,4 має бути:
а. 6 : 1; б. 5 : 2; в. 4 : 1; г. 4 : 2.
13. Фосфатний буфер в організмі людини є в:
а. крові, сечі, травних соках; б. крові, сечі, слині;
в. крові, слині, лімфі;
г. крові, соках підшлункової залози та шлунку, мозку.
14. Найбільший вміст у крові людини буфера:
а. аміачного; б. фосфатного;
в. гідрогенкарбонатного; г. гемоглобінового.
15. Буферна дія (буферування) – це здатність буферного розчину стійко зберігати постійне значення:
а. добутку молярних концентрацій компонентів буфера;
б. водневого показника рН;
в. константи дисоціації слабкого електроліту буфера Кд;
г.
іонного добутку води
![]() ;
;
д. константи дисоціації води Кд (Н2О).
16. На скільки одиниць має бути зсунутий рН крові, щоб в організмі розвинувся ацидоз:
а. зменшитися на 0,1; б. збільшитися на 0,7;
в. збільшитися на 0,5; г. зменшитися на 0,3;
д. збільшитися на 1,0 ?
17. Важкі форми цукрового діабету супроводжуються порушенням кислотно-основної рівноваги в організмі і виникненням ацидозу. Яке значення рН крові цьому відповідає:
а. 7,7 – 7,9; б. 7,1 – 7,2; в. 7,35 – 7,65; г. 7,85 – 8,15;
д. 8,65 – 8,85 ?
18. На скільки одиниць має бути зсунутий рН крові, щоб в організмі розвинувся алкалоз:
а. збільшитися на 1,5; б. зменшитися на 2,0;
в. зменшитися на 0,5; г. збільшитися на 0,3;
д. збільшитися на 1,0?
19. Якого значення набуває рН крові, якщо в організмі розвинувся алкалоз:
а. 8,00; б. 9,55; в. 7,66; г. 8,90; д. 5,56?
20. Головними чинниками, що впливають на величину рН буферного розчину, є:
а. іонний добуток води Кв;
б. добуток молярних концентрацій компонентів буфера;
в. рКд слабкого електроліту та співвідношення молярних концентрацій компонентів буфера, температура;
г. концентрація буферного розчину
21. рН оснốвного буфера дорівнює (формула Гендерсона-Гассельбаха):
а.
![]() ; б.
; б.
![]() ;
;
в.
![]() ; г.
; г.
![]() ;
;
д.
![]() .
.
22. Відомо, що при ішемічній хворобі серця відбувається зміщення кислотно-основної рівноваги в кислу область. На скільки одиниць змінюється при цьому рН крові?
а. збільшується на (0,7 – 1,0) ; б. збільшується на (1,0 – 2,0) ;
в. зменшується на (1,5 – 2,0) ; г. зменшується на (0,2 – 0,3) ;
д. збільшується на (0,4 – 0,5)?
23. Компонентами кислотного буфера є:
а. слабка кислота та сіль цієї кислоти і сильної основи (лугу) ;
б. слабка кислота та сіль сильної кислоти і сильної основи (лугу);
в. слабка кислота та сіль сильної кислоти і слабкої основи;
г. слабка кислота та сіль цієї кислоти і слабкої основи;
д. сильна кислота та сіль цієї кислоти і сильної основи (лугу).
24. Біологічні рідини (кров, лімфу, сечу тощо) можна розбавляти водою для практичних досліджень без зміни рН у разів:
а. 25 – 40; б. 10 – 20; в. 30 – 50; г. 50 – 100; д. 100 – 200.
25. Компонентами основного буфера є:
а. сильна основа (луг) та сіль цієї основи і слабкої кислоти;
б. сильна основа (луг) та сіль цієї основи і сильної кислоти;
в. слабка основа та сіль цієї основи і слабкої кислоти;
г. слабка основа та сіль цієї основи і сильної кислоти;
д. слабка основа та сіль сильної основи (лугу) і сильної кислоти.
26. рН кислотного буфера дорівнює (формула Гендерсона-Гассельбаха):
а.
![]() ; б.
; б.
![]() ;
;
в.
![]() ; г.
; г.
![]() ;
;
д.
![]() .
.
27. Обчислити рН амонійного буфера, що одержали при змішуванні 400 мл розчину NH4Cl з с0(NH4Cl) = 0,15 моль/л і 200 мл розчину аміаку з с0(NH3∙Н2О)=0,1 моль/л. Кд(NH3∙Н2О) = 1,8∙10–5моль/л.
а. 9,18; б. 9,22; в. 9,08; г. 8,56; д. 8,78.
28. Обчислити рН ацетатного буфера, що одержали при змішуванні 50 мл розчину СН3СООNа з с0(СН3СООNа) = 0,1 моль/л і 200 мл розчину СН3СООН з с0(СН3СООН) = 0,05 моль/л. Кд(СН3СООН) = 1,75∙10–5моль/л.
а. 4,46; б. 4,76; в. 5,24; г. 5,74; д. 4,16.
29. Обчислити рН фосфатного буфера, що одержали при змішуванні 150 мл розчину NаН2РО4 з с0(NаН2РО4) = 0,1 моль/л і 200 мл розчину Nа2НРО4 з с0(Nа2НРО4) = 0,05 моль/л. Кд (Н2РО4–) = 6,2∙10–8моль/л.
а. 7,09; б. 7,80; в. 7,34; г. 7,02; д. 7,22.
30. Обчислити рН амонійного буфера, що одержали при змішуванні 250 мл розчину NH4Cl з с0(NH4Cl) = 0,2 моль/л і 500 мл розчину аміаку з с0(NH3∙Н2О) = 0,1 моль/л. Кд(NH3∙Н2О) = 1,8∙10–5моль/л.
а. 9,47; б. 9,26; в. 10,21; г. 10,13; д. 10,28.
31. Обчислити рН ацетатного буфера, що одержали при змішуванні 100 мл розчину СН3СООН з с0(СН3СООН) = 0,1 моль/л і 200 мл розчину СН3СООNа з с0(СН3СООNа) = 0,2 моль/л. Кд (СН3СООН) = 1,75∙10–5моль/л.
а. 4,16; б. 5,26; в. 5,36; г. 5,06; д. 5,66.
32. Обчислити рН фосфатного буфера, що одержали при змішуванні 200 мл розчину Na2НРО4 з с0(Na2НРО4) = 0,1 моль/л і 100 мл розчину NаН2РО4 з с0(NаН2РО4) = 0,1 моль/л. Кд (Н2РО4– ) = 6,2∙10–8моль/л.
а. 6,52; б. 5,48; в. 7,50; г. 5,88; д. 6,75.
33. Обчислити рН амонійного буфера, що одержали при змішуванні 500 мл розчину аміаку з с0(NH3∙Н2О) = 0,1 моль/л і 100 мл розчину NH4Cl з с0(NH4Cl) = 0,2 моль/л. Кд(NH3∙Н2О) = 1,8∙10–5моль/л.
а. 10,49; б. 10,24; в. 9,78; г. 9,66; д. 9,83.
34. Обчислити рН ацетатного буфера, що одержали при змішуванні 200 мл розчину СН3СООН з с0(СН3СООН) = 0,1 моль/л і 200 мл розчину СН3СООNа з с0(СН3СООNа) = 0,2 моль/л. Кд (СН3СООН) = 1,75∙10–5моль/л.
а. 4,76; б. 4,46; в. 5,06; г. 5,36; д. 5,66.
35. Обчислити рН фосфатного буфера, що одержали при змішуванні 50 мл розчину NаН2РО4 з с0(NаН2РО4) = 0,2 моль/л і 150 мл розчину Nа2НРО4 з с0(Nа2НРО4) = 0,1 моль/л. Кд (Н2РО4– ) = 6,2∙10–8моль/л.
а. 7,03; б. 8,89; в. 7,42; г. 7,38; д. 7,50.
36. Обчислити рН амонійного буфера, що одержали при змішуванні 200 мл розчину NH4Cl з с0(NH4Cl) = 0,1 моль/л і 250 мл розчину аміаку з с0(NH3∙Н2О) = 0,2 моль/л. Кд(NH3∙Н2О) = 1,8∙10–5моль/л.
а. 8,68; б. 8,89; в. 9,38; г. 10,83; д. 9,66.
37. Обчислити рН ацетатного буфера, що одержали при змішуванні 75 мл розчину СН3СООН з с0(СН3СООН) = 0,1 моль/л і 150 мл розчину СН3СООNа з с0(СН3СООNа) = 0,2 моль/л. Кд (СН3СООН) = 1,75∙10–5моль/л.
а. 4,08; б. 4,24; в. 4,56; г. 5,16; д. 5,36.
38. Обчислити рН фосфатного буфера, що одержали при змішуванні 50 мл розчину NаН2РО4 з с0(NаН2РО4) = 0,2 моль/л і 150 мл розчину Nа2НРО4 з с0(Nа2НРО4) = 0,05 моль/л. Кд (Н2РО4– ) = 6,2∙10–8моль/л.
а. 7,08; б. 7,22; в. 7,36; г. 7,41; д. 7,45.
39. Обчислити рН амонійного буфера, що одержали при змішуванні 400 мл розчину NH4Cl з с0(NH4Cl) = 0,1 моль/л і 250 мл розчину аміаку з с0(NH3∙Н2О) = 0,2 моль/л. Кд(NH3∙Н2О) = 1,8∙10–5моль/л.
а. 9,44; б. 8,96; в. 9,72; г. 9,36; д. 9,24.
40. Обчислити рН ацетатного буфера, що одержали при змішуванні 250 мл розчину СН3СООН з с0(СН3СООН) = 0,1 моль/л і 750 мл розчину СН3СООNа з с0(СН3СООNа) = 0,2 моль/л. Кд (СН3СООН) = 1,75∙10–5моль/л.
а. 5,36; б. 5,54; в. 5,26; г. 5,06; д. 4,76.
41. Розрахувати об’єми розчинів СН3СООН з с0(СН3СООН) = 0,1 моль/л і СН3СООNа з с0(СН3СООNа) = 0,1 моль/л, а також води, які необхідно змішати, щоб одержати 400 мл ацетатного буфера з с(буфера) = 0,05 моль/л і рН = 5,24. Кд (СН3СООН) = 1,75∙10–5моль/л. У відповіді об’єми складових буфера виразити в літрах.
V (Н2О): а) 0,2 ; б) 0,1; в) 0,25; г) 0,2 ; д) 0,1;
V (СН3СООNа): 0,15; 0,2; 0,05; 0,05; 0,1;
V (СН3СООН): 0,05; 0,1; 0,1 ; 0,15; 0,2.
42. Розрахувати об’єми розчинів Nа2НРО4 з с0(Nа2НРО4) = 0,02 моль/л і NаН2РО4 з с0(NаН2РО4) = 0,02 моль/л, які необхідно змішати, щоб одержати 200 мл фосфатного буфера з с(буфера) = 0,02 моль/л і рН = 7,68. Кд (Н2РО4–) = 6,2∙10–8моль/л. У відповіді об’єми компонентів буфера виразити в літрах.
V (Nа2НРО4): а) 0,15; б) 0,05; в) 0,10; г) 0,12; д) 0,08;
V (NаН2РО4): 0,05; 0,15; 0,10; 0,08; 0,12.
43. Розрахувати об’єми розчинів СН3СООН з с0(СН3СООН) = 0,1 моль/л і СН3СООNа з с0(СН3СООNа) = 0,1 моль/л, а також води, які необхідно змішати, щоб одержати 800 мл ацетатного буфера з с(буфера) = 0,05 моль/л і рН = 5,24. Кд (СН3СООН) = 1,75∙10–5моль/л. У відповіді об’єми складових буфера виразити в літрах.
V (Н2О): а)0,2; б) 0,1; в) 0,4; г) 0,4; д) 0,3;
V (СН3СООNа): 0,4; 0,5; 0,3; 0,2; 0,4;
V (СН3СООН): 0,2; 0,2; 0,1; 0,2; 0,1.
44. Розрахувати об’єми розчинів Nа2НРО4 з с0(Nа2НРО4) = 0,1 моль/л і NаН2РО4 з с0(NаН2РО4) = 0,1 моль/л, а також води, які необхідно змішати, щоб одержати 600 мл фосфатного буфера з с(буфера) = 0,05 моль/л і рН = 5,46. Кд (Н2РО4– ) = 6,2∙10–8моль/л. У відповіді об’єми складових буфера виразити в літрах.
V (Н2О): а) 0,2; б) 0,3; в) 0,1; г) 0,2; д) 0,3;
V (Nа2НРО4): 0,3; 0,2; 0,2; 0,1; 0,1;
V (NаН2РО4): 0,1; 0,1; 0,3; 0,3; 0,2.
45. Розрахувати об’єми розчинів Nа2НРО4 з с0(Nа2НРО4) = 0,02 моль/л і NаН2РО4 з с0(NаН2РО4) = 0,02 моль/л, а також води, які необхідно змішати, щоб одержати 400 мл фосфатного буфера з с(буфера) = 0,01 моль/л і рН = 7,68. Кд (Н2РО4– ) = 6,2∙10–8моль/л. У відповіді об’єми складових буфера виразити в літрах.
V (Н2О): а) 0,05; б) 0,20; в) 0,20; г) 0,15; д) 0,05;
V (Nа2НРО4): 0,15; 0,05; 0,15; 0,20; 0,20;
V (NаН2РО4): 0,20; 0,15; 0,05; 0,05; 0,15.
46. Розрахувати об’єми розчинів СН3СООН з с0(СН3СООН) = 0,1 моль/л і СН3СООNа з с0(СН3СООNа) = 0,1 моль/л, які необхідно змішати, щоб одержати 300 мл ацетатного буфера з с(буфера) = 0,1 моль/л і рН = 5,46. Кд (СН3СООН) = 1,75∙10–5моль/л. У відповіді об’єми компонентів буфера виразити в літрах.
V (СН3СООNа): а) 0,05; б) 0,15; в) 0,25; г) 0,1; д) 0,2;
V (СН3СООН): 0,25; 0,15; 0,05; 0,2; 0,1.
47. Розрахувати об’єми розчинів СН3СООН з с0(СН3СООН) = 0,2 моль/л і СН3СООNа з с0(СН3СООNа) = 0,2 моль/л, які необхідно змішати, щоб одержати 300 мл ацетатного буфера з с(буфера) = 0,2 моль/л і рН = 5,06. Кд (СН3СООН) = 1,75∙10–5моль/л. У відповіді об’єми компонентів буфера виразити в літрах.
V (СН3СООNа): а) 0,05; б) 0,15; в) 0,25; г) 0,1; д) 0,2;
V (СН3СООН): 0,25; 0,15; 0,05; 0,2; 0,1.
48. Розрахувати об’єми розчинів Nа2НРО4 з с0(Nа2НРО4) = 0,02 моль/л і NаН2РО4 з с0(NаН2РО4) = 0,02 моль/л, які необхідно змішати, щоб одержати 600 мл фосфатного буфера з с(буфера) = 0,02 моль/л і рН = 7,9. Кд (Н2РО4– ) = 6,2∙10–8моль/л. У відповіді об’єми компонентів буфера виразити в літрах.
V (Nа2НРО4): а) 0,4; б) 0,5; в) 0,2; г) 0,1; д) 0,3;
V (NаН2РО4): 0,2; 0,1; 0,4; 0,5; 0,3.
49. Розрахувати об’єми розчинів СН3СООН з с0(СН3СООН) = 0,2 моль/л і СН3СООNа з с0(СН3СООNа) = 0,2 моль/л, а також води, які необхідно змішати, щоб одержати 600 мл ацетатного буфера з с(буфера) = 0,1 моль/л і рН = 5,06.Кд (СН3СООН) = 1,75∙10–5моль/л. У відповіді об’єми складових буфера виразити в літрах.
V (Н2О): а) 0,3; б) 0,3; в) 0,1; г) 0,6; д) 0,2;
V (СН3СООNа): 0,1; 0,2; 0,3; 0,15; 0,2;
V (СН3СООН): 0,2; 0,1; 0,2; 0,15; 0,2.
50. Розрахувати об’єми розчинів Nа2НРО4 з с0(Nа2НРО4) = 0,01 моль/л і NаН2РО4 з с0(NаН2РО4) = 0,01 моль/л, а також води, які необхідно змішати, щоб одержати 600 мл фосфатного буфера з с(буфера) = 0,005 моль/л і рН = 7,9. Кд (Н2РО4– ) = 6,2∙10–8моль/л. У відповіді об’єми складових буфера виразити в літрах.
V (Н2О): а) 0,05; б) 0,05; в) 0,25; г) 0,30; д) 0,25;
V (Nа2НРО4): 0,30; 0,25; 0,30; 0,25; 0,05;
V (NаН2РО4): 0,25; 0,30; 0,05; 0,05; 0,30.
51. Розрахувати об’єми розчинів Nа2НРО4 з с0(Nа2НРО4) = 0,05 моль/л і NаН2РО4 з с0(NаН2РО4) = 0,05 моль/л, які необхідно змішати, щоб одержати 800 мл фосфатного буфера з с(буфера) = 0,05 моль/л і рН = 7,2. Кд (Н2РО4– ) = 6,2∙10–8моль/л. У відповіді об’єми компонентів буфера виразити в літрах.
V (Nа2НРО4): а) 0,3; б) 0,2; в) 0,5; г) 0,6; д) 0,4;
V (NаН2РО4): 0,5; 0,6; 0,3; 0,2; 0,4.
52. Розрахувати об’єми розчинів СН3СООН з с0(СН3СООН) = 0,2 моль/л і СН3СООNа з с0(СН3СООNа) = 0,2 моль/л, які необхідно змішати, щоб одержати 800 мл ацетатного буфера з с(буфера) = 0,2 моль/л і рН = 5,24. Кд (СН3СООН) = 1,75∙10–5моль/л. У відповіді об’єми компонентів буфера виразити в літрах.
V (СН3СООNа): а) 0,4; б) 0,2; в) 0,6; г) 0,35; д) 0,3;
V(СН3СООН): 0,4; 0,6 ; 0,2; 0,25; 0,3.
53. Розрахувати об’єми розчинів СН3СООН з с0(СН3СООН) = 0,2 моль/л і СН3СООNа з с0(СН3СООNа) = 0,2 моль/л, а також води, які необхідно змішати, щоб одержати 240 мл ацетатного буфера з с(буфера) = 0,1 моль/л і рН = 5,46. Кд (СН3СООН) = 1,75∙10–5моль/л. У відповіді об’єми складових буфера виразити в літрах.
V (Н2О): а) 0,1; б) 0,04; в) 0,12; г) 0,1; д) 0,12;
V (СН3СООNа): 0,1; 0,12; 0,08; 0,12; 0,1;
V (СН3СООН): 0,04; 0,08; 0,04; 0,02; 0,02.
54. Розрахувати об’єми розчинів Nа2НРО4 з с0(Nа2НРО4) = 0,02 моль/л і NаН2РО4 з с0(NаН2РО4) = 0,02 моль/л, а також води, які необхідно змішати, щоб одержати 500 мл фосфатного буфера з с(буфера) = 0,01 моль/л і рН = 7,8. Кд (Н2РО4– ) = 6,2∙10–8моль/л. У відповіді об’єми складових буфера виразити в літрах.
V (Н2О): а) 0,25; б) 0,25; в) 0,20; г) 0,20; д) 0,05;
V (Nа2НРО4): 0,05; 0,20; 0,05; 0,25; 0,20;
V (NаН2РО4): 0,20; 0,05; 0,25; 0,05; 0,25.
55. Написати іонне рівняння реакції, що пояснює механізм дії фосфатного буфера при додаванні до нього помірної кількості калій гідроксиду.
56. Написати іонне рівняння реакції, що пояснює механізм дії гідрогенкарбонатного буфера при додаванні до нього помірної кількості хлоридної кислоти.
57. Написати іонне рівняння реакції, що пояснює механізм дії амонійного буфера при додаванні до нього помірної кількості калій гідроксиду.
58. Написати іонне рівняння реакції, що пояснює механізм дії ацетатного буфера при додаванні до нього помірної кількості хлоридної кислоти.
59. Написати іонне рівняння реакції, що пояснює механізм дії фосфатного буфера при додаванні до нього помірної кількості хлоридної кислоти.
60. Написати іонне рівняння реакції, що пояснює механізм дії гідрокарбонатного буфера при додаванні до нього помірної кількості натрій гідроксиду.
61. Написати іонне рівняння реакції, що пояснює механізм дії амонійного буфера при додаванні до нього помірної кількості хлоридної кислоти.
62. Написати іонне рівняння реакції, що пояснює механізм дії ацетатного буфера при додаванні до нього помірної кількості натрій гідроксиду.
Тема 8 Визначення буферної ємності. Роль буферів в біосистемах
Буферні розчини здатні:
підтримувати постійне значення рН при безмежному розведенні;
підтримувати постійне значення рН при додаванні будь-яких кількостей сильної кислоти або лугу;
підтримувати постійне значення рН тільки при додаванні порівнянню невеликих кількостей сильних кислот або лугів та обмеженому розведенні.
Буферна ємність вимірюється:
кількістю кислоти, додавання якої до буферного розчину не змінює його рН;
кількістю кислоти чи основи, додавання яких до 1 л розчину змінює рН на одиницю;
кількістю основи, додавання якої до 1 л розчину змінює рН на 2 одиниці;
кількістю кислоти чи основи, додавання яких до буферного розчину не змінює його рН.
Буферна ємність характеризує здатність буферного розчину:
протидіяти зміщенню реакції середовища при додаванні сильних кислот та сильних основ;
сприяти зміщенню реакції середовища при додаванні сильних кислот та сильних основ;
підтримувати постійну концентрацію солі у розчині, незалежно від кількості доданої сильної кислоти чи основи;
змінювати значення рН розчину, незалежно від кількості доданої сильної кислоти чи основи.
Одиниці виміру буферної ємності:
моль/л;
%;
г/л;
кг/см3.
Буферна ємність залежить від:
об’єму буферного розчину;
кількості доданої сильної кислоти чи сильної основи;
співвідношення кількості компонентів кислотно–основної пари;
концентрації солі у розчині і не залежить від концентрації слабкої кислоти чи слабкої основи.
Чим більша концентрація кожного із компонентів кислотно–основної пари, тим буферна ємність такого розчину:
вища;
не залежить від концентрації компонентів.
нижча.
Максимальне значення буферної ємності при:
рН= рК;
рН> рК;
рН< рК;
рН= рК+1.
Буферна ємність розчину найбільша, якщо:
співвідношення концентрацій компонентів буферної суміші більше 1;
співвідношення концентрацій компонентів буферної суміші менше 1;
співвідношення концентрацій компонентів буферної суміші =1;
співвідношення концентрацій компонентів буферної суміші не впливає на величину буферної ємності.
Будь–яка буферна суміш практично зберігає сталість рН лише за умови:
додавання відносно невеликої кількості сильної кислоти або лугу;
додавання будь–якої кількості сильної кислоти або лугу;
додавання досить значної кількості слабкої кислоти або основи;
додавання великої кількості сильної кислоти або лугу.
При використанні кислотних буферних розчинів для забезпечення найбільшої буферної ємності треба вибирати такі кислоти, для яких:
значення рК найбільш близьке до заданого значення (14–рН);
природа кислоти не має значення;
значення рК найбільш близьке до заданого значення рН;
значення рК відмінне від заданого значення рН щонайменш у 10 разів.
При роботі з основними буферними розчинами для забезпечення найбільшої буферної ємності потрібно вибирати такі основи, для яких:
значення рК найбільш близьке до заданого значення рН;
значення рК відмінне від заданого значення рН щонайменш у 10 разів;
значення рК найбільш близьке до потрібного значення (14 – рН);
значення рК найбільш близьке до заданого значення рН.
Яка буферна система з перерахованих буферних систем крові має найбільшу буферну ємність:
гідрогенкарбонатна;
гемоглобінові;
фосфатна;
амінокислотна.
В міру поступового додавання до буферного розчину сильної кислоти або лугу стійкість розчину до зміни рН:
поступово зменшується;
залишається постійною;
поступово збільшується;
різко зменшується.
Буферні системи при поступовому додаванні значної кількості сильної кислоти або лугу змінюють рН:
негайно, практично миттєво;
не реагують на зміну рН;
поступово;
спочатку підвищують значення рН розчину на одиницю, а потім зменшують на одиницю.
in vivo відновлення буферної системи крові забезпечується:
нирками і легенями;
виключно нирками;
виключно легенями;
легенями і шлунком.
Буферна ємність внутрішнього середовища еритроцитів зумовлена наявністю:
гідрогенкарбонатної (H2CO3/KHCO3) та фосфатної (KH2PO4/K2HPO4) буферних систем;
гідрогенкарбонатної (H2CO3/KHCO3), фосфатної (KH2PO4/K2HPO4) та білкової буферних систем;
гідрогенкарбонатної (H2CO3/KHCO3) буферної системи;
гідрогенкарбонатної (H2CO3/KHCO3) та білкової буферних систем.
Буферна ємність плазми крові зумовлена наявністю:
гідрогенкарбонатної (H2CO3/KHCO3) та фосфатної (KH2PO4/K2HPO4) буферних систем;
гідрогенкарбонатної (H2CO3/KHCO3), фосфатної (KH2PO4/K2HPO4) та білкової буферних систем;
гідрогенкарбонатної (H2CO3/KHCO3) буферної системи;
гідрогенкарбонатної (H2CO3/KHCO3) та білкової буферних систем.
Гідрогенкарбонатна буферна система має взаємозв'язок:
з буферними системами тільки внутрішньоклітинних рідин;
із усіма буферними системами і позаклітинних, і внутрішньоклітинних рідин;
з буферними системами лише позаклітинних рідин;
існує в організмі ізольовано.
Фосфатна буферна система має буферну ємність:
значну за кислотою, незначну за лугом;
значну як за кислотою, так і за лугом;
незначну як за кислотою, так і за лугом;
незначну за кислотою, значну за лугом.
Буферна ємність вільних амінокислот плазми крові:
значна за кислотою, незначна за лугом;
незначна як за кислотою, так і за лугом;
значна за лугом, незначна за кислотою;
значна як за кислотою, так і за лугом.
Буферна ємність білків плазми крові є:
незначною як за кислотою, так і за лугом;
значною як за кислотою, так і за лугом;
значною за кислотою, незначною за лугом;
незначною за кислотою, значною за лугом.
Потужність буферних систем плазми крові зменшується у ряді:
білки; (NaHCO3/ H2CO3); (Na2HPO4/ NaH2PO4); амінокислоти;
(NaHCO3/ H2CO3); білки; (Na2HPO4/ NaH2PO4); амінокислоти;
(Na2HPO4/ NaH2PO4); (NaHCO3/ H2CO3); білки; амінокислоти;
білки; (Na2HPO4/ NaH2PO4); амінокислоти; (NaHCO3/ H2CO3).
Фосфоліпіди, які складають основу мембран еритроцитів:
відіграють значну роль у підтримці сталого значення рН внутрішнього середовища еритроцитів;
не підтримують кислотно–основну рівновагу внутрішнього середовища еритроцитів;
відіграють незначну роль у підтримці сталого рН внутрішнього середовища еритроцитів;
відіграють значну роль у підтримці сталого значення рН плазми крові.
Значення рК дисоціації фосфатних груп знаходяться у межах 6,8 – 7.2, тому за фізіологічних умов рН фосфоліпіди мембран еритроцитів знаходяться як у іонізованому, так і неіонізованому стані. Тобто сама мембрана еритроцитів:
не підтримує стале значення рН внутрішнього середовища еритроцитів;
володіє буферною дією і підтримує стале значення рН внутрішнього середовища еритроцитів;
не є буферною системою;
підтримує сталість рН плазми крові.
Буферна ємність, що визначається білками плазми, залежить від:
структури та числа вільних протон–акцепторних груп білків і не залежить від їх концентрації;
концентрації білків, їх структури та числа вільних протон–акцепторних груп;
концентрації білків та не залежить від їх структури та числа вільних протон–акцепторних груп;
білки плазми не виявляють буферних властивостей і, отже, буферна ємність для цієї системи не є характеристикою.
Гідрокарбонатна буферна система більш ефективно компенсує дію речовин:
які збільшують основність крові, ніж речовин, які збільшують кислотність крові;
які зменшують кислотність крові;
які збільшують кислотність крові;
в однаковій мірі компенсує дію речовин, що призводять до зміни кислотно–основного стану крові.
Надлишок CO2 в атмосфері приводить до додаткового розчинення CO2 у крові (згідно з законом Генрі). Це, в свою чергу, викликає:
підвищення рН крові (алкалоз);
зниження рН крові (ацидоз);
не змінює рН крові.
Надходження в кров кислот – донорів гідроген-іонів викликає зсув рівноваги в ланцюжку (за принципом Ле Шательє):
![]()
вправо з утворенням надлишку іонів HCO3–;
вліво в результаті того, що іони HCO3– зв’язують іони гідрогену в молекули H2CO3. які в момент утворення розкладаються на СО2 і Н2О;
не викликає зсув рівноваги;
кислоти не є донорами гідроген іонів і тому не впливають на кислотно–основну рівновагу у крові.
Зміна параметрів гідрогенкарбонатної буферної системи:
не має значення для кислотно–основного стану організму;
досить точно характеризує стан дихальних або метаболічних порушень, тобто кислотно–основний стан організму;
гідрокарбонатна буферна системи не змінює своїх параметрів за будь–яких умов.
Буферна ємність за кислотою, встановлена титриметричним методом, обчислюється за формулою:
а)

в)

с)
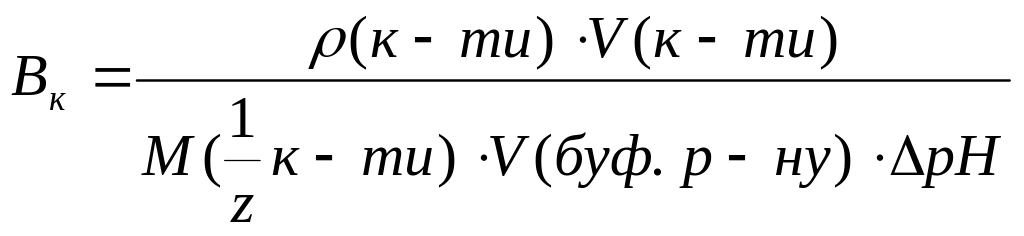
д)

Буферна ємність за основою дорівнює:
а)

в)
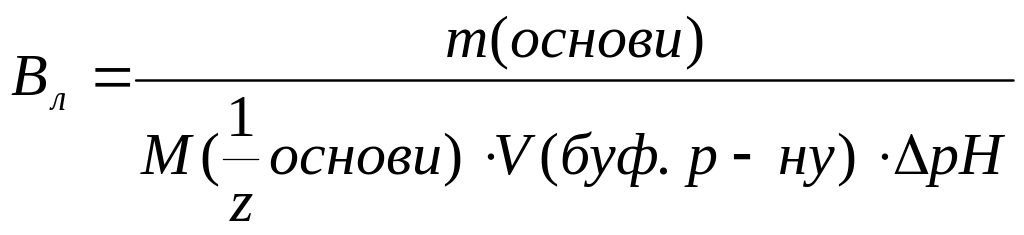
с)

д)
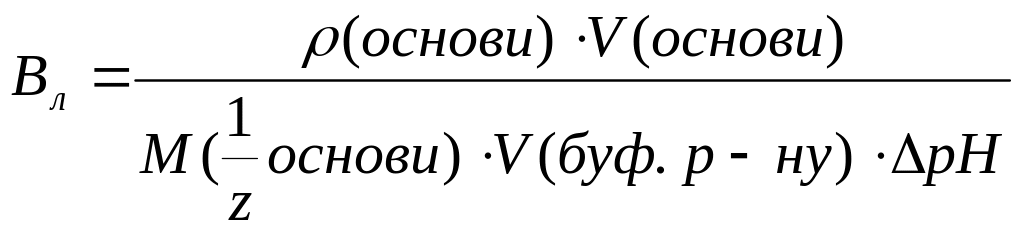
Для зміни рН від 7,36 до 7.4 до 10,0 мл крові додано 3,6 см3 0,05 моль/л розчину хлоридної кислоти. Яка буферна ємність крові за кислотою:
50 ммоль/л;
5 ммоль/л;
0,05 ммоль/л;
50 моль/л?
Яка ємність буферного розчину за кислотою, якщо при титруванні 10,0 см3 розчину затрачено 5,7 мл 0,1 моль/л розчину хлоридної кислоти на зменшення рН з 4,0 до 3,1:
6,3ммоль/л;
63ммоль/л;
63 моль/л;
0,063ммоль/л?
Яка ємність буферного розчину за лугом, якщо при титруванні 10,0 см3 розчину затрачено 2,0 см3 0,2 моль/л розчину натрій гідроксиду на збільшення рН з 4,0 до 6,0:
20 ммоль/л;
2 ммоль/л;
20 моль/л;
0,02 ммоль/л?
Яка буферна ємність сироватки крові за лугом, якщо після титрування 5 см3 її затрачено 2,1 мл 0,1 моль/л розчину натрій гідроксиду при зміні рН з 7,4 до 9,4:
2,1 ммоль/л;
21 моль/л;
21 ммоль/л;
0,021 ммоль/л?
До 100 мл крові добавили 14 мл 0,1 моль/л розчину натрій гідроксиду при цьому рН змінилось з 7,36 до 9,36. Буферну ємність за лугом дорівнює:
0,7 ммоль/л;
7 ммоль/л;
70 ммоль/л;
0,07 ммоль/л.
До 100 мл крові добавили 36 мл 0,1 моль/л розчину хлоридної кислоти при цьому рН змінилось з 7,36 до 6,64. Буферна ємність за кислотою дорівнює:
5 ммоль/л;
0,05 ммоль/л;
50 моль/л;
50 ммоль/л.
Розрахуйте буферну ємність буферного розчину за кислотою, якщо при додаванні до 50 мл цього розчину 2 мл хлоридної кислоти з молярною концентрацією 0,8 моль/л рН розчину змінилось з 7,3 до 6,85:
0,071ммоль/л;
7,1 ммоль/л;
71 моль/л;
71 ммоль/л.
Яка буферна ємність сироватки крові за калій гідроксидом, якщо після титрування 10,0 мл її затрачено 8,4 см3 0,05 моль/л розчину калій гідроксиду при зміні рН з 7,4 до 9,4:
21 моль/л;
21 ммоль/л;
21 ммоль/г;
0,021 ммоль/л?
Яка буферна ємність фосфатної буферної системи за лугом, якщо після титрування 10,0 мл її затрачено 5,3 мл 0,01 моль/л розчину калій гідроксиду при зміні рН на 1?
Яка буферна ємність фосфатної буферної системи за кислотою, якщо після титрування 100,0 мл її затрачено 14,7 мл 0,01 моль/л розчину хлоридної кислоти при зміні рН на 1,2?
Яка буферна ємність фосфатної буферної системи за лугом, якщо після титрування 50,0 мл її затрачено 2,2 мл 0,01 моль/л розчину калій гідроксиду при зміні рН з 7,4 до 8,2?
Розрахуйте буферну ємність фосфатної буферної системи за кислотою, якщо при додаванні до 50 мл цього розчину 7,3 мл хлоридної кислоти з молярною концентрацією 0,01 моль/л рН розчину змінилось з 7,3 до 6,2.
Яка буферна ємність гідрогенкарбонатної буферної системи плазми крові за лугом, якщо після титрування 100,0 мл її затрачено 15,3 мл 0,01 моль/л розчину калій гідроксиду при зміні рН на 1 одиницю?
Яка буферна ємність гідрогенкарбонатної буферної системи плазми крові за кислотою, якщо після титрування 10,0 мл її затрачено 9,8 мл 0,1 моль/л розчину хлоридної кислоти при зміні рН на 2 одиниці?
Яка буферна ємність гідрогенкарбонатної буферної системи плазми крові за лугом, якщо після титрування 50,0 мл її затрачено 3, мл 0,01 моль/л розчину калій гідроксиду при зміні рН з 7,4 до 8,2?
Розрахуйте буферну ємність гідрогенкарбонатної буферної системи плазми крові за кислотою, якщо при додаванні до 25 мл цього розчину 14,3 мл хлоридної кислоти з молярною концентрацією 0,05 моль/л рН розчину змінилось з 7,4 до 6,7.
Розрахуйте буферну ємність суміші, що складається з 0.01 моля ацетатної кислоти та 0.03 моля натрій ацетату у 100 мл розчину. рКа=4,76.
Яка кількість доданої хлоридної кислоти призведе до помітної зміни значення рН розчину суміші 0.035 моля NaHCO3 та 0.050 моля H2CO3?
Як приготувати два буферних розчини, які складаються з однакових компонентів та мають однакове значення рН, але відрізняються за буферною ємністю?
До 100мл крові додати 14мл розчину NaOH з с(NaOH) =0,1моль/л, при цьому рН змінився від 7,36 до 9,36. Визначити буферну ємність крові за лугом.
До 100мл крові додали 36мл розчину HCl з c(HCl) = 0,1моль/л, при цьому рН змінився від 7,36 до 6,64. Визначити буферну ємність крові за кислотою.
Розрахуйте співвідношення концентрацій
 в умовах плазми крові (при 37ºC) pK1
= 6,1.
в умовах плазми крові (при 37ºC) pK1
= 6,1.Розрахуйте співвідношення концентрацій
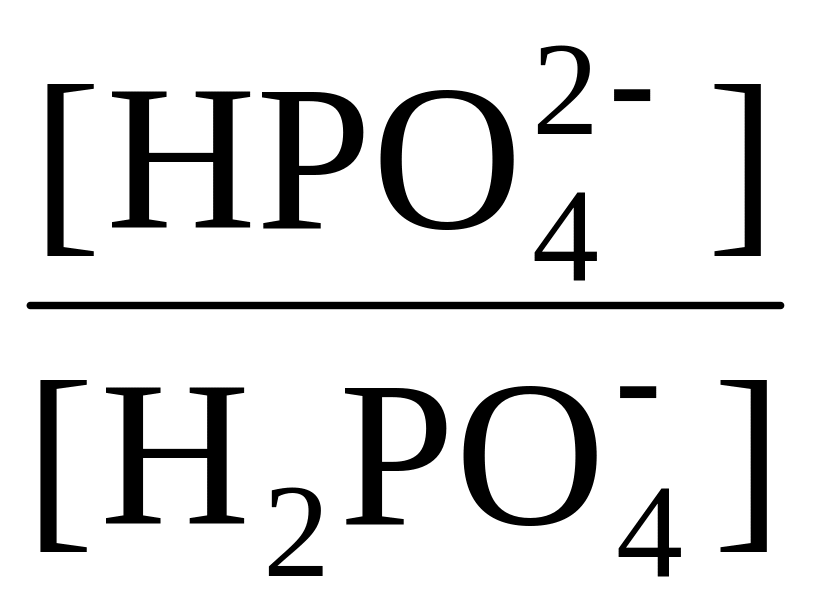 в умовах плазми крові (при 37ºC) pK1
= 6,8.
в умовах плазми крові (при 37ºC) pK1
= 6,8.Розрахуйте співвідношення концентрацій в умовах еритроцитів (при 37ºC) pK1 = 6,1.
Розрахуйте співвідношення концентрацій в умовах еритроцитів (при 37ºC) pK1 = 6,8.
Запишіть рівняння Гендерсона–Гассельбаха для гемоглобінової буферної системи. (рКHHb = 8,2;)
Запишіть рівняння Гендерсона–Гассельбаха для оксигемоглобінової
(
![]() = 6,95) буферної системи.
= 6,95) буферної системи.
Які іони Hb‾ чи HbО2‾ будуть активніше зв’язувати протони? (рКHHb = 8,2; = 6,95).
Вкажіть область рН ефективної дії ацетатної буферної суміші:
a) рН = 3,7 – 5,7; b) рН = 8,2 – 10,2;
c) рН = 9,3 – 11,3; d) рН = 6,2 – 8,2.
Вкажіть область рН ефективної дії аміачної буферної суміші:
a) рН = 3,7 – 5,7; b) рН = 8,2 – 10,2;
c) рН = 9,3 – 11,3; d) рН = 6,2 – 8,2.
Вкажіть область рН ефективної дії фосфорної буферної суміші:
a) рН = 3,7 – 5,7; b) рН = 8,2 – 10,2;
c) рН = 9,3 – 11,3; d) рН = 6,2 – 8,2.
Вкажіть область рН ефективної дії гідрогенкарбонатної буферної суміші:
a) рН = 3,7 – 5,7; b) рН = 8,2 – 10,2;
c) рН = 5,4 – 7,4; d) рН = 6,2 – 8,2.
Вкажіть область рН ефективної дії оксигемоглобінової буферної суміші:
a) рН = 3,7 – 5,7; b) рН = 8,2 – 10,2;
c) рН = 7,2 – 9,2; d) рН = 6,2 – 8,2.
Вкажіть область рН ефективної дії гемоглобінової буферної суміші:
a) рН = 5,95 – 7,95; b) рН = 8,2 – 10,2;
c) рН = 7,2 – 9,2; d) рН = 6,2 – 8,2.
Який з буферних розчинів складу по 100ммоль оцтової кислоти й ацетату натрію чи по 10ммоль оцтової кислоти й ацетату натрію буде мати більшу буферну ємність при додаванні до 1 л буферного розчину 5 ммоль НСl?
Тема 9 Колігативні властивості розчинів
1. Яким буде розчин кальцій хлориду стосовно розчину натрій хлориду , якщо молярні концентрації електролітів однакові:
а) ізотонічним; б) гіпертонічним; в) гіпотонічним?
2. Яким буде розчин кальцій нітрату стосовно розчину натрій
хлориду, якщо молярні концентрації електролітів однакові:
а) ізотонічним; б) гіпертонічним; в) гіпотонічним?
3. Яким буде розчин амоній хлориду стосовно розчину калій сульфату, якщо молярні концентрації електролітів однакові:
а) гіпотонічним; б) ізотонічним; в) гіпертонічним?
4. Яким буде розчин амоній сульфату стосовно розчину калій сульфату, якщо молярні концентрації електролітів однакові:
а) гіпертонічним; б) ізотонічним; в) гіпотонічним?
5. Яким буде розчин калій сульфату стосовно розчину натрій сульфату, якщо молярні концентрації електролітів однакові:
а) ізотонічним; б) гіпотонічним; в) гіпертонічним?
6. Яким буде розчин натрій хлориду стосовно розчину калій сульфату, якщо молярні концентрації електролітів однакові:
а) гіпотонічним; б) ізотонічним; в) гіпертонічним?
7. Яким буде розчин натрій хлориду стосовно розчину амоній сульфату, якщо молярні концентрації електролітів однакові:
а) гіпертонічним; б) гіпотонічним; в) ізотонічним?
8. Яким буде розчин калій сульфату стосовно розчину кальцій нітрату, якщо молярні концентрації електролітів однакові:
а) ізотонічним; б) гіпертонічним; в) гіпотонічним?
9. Яким буде розчин калій хлориду стосовно розчину кальцій хлориду, якщо молярні концентрації електролітів однакові:
а) ізотонічним; б) гіпертонічним; в) гіпотонічним?
10. Яким буде розчин натрій хлориду стосовно розчину кальцій хлориду, якщо молярні концентрації електролітів однакові:
а) ізотонічним; б) гіпотонічним; в) гіпертонічним?
11. Яким буде розчин натрій сульфату стосовно розчину натрій хлориду, якщо молярні концентрації електролітів однакові:
а) ізотонічним; б) гіпертонічним; в) гіпотонічним?
12. Яким буде розчин калій сульфату стосовно розчину натрій хлориду, якщо молярні концентрації електролітів однакові:
а) ізотонічним; б) гіпотонічним; в) гіпертонічним?
13. Який із розчинів має найбільший осмотичний тиск, якщо масові концентрації розчинених речовин однакові:
а) фруктози; б) мальтози; в) рибози; г) глюкози?
14. Який із розчинів має найменший осмотичний тиск, якщо масові концентрації розчинених речовин однакові:
а) сахарози; б) глюкози; в) фруктози; г) рибози?
15. Який із розчинів має найбільший осмотичний тиск, при однаковій температурі, якщо масові концентрації розчинених речовин однакові:
а) калій хлориду; б) літій хлориду; в) амоній хлориду;
г) кальцій хлориду; д) натрій хлориду?
16. Який із розчинів має найбільший осмотичний тиск, якщо масові концентрації розчинених речовин однакові:
а) калій хлориду; б) літій хлориду; в) амоній хлориду;
г) алюміній хлориду; д) натрій хлориду?
17. Для якого із розчинів ізотонічний коефіцієнт для NaCl найбільший:
а) c(NaCl) = 0,1моль/л; б) c(NaCl) = 0,01моль/л;
в) c(NaCl) = 0,05моль/л; г) c(NaCl) = 0,001моль/л?
18. Для якого із розчинів СaCl2 ізотонічний коефіцієнт найбільший:
а) с(СaCl2) = 0,2моль/л; б) с(СaCl2) = 0,1моль/л;
в) с(СaCl2) = 0,01моль/л; г) с(СaCl2) = 0,05моль/л?
19. Для якого електроліту ізотонічний коефіцієнт найбільший у таких розчинах:
а) c(NaCl) = 0,01моль/л; б) c(KCl) = 0,01моль/л;
в) c(K2SO4) = 0,01моль/л; г) c(MgSO4) = 0,01моль/л?
20. Для якого електроліту ізотонічний коефіцієнт найбільший у таких розчинах:
а) c(NaNO3) = 0,01моль/л; б) c(KNO3) = 0,01моль/л;
в) c(Ca(NO3)2) = 0,01моль/л; г) c(LiNO3) = 0,01моль/л?
21. Для якого із водних розчинів температура замерзання найнижча:
а) b(NaCl) = 0,1моль/кг; б) b(глюкози) = 0,1моль/кг;
в) b(KCl) = 0,1моль/кг; г) b(CaCl2) = 0,1моль/кг?
22. Для якого із водних розчинів температура замерзання найнижча:
а) b(КCl) = 0,1моль/кг; б) b(KNO3) = 0,1моль/кг;
в) b(K2SO4) = 0,1моль/кг; г) b(KBr) = 0,1моль/кг?
23. Для якого із водних розчинів температура замерзання найнижча:
а) b(глюкози) = 0,1моль/кг; б) b(рибоза) = 0,1моль/кг;
в) b(сахарози) = 0,1моль/кг; г) b(NaCl) = 0,1моль/кг?
24. Для якого із водних розчинів температура замерзання найнижча:
а) b(глюкози) = 0,1моль/кг; б) b(KCl) = 0,1моль/кг;
в) b(сахарози) = 0,1моль/кг; г) b(K2SO4) = 0,1моль/кг?
25. Для якого із водних розчинів температура замерзання найнижча:
а) 10г глюкози на 1000г води; б) 10г рибози на1000г води;
в) 10г фруктози на 1000г води; г) 10г сахарози на 1000г води?
26. Для якого із водних розчинів температура замерзання найнижча:
а) 10г NaCl на 1000г води; б) 10г КCl на 1000г води;
в) 10г KNO3 на 1000г води; г) 10г NaNO3 на 1000г води?
27. Для якого із водних розчинів температура кипіння найвища:
а) b(NaCl) = 0,1моль/кг; б) b(глюкози) = 0,1моль/кг;
в) b(KCl) = 0,1моль/кг; г) b(CaCl2) = 0,1моль/кг?
28. Для якого із водних розчинів температура кипіння найвища:
а) b(КCl) = 0,1моль/кг; б) b(KNO3) = 0,1моль/кг;
в) b(K2SO4) = 0,1моль/кг; г) b(KBr) = 0,1моль/кг?
29. Який із розчинів натрій хлориду стосовно крові буде гіпотонічним і в ньому буде відбуватися гемоліз:
а) ω(NaCl) = 10%; б) ω(NaCl) = 9%;
в) ω(NaCl) = 0,9%; г) ω(NaCl) = 0,09%?
30. Який розчин натрій хлориду стосовно крові буде гіпотонічним і в ньому буде відбуватися гемоліз:
а) ω(NaCl) = 0,1; б) ω(NaCl) = 0,09;
в) ω(NaCl) = 0,009; г) ω(NaCl) = 0,0009?
31. Який із розчинів натрій хлориду стосовно крові буде гіпотонічним і в ньому буде відбуватися гемоліз:
а) c(NaCl) = 1,5моль/л; б) c(NaCl) = 0,5моль/л;
в) c(NaCl) = 0,15моль/л; г) c(NaCl) = 0,015моль/л?
32. Який із розчинів натрій хлориду стосовно крові буде гіпертонічним:
а) ω(NaCl) = 0,09; б) ω(NaCl) = 0,009;
в) ω(NaCl) = 0,0009; г) ω(NaCl) = 0,00009?
33. В якому із розчинів натрій хлориду буде відбуватися плазмоліз крові:
а) c(NaCl) = 1,5моль/л; б) c(NaCl) = 0,15моль/л;
в) c(NaCl) = 0,015моль/л; д) c(NaCl) = 0,0015моль/л?
34. Який із розчинів при температурі 370С має найменший осмотичний тиск:
а) с(NaCl) = 0,1моль/л; б) с(KCl) = 0,1моль/л;
в) с(K2SO4) = 0,1моль/л; г) c(глюкози) = 0,1моль/л?
35. Який осмотичний тиск має бути у розчинах лікарських речовин, що застосовують в медичній практиці як ізотонічні до крові:
а) π = 3,8кПа; б) π = 770Па; в) π = 7,7кПа;
г) π = 77,0кПа; д) π = 770кПа?
36. Який осмотичний тиск повинні мати розчини, що використовуються в медицині як ізотонічні розчини або кровозамінники:
а) 500-600кПа; б) 700-800кПа; в) 300-400кПа;
г) 900-1000кПа; д) 200-300кПа?
37. Чому буде дорівнювати ізотонічний коефіцієнт Вант - Гоффа для барій нітрату, якщо ця речовина повністю дисоціює у водному розчині:
а) і = 2; б) і = 4; в) і = 3; г) і = 1; д) і = 5?
38. Чому буде дорівнювати ізотонічний коефіцієнт Вант - Гоффа для калій сульфату, якщо ця речовина повністю дисоціює у водному розчині:
а) і = 4; б) і = 3; в) і = 1; г) і = 5; д) і = 2?
39. Чому буде дорівнювати ізотонічний коефіцієнт Вант - Гоффа для кальцій хлориду, якщо ця речовина повністю дисоціює у водному розчині:
а) і = 1; б) і = 4; в) і = 2; г) і = 5; д) і = 3?
40. Чому дорівнює ізотонічний коефіцієнт Вант - Гоффа для кальцій нітрату, якщо ця речовина повністю дисоціює у водному розчині:
а) і = 2; б) і = 4; в) і = 3; г) і = 1; д) і = 5?
41. Чому дорівнює коефіцієнт Вант - Гоффа для калій сульфату, якщо що ця речовина повністю дисоціює у водному розчині:
а) і = 2; б) і = 4; в) і = 3; г) і = 1; д) і = 5?
42. Чому дорівнює ізотонічний коефіцієнт Вант - Гоффа для калій нітрату, якщо ця речовина повністю дисоціює у водному розчині:
а) і = 3; б) і = 4; в) і = 2; г) і = 1; д) і = 5?
43. У якому випадку відбувається осмос, якщо через напівпроникну мембрану знаходяться у контакті розчини солей з однаковою молярною концентрацією:
а) NaCl / KCl; б) NaCl /CaCl2;
в) CaCl2 / Ca(NO3)2; г) NaCl / NaNO3?
44. Обчислити температуру замерзання розчину, в якому на 100г води припадає 3,6г глюкози. Тзам.Н2О = 273,15К; Кк = 1,86 кг·К/моль, М(С6Н12О6) = 180г/моль.
а) 198,34К; б) 325,32К; в) 211,76К;
г) 272,78К; д) 235,44К.
45. Обчислити осмотичний тиск розчину гемоглобіну при температурі 300К, якщо в 1л розчину міститься 124г гемоглобіну, враховуючи, що макромолекула гемоглобіну має глобулярну форму. R = 8,31·103л·Па/моль·К; М(гемоглобіну) = 68000г/моль.
а) 2,04·103Па; б) 1,87·103Па; в) 4,54·103Па; г) 3,46·103Па; д) 5,23·103Па.
46.
Розрахувати молярну масу неелектроліту,
якщо при розчиненні 2,3г цієї речовини
у воді, одержали 250мл розчину, осмотичний
тиск якого при 270С
дорівнює 249 кПа. R=8,31·103
![]() .
.
а) 60 г/моль; б) 92 г/моль; в) 46 г/моль; г) 50 г/моль; д) 70 г/моль.
47. Розрахувати осмотичний тиск розчину цукру, у 1л якого знаходиться 91 г розчиненої речовини (t=370С). R=8,31·103 ; М(сахарози)=342 г/моль.
а) 6,76 атм; б) 597 кПа; в) 342 кПа;
г) 685,5 кПа; д) 546 кПа.
48.
При якій температурі буде замерзати
водний розчин гліцерину, що вміщує 0,5
моль речовини на 1кг води? Кк
= 1,86![]() ;
М(С3Н6О3)
= 92 г/моль; Тзам
;
М(С3Н6О3)
= 92 г/моль; Тзам![]() =273,15К.
=273,15К.
а) – 0,930С; б) – 0,520С; в) – 0,750С; г) – 1, 550С.
49. Розрахувати величину осмотичного тиску розчину, що містить 9,2 г гліцерину (C3H8O3) в 100 мл розчину при 250С. R=8,31·103 ; М(С3Н8О3)=92 г/моль
а) 247 кПа; б) 24,4 атм; в) 2476,4 кПа;
г) 22,4 атм; д) 32,4 атм.
50. Визначити осмотичний тиск розчину, що містить 17,1 г сахарози в 500 мл розчину при температурі 370С. R=8,31·103 ; М(сахарози)=342 г/моль.
а) 1,12 атм; б) 257,61 кПа; в) 2,54 атм;
г) 11,2 атм; д) 4,36 атм.
51. Яка маса етилового спирту міститься в 10 л розчину, якщо осмотичний тиск розчину дорівнює 340 кПа при 00С. R=8,31·103 , М (С2Н5ОН) = 46г/моль.
а) 69 г; б) 3,36 г; в) 6,9 г; г) 34,5 г; д) 60,5 г.
52. Чому дорівнює осмотичний тиск розчину, що містить 12 г СН3СООН у 200мл розчину при 00С. R=8,31·103 , М(СН3СООН)=60 г/моль
а) 2267,7 кПа; б) 226,9 кПа; в) 247,6 кПа; г) 2,44 атм; д) 3,44 атм.
53. Обчислити молекулярну масу неелектроліту, якщо розчин, що вміщує 184,0 г цієї речовини в 2000г води замерзає при – 1,860С. Кк = 1,86 ; Тзам =273,15К.
а) 150 ; б) 184; в) 146; г) 174; д) 92.
54. Розчин, що вміщує 5,4г неелектроліту в 200г води кипить при 100,0780С. Обчислити молекулярну масу цієї речовини. Ке=0,52 ;Ткип = 373,15К.
а) 200; б) 154; в) 120; г) 190; д) 180.
55. Знайти осмотичний тиск розчину сахарози (ρ = 1г/мл) при 310К, якщо ω(сахарози) = 2%. М(сахарози) == 342 г/моль, R=8,31·103 .
а) 2080кПа; б) 2080кПа; в) 1040кПа;
г) 1041кПа; д) 1041кПа.
56. В 500г води розчинено 33г неелектроліту. Розчин кипить при 100,500С. Визначити молекулярну масу розчиненої речовини. Ке=0,52 ; Ткип =373,15К
а) 33; б) 66; в) 132; г) 144; д) 165.
57. Обчислити величину осмотичного тиску розчину, що містить 3 г сечовини в 100 мл розчину при 370С. R=8,31·103 , М (CO(NH2)2) = 60 г/моль.
а) 129 кПа; б) 12,71 атм; в) 1288 кПа;
г) 15,6 атм; д) 1487 кПа.
58. Знайти молекулярну масу глобулярного білка, якщо осмотичний тиск його розчину, що вміщує 20г/л білка дорівнює 1,6кПа при 298 К. R=8,31·103 .
а) 30955; б) 28634; в) 3100; г) 35600 д) 25430.
59. В 300 г води розчинено 90 г фруктози С6Н12О6. При якій температурі замерзне цей розчин? Кк = 1,86 ; М(С6Н12О6) = = 180 г/моль; Тзам =273,15К.
а) – 3,10C; б) + 3,10C; в) –1,860C; г) –2,890C; д) –4,250C.
60. Розчини хлориду натрію, хлориду літію, хлориду амонію, хлориду калію, хлориду кальцію замерзають при однакових температурах. Моляльність розчину якого електроліту найменша:
а) хлориду кальцію; б) хлориду натрію; в)хлориду калію;
г) хлориду літію; д) хлориду амонію?
61. Якщо розчини ізотонічні, то молярна концентрація якого електроліту найменша:
а) сульфату натрію; б) хлориду натрію; в) нітрату натрію;
г) хлориду калію; д) нітрату калію?
62. Якщо два розчини з однаковою молярною концентрацією розчинених речовин знаходяться у контакті через напівпроникну мембрану, то в якому випадку відбувається осмос:
а) КСІ / NaCl; б) CaCl2/ BaCl2; в) CaCl2/ KCl; г) KCl/ KNO3?
63. Якщо два розчини з однаковою молярною концентрацією розчинених речовин знаходяться у контакті через напівпроникну мембрану, то в якому випадку відбувається осмос:
а) глюкоза / сахароза; б) сечовина/ глюкоза;
в) сахароза/ фруктоза; г) NaCl/ глюкоза?
64. Якщо два розчини з однаковою молярною концентрацією розчинених речовин знаходяться у контакті через напівпроникну мембрану, то в якому випадку відбувається осмос:
а) сечовина / CaCl2; б) CaCl2 / SrCl2;
в) CaCl2 / BaCl2; г) NaNO3 / KNO3?
65. Рівняння Вант – Гоффа π = с( x ) R Т справедливе для:
а) розбавлених розчинів неелектролітів;
б) розбавлених розчинів електролітів;
в) концентрованих розчинів неелектролітів;
г) концентрованих розчинів електролітів?
66. Рівняння Вант – Гоффа π = і с( x ) R Т справедливе для:
а) розбавлених розчинів неелектролітів;
б) розбавлених розчинів електролітів;
в) концентрованих розчинів неелектролітів?
67. Рівняння Рауля ΔТзам. = Кк b( x ) справедливе для:
а) розбавлених розчинів неелектролітів;
б) розбавлених розчинів електролітів;
в) концентрованих розчинів неелектролітів;
г) концентрованих розчинів електролітів?
68. Рівняння Рауля ΔТзам. = і Кк b( x ) справедливе для:
а) розбавлених розчинів неелектролітів;
б) розбавлених розчинів електролітів;
в) концентрованих розчинів неелектролітів;
г) концентрованих розчинів електролітів?
69. Рівняння Рауля ΔТкип. = Ке b( x ) справедливе для:
а) розбавлених розчинів неелектролітів;
б) розбавлених розчинів електролітів;
в) концентрованих розчинів неелектролітів;
г) концентрованих розчинів електролітів?
70. Рівняння Рауля ΔТкип. = і Ке b( x ) справедливе для:
а) розбавлених розчинів неелектролітів;
б) розбавлених розчинів електролітів;
в) концентрованих розчинів неелектролітів;
г) концентрованих розчинів електролітів?
71. Осмос – це:
а) проникнення тільки молекул розчинника через напівпроникну мембрану;
б) проникнення тільки молекул розчиненої речовини через напівпроникну мембрану;
в) не проникнення ні молекул розчинника ні молекул розчиненої речовини через напівпроникну мембрану;
г) проникнення молекул розчиненої речовини та молекул розчинника через напівпроникну мембрану?
72. Напівпроникна мембрана пропускає:
а) тільки молекули розчиненої речовини;
б) тільки молекули розчинника;
в) молекули розчинника і розчиненої речовини;
г) не пропускає ні молекул розчинника, ні молекул розчиненої речовини?
73. Найбільш вірогідне значення і в рівнянні π = і с( x ) R Т для розчинів електролітів:
а) і < 1; б) і = 1; в) і > 1; г) і > 100?
74. Явище гемолізу еритроцитів відбувається в:
а) гіпертонічному розчині; б) розчинах електролітів;
в) ізотонічному розчині; г) гіпотонічному розчині; д) розчинах неелектролітів?
75. Якщо розчини ізотонічні, то молярна концентрація якого електроліту найменша:
а) калій нітрату; б) натрій нітрату; в)натрій хлориду;
г) калій хлориду; д) кальцій нітрату?
76. Розчини натрій хлориду, калій хлориду, алюміній хлориду, кальцій хлориду, амоній хлориду замерзають при однакових температурах. Моляльність розчину якого електроліту найменша:
а) кальцій хлориду; б) алюміній хлориду; в) калій хлориду;
г) амоній хлориду; д) натрій хлориду?
77. Якщо розчини ізотонічні, то молярна концентрація якого електроліту найменша:
а) натрій нітрату; б) калій нітрату; в) калій хлориду;
г) кальцій хлориду; д) натрій хлориду?
78. Розчини калій сульфату, натрій сульфату, амоній сульфату, кальцій хлориду та калій хлориду мають однакові молярні концентрації. Який із цих розчинів характеризується найменшим осмотичним тиском:
а) кальцій хлориду; б) натрій сульфату; в) калій сульфату;
г) амоній сульфату; д) калій хлориду?
79. Розчини натрій сульфату, літій сульфату, амоній сульфату, калій сульфату, алюміній хлориду замерзають при однакових температурах. Моляльність розчину якого електроліту найменша:
а) амоній сульфату; б) калій сульфату;
в) натрій сульфату; г) літій сульфату; д) алюміній хлориду?
80. Явище плазмолізу еритроцитів крові відбувається в:
а) гіпотонічному розчині; б) ізотонічному розчині;
в) розчинах неелектролітів; г) розчинах електролітів;
д) гіпертонічному розчині?
81. Якщо розчини ізотонічні, то молярна концентрація якого електроліту найменша:
а) натрій нітрату; б) калій нітрату; в) калій хлориду;
г) амоній сульфату; д) натрій хлориду?
82. Розчини натрій нітрату, літій нітрату, амоній нітрату, калій нітрату, кальцій нітрату замерзають при однакових температурах. Моляльність розчину якого із електролітів найменша:
а) амоній нітрату; б) калій нітрату; в) натрій нітрату;
г) літій нітрату; д) кальцій нітрату?
83. Розчини натрій нітрату, літій нітрату, калій нітрату, амоній нітрату та кальцій нітрату мають однакові молярні концентрації . Який із цих розчинів характеризується найбільшим осмотичним тиском:
а) літій нітрату; б) кальцій нітрату; в) калій нітрату;
г) амоній нітрату; д) натрій нітрату?
84. Який розчин натрій хлориду стосовно крові буде ізотонічним:
а) ω(NaCl) = 9%; б) ω(NaCl) = 0,9%;
в) ω(NaCl) = 0,09%; г) ω(NaCl) = 0,009%?
85. Розчини натрій хлориду, літій хлориду, калій хлориду, амоній хлориду та алюміній хлориду мають однакові молярні концентрації. Який із цих розчинів має найбільший осмотичний тиск:
а) калій хлориду; б) амоній хлориду;
в) літій хлориду; г) алюміній хлориду; д) натрій хлориду?
86. Який із розчинів має найбільший осмотичний тиск, якщо масові концентрації розчинених речовин однакові:
а) кальцій хлориду; б) натрій хлориду;
в) калій хлориду; г) амоній хлориду; д) літій хлориду?
87. Одиниці, в яких вимірюють b( x ):
а)
![]() ; б)
%; в)
; б)
%; в)
![]() ; г)
; г)
![]() .
.
88. Значення Кк в рівнянні ΔТзам. = Кк b( x ) для водних розчинів:
а)
1![]() ; б)
1,86
; в) 3
; г) 0,5
.
; б)
1,86
; в) 3
; г) 0,5
.
89. Значення Ке в рівнянні ΔТкип = Ке b( x ) для водних розчинів:
а) 1 ; б) 1,86 ; в) 3 ; г) 0,52 .
90. Одиниці, в яких вимірюють Кк в рівнянні ΔТзам. = Кк b( x ):
а)
; б)
![]() ; в)
; в)
![]() ; г)
; г)
![]() .
.
91. Одиниці, в яких вимірюють Ке в рівнянні ΔТкип = Ке b( x ):
а) ; б) ; в) ; г) .
92. Одиниці, в яких вимірюється R в рівнянні Вант – Гоффа π = с( x ) R Т:
а)
![]() ; б)
; б)
![]() ; в)
; в)
![]() ; г)
; г)
![]() .
.
93. Значення R в рівнянні Вант – Гоффа π = с( x ) R Т:
а) 8,31 ; б) 8,31 · 103 ;в) 8,31 ; г) 8,31 .
94.
Формула π =
![]() R Т для обчислення осмотичного тиску
крові використовується в методі:
R Т для обчислення осмотичного тиску
крові використовується в методі:
а) ебуліометрії; б) кріометрії;
в) кондуктометрії; г) потенціометрії?
95. Вказати, в якому із рівнянь виражена залежність ΔТзам від моляльності розчиненої речовини:
а)
ΔТзам.
= Кк b(
x ); б) ΔТзам.
= Кк
![]() ;
;
в)
ΔТзам.
= Кк
![]() ; г)
ΔТзам.
= Кк
; г)
ΔТзам.
= Кк
![]() .
.
96. Вказати, в якому із рівнянь виражена залежність ΔТзам від маси розчиненої речовини:
а) ΔТзам. = Кк b( x ); б) ΔТзам. = Кк ;
в)
ΔТзам.
= Кк
![]() ; г)
ΔТзам.
= Кк
.
; г)
ΔТзам.
= Кк
.
97. Вказати, в якому із рівнянь виражена залежність ΔТкип від моляльності розчиненої речовини:
а) ΔТкип. = Ке b( x ); б) ΔТкип = Ке ;
в) ΔТкип. = Ке ; г) ΔТкип=. Ке .
98. Вказати, в якому із рівнянь виражена залежність ΔТкип від маси розчиненої речовини:
а) ΔТкип. = Ке b( x ); б) ΔТкип = Ке ;
в) ΔТкип. = Ке ; г) ΔТкип = Ке .
99. Вказати, в якому із рівнянь виражена залежність осмотичного тиску від молярної концентрації розчиненої речовини:
а)
π = с( x ) R Т; б) π =
![]() R Т;
R Т;
в)
π =
![]() R Т; г) π =
R Т; г) π =
![]() R Т.
R Т.
100. Вказати, в якому із рівнянь виражена залежність осмотичного тиску від масової частки розчиненої речовини:
а) π = с( x ) R Т; б) π = R Т;
в) π = R Т; г) π = R Т.
Література до модуля 1
Основна:
1. Медична хімія. (Під ред. Калібабчук В.О.)-Київ. 2005. - 418 с.
2. Мороз А.С., Ковальова А.Г. Фізична та колоїдна хімія. – Львів: “Світ”, 1994. – 279с
3. Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. Общая химия. Биофизическая химия. Химия биогенных элементов. – М. Высшая школа, 2000, – 560с.
4. Зеленин К.Н. Химия. –Санкт-Петербург: “Специальная Литература”, 1997. -688с.
5. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. – М. “Высшая школа”, 1975. – 256с.
Додаткова:
1. Левітін Є.Я., Бризицька А.М., Клюєва Р.Г. Загальна та неорганічна хімія. – Вінниця: Нова книга, 2003. –464с.
2. Глинка Н.Л. Общая химия. - Ленинград: химия, 1984. – 702с.
3. Садовничая Л.П., Хухрянский В.Г., Цыганенко А.Я. Биофизическая химия. – Киев: “Вища школа”, 1986. – 272с.
4. Селезнев К.А. Аналитическая химия. – М., 1973.
Перелік індивідуальних завдань для самостійної роботи студентів до модуля 1.
Підготовка огляду наукової літератури та створення електронних варіантів схем до тем:
Історичний огляд місця хімії в підготовці студентів-медиків.
Місце хімічних наук в підготовці студентів-медиків.
Біологічна роль s- , p-елементів та їх сполук.
Біологічна роль d-елементів та їх сполук.
Застосування в медицині s- , p-елементів та їх сполук.
Застосування в медицині d-елементів та їх сполук.
Токсична дія s- , p-елементів та їх сполук.
Токсична дія d-елементів та їх сполук.
Класифікація комплексних сполук.
Класифікація методів титриметричного аналізу.
Класифікація буферних систем.
Механізм буферної дії.
Буферні системи організму.
Роль осмосу в біологічних системах.
Перелік питань для підготовки студентів до підсумкового модульного контролю модуля 1.
Змістовий модуль 2. Кислотно-основні рівноваги в біологічних рідинах
1. Розчини в життєдіяльності. Ентальпійний та ентропійний фактори розчинення та їх зв’язок з механізмом розчинення.
2. Розчинність газів у рідинах та її залежність від різних факторів. Закон Генрі-Дальтона. Вплив електролітів на розчинність газів. Розчинність газів у крові.
3. Розчинність твердих речовин та рідин. Розподіл речовин між двома рідинами, що не змішуються. Закон розподілу Нернста, його значення у явищі проникності біологічних мембран.
4. Рівновага у розчинах електролітів. Закон розведення Оствальда.
5. Дисоціація води. Іонний добуток води. pH біологічних рідин.
6. Добуток розчинності. Умови утворення та розчинення осадів.
7. Типи протолітичних реакцій. Реакції нейтралізації, гідролізу та іонізації.
8. Гідроліз солей. Ступінь гідролізу, залежність його від концентрації та температури. Константа гідролізу.
9. Основи титриметричного аналізу. Методи кислотно-основного титрування. Кислотно-основні індикатори та принципи їх підбору.
10. Буферні системи та їх класифікація, рН буферних розчинів.
11. Механізм дії буферних систем.
12. Буферна ємність та фактори, від яких вона залежить. Буферні системи крові.
13. Колігативні властивості розбавлених розчинів: зниження температури замерзання, підвищення температури кипіння. Закони Рауля. Кріометрія та ебуліометрія.
14. Колігативна властивість розбавлених розчинів. Осмос. Осмотичний тиск. Закон Вант-Гоффа. Плазмоліз та гемоліз.
15. Колігативні властивості розбавлених розчинів електролітів. Ізотонічний коефіцієнт. Гіпо-, гіпер- та ізотонічні розчини в медичній практиці. Роль осмосу в біологічних системах.
