
- •«Вступ. Основи термодинаміки»
- •Основні поняття термодинаміки.
- •1 Закон термодинаміки.
- •2.1. Залежність теплових ефектів реакцій від температури.
- •2 Закон термодинаміки.
- •Основні поняття термодинаміки
- •Перший закон термодинаміки
- •Залежність теплових ефектів реакцій від температури.
- •Другий закон термодинаміки
- •Тема 6 хімічна кінетика
- •6.1 Загальні положення
- •6.2 Швидкість хімічної реакції
- •6.3 Залежність швидкості реакції від концентрації реагуючих речовин
- •6.4 Енергія активації
- •6.5 Вплив температури на швидкість реакцій
- •6.6 Каталіз
- •6.7 Хімічна рівновага
- •6.8 Зміщення хімічної рівноваги. Принцип Ле Шательє
- •Важливі терміни і поняття
6.3 Залежність швидкості реакції від концентрації реагуючих речовин
Необхідною умовою можливості взаємодії між двома частинками (атомами, молекулами, йонами), є їх взаємне зіткнення, тобто зближення до такої відстані, на якій електрони та атоми однієї частинки потрапляють у сферу дії електричних полів іншої частинки. Тому швидкість гомогенних реакцій залежить від числа зіткнень частинок за одиницю часу.
Число таких зіткнень збільшується пропорційно збільшенню частинок речовини, що містяться в одиниці об’єму, тобто залежить від їх концентрації.
В ході реакції змінюються концентрації і вихідних речовин, і продуктів реакції. Якщо у реагентів однакові стехіометричні коефіцієнти, то зміна їх концентрації в часі (по модулю) теж однакові. Наприклад, для реакції:
СО(г) + Н2О(г) = СО2(г) + Н2(г)
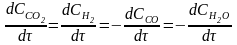
Для реакцій з різними стехіометричними коефіцієнтами швидкості зміни концентрацій будуть різними. Наприклад, для реакції:
СН4(г) + 2Н2О(г) = СО2(г) + 4Н2(г)

Тобто видно, що концентрація Н2О змінюється в 2 рази, а Н2 – в 4 рази швидше, ніж концентрація СН4 і СО2. Отже, якщо в акті реакції учасниками є дві однакові молекули води, то її концентрацію слід ввести в другий ступінь, а концентрацію водню – в четвертий.
Швидкість необоротної реакції:
aA + bB → cC + dD
визначається співвідношенням:
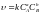
де СА та СВ – концентрації речовин А та В, моль/л; k – коефіцієнт пропорційності; для кожної реакції при постійній температурі він є сталою величиною, яку називають константою швидкості реакції.
Це співвідношення називають кінетичним рівнянням хімічної реакції.
Величина k чисельно дорівнює швидкості реакції за умов, коли концентрації реагуючих речовин чи їх добуток дорівнюють одиниці. Константа швидкості залежить від природи реагуючих речовин і температури. Чим більша константа швидкості, тим більша швидкість перебігу реакції. Математичний вираз швидкості реакції відновлення нітроген (ІІ) оксиду воднем і реакції утворення амоніаку має вигляд:
2NO
+ H2
= N2O
+ H2O, 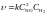
N2
+ 3H2
= 2NH3, 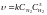
Для гетерогенних реакцій не враховуємо концентрації твердої речовини, тому що інтенсивність взаємодії обумовлена величиною площі поверхні стикання. Концентрація твердої речовини є сталою величиною, яка входить у величину константи швидкості.
CuO(к)
+ H2(г)
= Cu(к)
+ H2O(г), 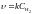
FeO(к)
+ CO(г)
= Fe(к)
+ CO2
(г), 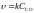
Для реакцій, які протікають у газоподібному стані кінетичне рівняння дає змогу використати при обчисленнях не тільки зміну концентрації речовин, але і зміну величин тиску чи об’єму. При цьому слід врахувати, що зміна тиску прямопропорційна зміні концентрації, а зміна об’єму – оберненопропорційна.
Приклад 1. Напишіть кінетичне рівняння для реакцій:
а) 2NO (г) + Cl2 (г) = 2NOCl (г)
б) CaO (т) + CO2 (г) = CaCO3 (т)
Розв’зок. а) υ = k [NO]2 · [O2],
де [NO] і [O2] – концентрації речовини NO і O2.
б) υ = k [CO2 ]
Кальцій оксид – тверда речовина, концентрація якого не змінюється в ході реакції, тому не входить у кінетичне рівняння.
Приклад 2. Як зміниться швидкість реакції:
2NO(г) + O2(г) = 2NO2(г)
якщо зменшити об’єм реакційної посудини у 3 рази?
Розв’зок. До зміни об’єму швидкість реакції виражалася рівнянням:
υ = k [NO]2 · [O2 ]
внаслідок зменшення об’єму концентрації кожного з реагентів зростуть втричі. Відповідно, тепер:
υ' = k (3[NO])2 · (3[O2]) = 27= k [NO]2 · [O2]
Порівнюючи вирази для υ і υ', знаходимо, що швидкість реакції зросла у 27 разів.
Приклад 3. Як зміниться швидкість реакції А2 + 2В = 2АВ
що відбувається в закритій посудині, якщо збільшити тиск у 6 разів ?
Розв’зок. До зміни об’єму швидкість реакції виражалася рівнянням:
υ1 = k [А2 ] · [В]2
Під час збільшення тиску у 6 разів концентрація кожної з речовин також зростає у 6 разів. У такому випадку:
υ2 = k (6[А2 ]) · (6[В])2 =216 k [А2 ] · [В]2 = 216 υ1
Швидкість реакції зросте у 216 разів.
Для більшості хімічних реакцій сумарне стехіометричне рівняння не відображає дійсного механізму процесу (проміжних стадій), а є загальним виразом для вихідних речовин і продуктів реакції. При цьому показники степенів у законі діючих мас не дорівнюють стехіометричним коефіцієнтам і мають формальний характер.
Розглянемо простий приклад. Фотохімічне розкладання газоподібного НВr відбувається за стехіометричним рівнянням
2НВr (г) = Н2 (г) + Br2 (г).
Відомо, що в механізмі цієї реакції немає стадії взаємодії двох молекул НВr. Насправді зазначена фотохімічна реакція відбувається за таким механізмом:
НВr + hν = H + Br;
H + HBr = H2 + Br;
Вr + Вr = Вr2
Отже, ніякого зв’язку між стехіометрією рівняння і механізмом реакції, як і між стехіометричними коефіцієнтами і показниками степенів у кінетичному рівнянні, взагалі немає. Збіг, який спостерігається для деяких реакцій, має випадковий характер. Перебіг більшості хімічних реакцій такий, що утворення продуктів відбувається через ряд проміжних елементарних стадій (послідовних або паралельних), які можна вважати елементарними реакціями.
Зрозуміло, що швидкість реакції, яка складається з кількох елементарних стадій, зумовлюється швидкістю перебігу повільнішої з них. Сума показників степенів у рівнянні швидкості хімічної реакції (кінетичне рівняння) (6.3) є важливою характеристикою механізму процесу і називається порядком хімічної реакції. Якщо порядок реакції нульовий (швидкість не залежить від концентрації реагуючих речовин), то υ = const.
Швидкість реакції першого порядку описують кінетичним рівнянням
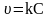
Прикладом реакцій першого порядку є розкладання нітроген(V) оксиду:
N2O5 = 2NO2 + ½O2
Для реакцій другого порядку кінетичне рівняння має вигляд
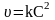 ;
;
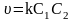
Прикладом реакцій другого порядку є взаємодія водню і йоду за рівнянням
Н2 + І2 = 2НІ
і розкладання нітроген (IV) оксиду :
NO2 + NO2 = 2NO + O2
Реакції третього порядку описуються кінетичними рівняннями
;
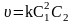 ;
;
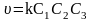
Прикладом таких реакцій є:
2NO + O2 = 2NO2;
2NO + Br2 = 2NOBr.
Порядок реакції, тобто сума показників степенів у кінетичному рівнянні, як правило, може набувати дробових значень.
Для характеристики механізму реакцій застосовують поняття молекулярності реакції. Під молекулярністю реакції розуміють кількість молекул, які беруть участь в елементарному акті взаємодії.
Реакція, для перебігу якої потрібна лише одна молекула, називається мономолекулярною реакцією. Це реакція розкладання або перегрупування, наприклад:
І2 = 2І;
НВr = Н + Вr
N2O5 = 2NO2 + ½ O2
Бімолекулярна реакція потребує для елементарного акту наявності двох частинок (молекул, йонів, атомів):
Н2 + І2 = 2НІ
У тримолекулярних реакціях реагують одночасно три молекули (ці реакції відбуваються дуже рідко):
2NO + O2 = 2NO2
Реакцій, молекулярність яких більша ніж три, не буває, оскільки одночасне зіткнення в одній точці чотирьох і більше молекул малоймовірне. Фактично всі елементарні хімічні реакції є мономолекулярними або бімолекулярними, тобто всі реальні хімічні реакції дуже прості, незважаючи іноді на складність сумарних стехіометричних рівнянь. Отже, сумарна форма рівняння хімічної реакції не відбиває складності і багатостадійності процесу, який може складатися з кількох елементарних реакцій різного порядку.
