
- •«Вступ. Основи термодинаміки»
- •Основні поняття термодинаміки.
- •1 Закон термодинаміки.
- •2.1. Залежність теплових ефектів реакцій від температури.
- •2 Закон термодинаміки.
- •Основні поняття термодинаміки
- •Перший закон термодинаміки
- •Залежність теплових ефектів реакцій від температури.
- •Другий закон термодинаміки
- •Тема 6 хімічна кінетика
- •6.1 Загальні положення
- •6.2 Швидкість хімічної реакції
- •6.3 Залежність швидкості реакції від концентрації реагуючих речовин
- •6.4 Енергія активації
- •6.5 Вплив температури на швидкість реакцій
- •6.6 Каталіз
- •6.7 Хімічна рівновага
- •6.8 Зміщення хімічної рівноваги. Принцип Ле Шательє
- •Важливі терміни і поняття
Залежність теплових ефектів реакцій від температури.
Теплові ефекти хімічних реакцій залежать від температури, при якій вони відбуваються. Причина цього криється в тому, що теплоємності вихідних речовин і продуктів реакції не однакові.
Здебільшого металургійні процеси проводяться не при кімнатній (298 К), а при значно вищих температурах, оскільки реакції окислення-відновлення і розкладу при низьких температурах протікають дуже повільно.
Тому стає задача визначати теплові ефекти реакцій при будь-яких температурах. Це можна зробити за законом Кірхгофа: приріст теплового ефекту при зміні температури на 1 дорівнює різниці між теплоємностями вихідних речовин і продуктів реакції.
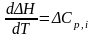 (диференційна
форма)
(диференційна
форма)
∆С – зміна теплоємності продуктів реакції і реагентів
Закон Кірхгофа можна представити рівнянням:
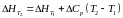
де Ср, - зміна теплоємкості у ході реакції
Другий закон термодинаміки
Як і перший закон термодинаміки, другий закон не може бути виведений теоретично із якихось інших законів, а є узагальненням досвіду всього людства.
Історично другий закон термодинаміки був сформульований раніш за перший. Основні його положення є в роботах М.Ломоносова (1747р.), С.Карно (1824р.), Клаузіуса (1850р.), Томсона (1854р.).
Існують прямі і зворотні теплові цикли. Прямим є двигуни всі, зворотні- холодильники.
Оборотними називаються процеси, які складаються з послідовних рівноважних станів і при протіканні в обох напрямках проходять через одні й ті ж самі проміжні стани. При оборотному процесі система виконує максимальну роботу, вони є найвигідніші і найекономічніші. Тому при конструюванні прагнуть наблизити цикл роботи двигуна до ідеального (цикл Карно), тобто до оборотних процесів.
Формулюється так: тепло не може самочинно переходити від менш нагрітого тіла до більш теплого.
Клаузіус показав, що для ізольованих систем такою функцією може бути ентропія (S).
ККД=
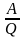 ККД=
ККД=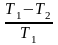
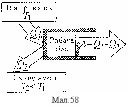 Тепловий
двигун—пристрій
для перетворення внутрішньої енергії
палива в механічну енергію.
Тепловий
двигун—пристрій
для перетворення внутрішньої енергії
палива в механічну енергію.
Кожен тепловий двигун має нагрівник, робоче тіло і охолоджувач (мал.58 ). Нагрівник має температуру Т1 і передає робочому тілу кількість теплоти Q1. Робоче тіло виконує механічну роботу А і віддає охолоджувачеві, що має температуру Т2, кількість теплоти Q2. далі робоче тіло повертається до початкового стану.
Не можна побудувати періодичну діючу машину єдиним результатом дії якої є виконання роботи дії за рахунок одержання теплоти від теплового резервуару.
Коефіцієнт корисної дії теплового двигуна
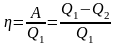 .
.
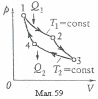 Цикл
Карно
– цикл, який складається з ізотермічних
та адіабатичних процесів (мал.59) У процесі
ізотермічного розширення при температурі
Т1,
робочому тілу (ідеальному газові)
надається кількість теплоти Q1,
а при ізотермічному стисканні при
температурі Т2<Т1
від газу забирається кількість теплоти
Q2.
Термічний коефіцієнт корисної дії циклу
не залежить від природи робочого тіла
й конструкції ідеального теплового
двигуна і дорівнює
Цикл
Карно
– цикл, який складається з ізотермічних
та адіабатичних процесів (мал.59) У процесі
ізотермічного розширення при температурі
Т1,
робочому тілу (ідеальному газові)
надається кількість теплоти Q1,
а при ізотермічному стисканні при
температурі Т2<Т1
від газу забирається кількість теплоти
Q2.
Термічний коефіцієнт корисної дії циклу
не залежить від природи робочого тіла
й конструкції ідеального теплового
двигуна і дорівнює
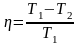
ККД будь-якого реального теплового двигуна, який працює при максимальній температурі T1 і мінімальній температурі T2, не може перевищувати ККД циклу Карно.
ККД ідеальної теплової машини не може дорівнювати одиниці ( за другим законом термодинаміки).
Вічний двигун (2-го роду) — уявна періодично діюча машина, яка б діставала енергію у вигляді теплоти від одного тіла і повністю, передавала її у формі роботи іншому тілу. Вічний двигун нездійсненний, хоч він формально й не суперечить закону збереження енергії. Принцип дії вічного двигуна 2-го роду суперечить другому принципові ( закону) термодинаміки.
Ентропія системи – це така кількість теплоти, яка перетворюється в таку форму, яка ніколи не може перетворитися в роботу.
Міра необоротності процесу в ізольованих системах, міра хаосу, чим вище ентропія, тим більший хаос.
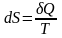
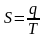
Математичний вираз першого і другого начал термодинаміки можна виразити рівнянням Гіббса-Гемгольца:
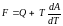
Отже, довільні процеси самочинно відбуваються лише в напрямі зменшення вільної енергії системи. Чим менша вільна енергія, тим більша ентропія, тим стійкіша система.
Домашнє завдання: С. 32-40.
