
- •Фундаментальные закономерности природы
- •Этапы развития естествознания
- •Подготовительный этап.
- •Механистический период.
- •Эволюционный период.
- •Период новейшей эволюции
- •Естественно-научная картина мира
- •Законы сохранения
- •!Метод электронного баланса! (этот метод будет на практическом занятии)
- •Объединенный закон сохранения массы и энергии
- •Периодический закон менделеева и строение атома
- •Современная модель состояния электрона в атоме
- •Электронные конфигурации атомов
- •Периодическая система менделеева
- •Периодические свойства атомов
- •Направление процесса энергетика и направление процесса
- •I закон термодинамики
- •Закон Гесса
- •Кинетика процессов
Современная модель состояния электрона в атоме
Электрон как все микрочастицы имеет двойственную природу, т.е. обладает свойствами и частицы и волны. Поэтому электрон в атоме не имеет траектории движения. Можно говорить лишь о вероятности нахождения электрона в пространстве вокруг ядра. И область пространства вокруг ядра, вероятность обнаружения электрона в которой составляет не менее 90 процентов, называется орбиталью данного электрона.
Существует 4 типа орбиталей: S, P, D, F

 Px Py Pz
Px Py Pz



S-орбиталь P-орбиталь (3 вида)
D-орбиталь – 5 видов
F-орбиталь – 7 видов
Строение электронных оболочек
Установлено, что электроны в атоме располагаются слоями, причем в одном слое находятся электроны, имеющие близкую по значению энергию. Поэтому слои еще называют энергетическими уровнями, или оболочками.
Энергетические уровни нумеруют цифрами от 1 до 7, начиная от ядра, либо обозначают буквами K, L, M, N, O, P, Q.
По
мере удаления от ядра емкость энергетических
уровней возрастает, но максимально
каждый уровень может содержать не более
2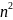 - электронов, где n
– номер уровня
- электронов, где n
– номер уровня
Начиная со 2-го уровня идет расщепление на подуровни. Как определить количество подуровней уровня? Количество подуровней равно номеру уровня, но не превышает 4.
В свою очередь каждый подуровень состоит из орбиталей определенной формы. Наблюдается это расщепление в магнитном поле, и носит название эффекта Зеемана.
|
|
|
|
Подуровень P – 3 орбитали
Подуровень D – 5 орбиталей
Подуровень F – 7 орбиталей
Т акже
атомные спектры обнаруживают расщепление,
связанное со свойством электрона,
называемым спином. Оно отражает
возможность электрона вращаться вокруг
собственной оси по или против часовой
стрелки. Два электрона с противоположными
спинами обозначаются стрелками,
направленными вверх и вниз
акже
атомные спектры обнаруживают расщепление,
связанное со свойством электрона,
называемым спином. Оно отражает
возможность электрона вращаться вокруг
собственной оси по или против часовой
стрелки. Два электрона с противоположными
спинами обозначаются стрелками,
направленными вверх и вниз
Таким образом, положение электрона в атоме определяют четыре характеристики: уровень, подуровень, орбиталь, спин.
Электронные конфигурации атомов
Это условная запись распределения электронов в атоме по уровням, подуровням, и орбиталям. При этом соблюдают следующие правила:
Принцип заполнения – низшие по энергии орбитали заполняются в первую очередь;
Принцип запрета Паули (Паули – венгерский физик) – на любой орбитали может находиться не более двух электронов, причем с разными спинами;
Правило Гунда – заполнение орбиталей одной подоболочки сначала идет одиночными электронами, и только потом возможна достройка орбитали электронами с противоположным спином.
В реальности заполнение электронами оболочек и подоболочек атомов не всегда идет в последовательности от 1-го к 7-му, и подоболочек последовательности S, P, D, F.
31 октября 2013 года
Периодическая система менделеева
В периодической таблице в настоящее время существует 7 горизонтальных рядом, называемых периодами, и 8 вертикальных рядов, называемых группами.
Все элементы периодической системы пронумерованы в соответствие с зарядом ядра атома, и, следовательно номер показывает количество протонов, а поскольку атом электрический нейтрален, значит и количество электронов, содержащихся в атоме.
К аждый
период начинается элементом, в котором
появляется электрон на новом энергетическом
уровне, поэтому номер периода совпадает
с номером внешнего электронного уровня
данного атома.
аждый
период начинается элементом, в котором
появляется электрон на новом энергетическом
уровне, поэтому номер периода совпадает
с номером внешнего электронного уровня
данного атома.

 [Li]
[Li] [He]1
[He]1
Be
1 [Be]
[He]1
[Be]
[He]1
B
1 [B]
[He]1
[B]
[He]1
Все элементы одного периода имеют одинаковые внутренние электронные оболочки, соответствующие структуре инертного газа, завершающего предыдущий период. Эти оболочки называются электронным остовом. Свойства элементов зависят только от внешних электронов, находящихся за пределами электронного остова.
По вертикали в таблице расположены 8 групп. Каждая группа делится на главную и побочную. Побочные группы образованы D-элементами. Номер группы как правило совпадает со значением высшей степени окисления, которую может проявлять атом, вступая во взаимодействие. Т.е. номер группы указывает на число валентных электронов, способных участвовать в образовании связи.




