
- •Фундаментальные закономерности природы
- •Этапы развития естествознания
- •Подготовительный этап.
- •Механистический период.
- •Эволюционный период.
- •Период новейшей эволюции
- •Естественно-научная картина мира
- •Законы сохранения
- •!Метод электронного баланса! (этот метод будет на практическом занятии)
- •Объединенный закон сохранения массы и энергии
- •Периодический закон менделеева и строение атома
- •Современная модель состояния электрона в атоме
- •Электронные конфигурации атомов
- •Периодическая система менделеева
- •Периодические свойства атомов
- •Направление процесса энергетика и направление процесса
- •I закон термодинамики
- •Закон Гесса
- •Кинетика процессов
!Метод электронного баланса! (этот метод будет на практическом занятии)
Этот метод был специально разработан для уравнивания окислительно-восстановительных реакций, которые протекают с переносом зарядов от одних групп атомов к другим.
Он основан на том, что соединение устойчиво, если число электронов, подданных одной группы атомов, равно числу электронов, принятой другой группой атомов.
Определяют формулы исходных веществ и продуктов реакций.
Определяют степени окисления элементов. При этом учитывают, что определенные элементы имеют практически постоянные степени окисления.
а) Н^+, исключения – гидриды металлов Ca^2+H2^-;
б) О^2-; исключения – перекиси H2^+O2^-;
в) элементы первой группы основной подгруппы Li^+, Na^+,K^+, и т.д.;
г) элементы второй группы основной подгруппы Mg^2+; Ca^2+; Sr^2+;
д) простые вещества, состоящие из атомов одного сорта, имеющие степень окисления 0: H2^0; O3^0; Fe^0;
е) в кислотных остатках степень окисления не меняется по сравнению с соответствующей кислотой: (SO4) = H2SO4
(SO3) = H2SO3
(NO2) = HNO2
(NO3) = HNO3
(PO4) = H3PO4
(Cl) = HCl
Определяют количество электронов, отданных восстановителем, и принятых окислителем.
Уравнивают количество отданных и принятых электронов, и определяют коэффициенты перед окислителем и восстановителем.
Подбирают, если необходимо, коэффициенты для других участников реакций.
Cu^0 + H^+N^5+O3^2- = Cu^2+(N^5+O3^2-)2 + N^2+O^2- + H2^+O^2-
Cu^0 -2электрона -> Cu^2+ 3
6
N^5+ + 3электрона -> N^2+ 2
17 октября 2013 года
Объединенный закон сохранения массы и энергии
Иллюстрацией этого закона в макромире является процесс фотосинтеза. Растения используют энергию света и содержащийся в воздухе углекислый газ для разложения воды.



При этом солнечная энергия аккумулируется в виде химической энергии соединения.
Благодаря процессу фотосинтеза идет накопление биомассы. Если бы этот процесс шел только в одном направлении, то количество биомассы давно бы превысило массу земли. Этого не происходит благодаря круговороту веществ. В частности, реакция, обратная процессу фотосинтеза, представляющая собой окисление углеводов, протекает в клетках всех живых организмов.
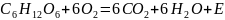
Круговорот вещества и энергии на Земле идет с участием солнечной энергии.
Рассчитаем массу вещества, которое дополнительно ежегодно приносит на Землю солнечный свет. Ежегодно в процессе фотосинтеза растения поглощают
Е=1,6х Дж
Дж
Е=m

Периодический закон менделеева и строение атома
Современная формулировка периодического закона Менделеева:
Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атома, равного порядковому номеру элемента в периодической таблице.
Периодичность свойств элементов определяется повторением строения внешнего электронного уровня элементов.
