
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Основные направления реакционной способности углеводородов в зависимости от их электронного строения
- •Ковалентная связь
- •Циклоалканы
- •Циклопропан с3н6
- •Транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
- •1. Гидрирование:
- •Пропен пропан
- •2. Галогенирование:
- •3. Гидрогалогенирование:
- •6. Полимеризация:
- •Алкадиены Это углеводороды, содержащие две двойные связи. Общая формула Сn h2n-2.
- •1. Гидрирование:
- •2. Гидрогалогенирование:
- •Ароматические углеводороды (арены)
- •Химические свойства
- •1. Галогенирование:
- •2. Нитрование:
- •3.Сульфирование:
- •4. Алкилирование:
- •Тема 2. Спирты. Фенолы. Нафтолы. Тиолы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Кислотность и основность органических соединений
- •Кислоты тон
- •Одноатомные спирты
- •Дегидрирование альдегид
- •Дегидрирование кетон
- •Многоатомные спирты
- •Спирты высшей атомности
- •Свойства фенолов как ароматических соединений. Реакции электрофильного замещения
- •Нафтолы
- •Ароматические спирты
- •Тема 3. Альдегиды и кетоны
- •Пиридоксаль пиридоксальфосфат
- •Этапы занятия и контроль усвоения знаний
- •I. Реакции нуклеофильного присоединения
- •4. Взаимодействие с галогенсодержащими реагентами
- •II. Реакции за счет -сн2-звена
- •Галогенирование:
- •III. Реакции, характерные только для альдегидов
- •Тема 4. Карбоновые кислоты и их функциональные производные
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этановая кислота 2-метилпропановая бутен-3-овая кислота
- •Малеиновая фумаровая кислота
- •Линолевая кислота
- •2. Реакции нуклеофильного замещения (sn ):
- •Двухосновные карбоновые кислоты
- •Трехосновные кислоты
- •Ноос–сн2–с–сн2–соон лимонная 3-гидрокси – 3-карбокси -
- •Специфические реакции двухосновных кислот
- •Тема 5. Липиды
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Омыляемые липиды
- •Омыляемые липиды
- •Жирные кислоты
- •Простые омыляемые липиды
- •Сложные омыляемые липиды
- •Ф осфолипиды
- •Глицерофосфо- сфингофосфо-
- •Гликолипиды
- •Цереброзиды ганглиозиды
- •Цереброзиды
- •Ганглиозиды
- •Неомыляемые липиды
- •Стероиды
- •Классификация стероидов
- •Эстрадиол
- •Тема 6. Соединения со смешанными функциями
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Оксокислоты
- •2. Кето-енольная таутомерия -оксокислот.
- •Оксокислоты
- •Стереоизомерия
- •(Оптические,
- •Энантиомеры
- •Тема 7. Аминокислоты.
- •III. Биологически важные реакции - аминокислот
- •Тема 8. Углеводы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Тема 8-1. Углеводы. Моносахариды Теория
- •Стереоизомерия моносахаридов
- •Важнейшие природные моносахариды а льдопентозы
- •Альдогексозы Кетогексоза
- •Цикло-цепные таутомеры моносахаридов
- •Перспективные формулы Хеуорса
- •Цикло-цепная таутомерия моносахаридов – это существование в водном растворе смеси таутомерных форм, способных превращаться друг в друга через открытую таутомерную форму:
- •3. Мутаротация сахаров При растворении кристаллической таутомерной формы углевода в воде наблюдается явление мутаротации.
- •4. Конформации моносахаридов
- •5. Эпимеризация
- •6. Химические свойства моносахаридов
- •Реакции, характерные для цепной формы углеводов
- •Кислоты
- •Реакции циклических таутомерных форм моносахаридов
- •Тема 8-2. Ди – и полисахариды
- •Дисахариды
- •Цикло-цепная таутомерия дисахаридов
- •Реакция «серебряного зеркала»:
- •Полисахариды
- •Тема 9. Гетероциклические соединения
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятий и контроль усвоения знаний
- •Содержание этапов занятия
- •Электронное строение «пиррольного» атома азота
- •Шестичленные гетероциклические системы с одним гетероатомом
- •Электронное строение «пиридинового» атома азота
- •Химические свойства
- •Пятичленные гетероциклы с двумя гетероатомами
- •Химические свойства
- •Шестичленные гетероциклические соединения с двумя гетероатомами п иримидин
- •Производные пиримидина
- •Полициклические гетероциклы
- •Триптофан
- •Хинолин и изохинолин
- •Нуклеиновые кислоты
- •Общая схема построения нуклеиновых кислот
- •Нуклеиновые кислоты
- •Нуклеотиды
- •Методические разработки по биоорганической химии
- •Методические разработки по биоорганической химии Санкт-Петербург
Тема 9. Гетероциклические соединения
Цель занятия: сформировать знания электронного строения и химических свойств гетероциклических соединений, играющих важную роль в биологической химии и медицине, составляющих основу метаболитов и лекарственных веществ.
Конкретные задачи
1. Студент должен знать: строение гетероциклических соединений – пиррола, фурана, тиофена, имидазола, пиразола, пиридина, пиримидина и пурина; электронное строение пиррольного и пиридинового атома азота; ароматичность и критерии ароматичности; реакции электрофильного замещения в гетероциклических ароматических системах; проявление кислотности и основности гетероциклических соединений.
2. Студент должен уметь: писать формулы пяти- и шестичленных гетероциклических соединений с одним или двумя гетероатомами, доказывать их ароматичность; писать уравнения реакций, показывающих их основные, кислотные и ароматические свойства; писать формулы пиримидиновых и пуриновых оснований в лактимной и лактамной формах; составлять структуры нуклеозидов, нуклеотидов, фрагментов первичной структуры нуклеиновых кислот.
Мотивация. Гетероциклические соединения широко распространены в природе и играют важную биологическую роль. Они входят в состав нуклеиновых кислот (пурин, пиримидин), пигментов растений и животных (пиррол), гормонов (индол), витаминов (пиррол, тиофен, пиридин), аминокислот (индол, имидазол, пирролидин), алкалоидов (пиридин, пиперидин); лекарственных препаратов (имидазол, хинолин, индол, пиразолон, пиридин), красителей (-оксииндол).
Вопросы для самоподготовки
1. Напишите структурные формулы 2.5-диметилфурана, 2-аминопиридина, 3-оксииндола, 2,6-диоксипиримидина; 2,6,8-триоксипурина.
2. Получите из пиридина никотиновую кислоту. Напишите уравнение реакции ее с NH3.
3. Почему мочевая кислота проявляет кислотные свойства?
4. Напишите формулы пиримидиновых и пуриновых оснований, входящих в состав нуклеиновых кислот.
Этапы занятий и контроль усвоения знаний
Этапы занятия |
Формы проведения этапа |
Время, мин |
1. Проверка выполнения домашнего задания. |
Проверка преподавателем выполнения домашнего задания в рабочей тетради. |
15 |
2. Контроль самоподготовки. |
Тест-контроль по теме занятия и оценка его результатов (0, 5, 10 баллов) |
15 |
3. Разбор теоретического материала. |
Устный опрос студентов у доски, объяснение наиболее трудных вопросов преподавателем. |
150 |
Содержание этапов занятия
1-й этап. Преподаватель проверяет наличие выполненного домашнего задания в рабочих тетрадях и оценивает его по пятибалльной системе.
2-й этап. Студент письменно отвечает на билет программированного контроля. Ответ оценивается по принятой балльной системе (0, 5, 10 баллов).
3-й этап. На 1 занятии по теме «Гетероциклические соединения» студенты учатся писать формулы пяти- и шестичленных гетероциклов с одним гетероатомом. Разбирают электронное строение «пиррольного» и «пиридинового» атомов азота, рассматривают свойства, характерные для этих соединений: ароматичность, кислотно-основные, нуклеофильные.
На 2 занятии рассматриваются пяти- и шестичленные гетероциклические соединения с двумя гетероатомами: имидазол, пиразол, пиримидин, окси- и аминопрозводные пиримидина – урацил, тимин, цитозин в лактимной и лактамной формах; конденсированные гетероциклические соединения: индол, пурин, окси- и аминопроизводные пурина – аденин, гуанин, мочевая кислота в лактимной и лактамной форме; разбирается строение нуклеозидов, нуклеотидов, фрагментов полинуклеотидной цепи.
Теория
Пятичленные гетероциклические соединения с одним гетероатомом:
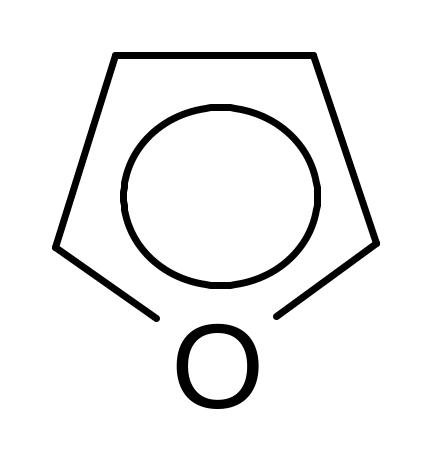
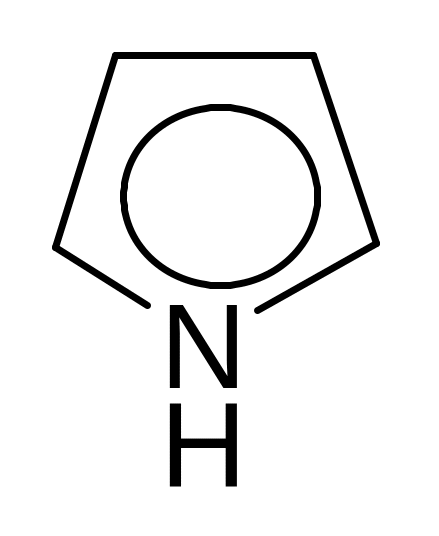

фуран пиррол тиофен
Все эти соединения являются ароматическими, так как отвечают критериям ароматичности:
S2 – гибридизованные атомы пиррола, фурана, тиофена образуют плоский - скелет;
количество - электронов удовлетворяет формуле Хюккеля (4n+2).
4 Электрона поставляют атомы углерода и 2 - электрона – гетероатомы N, O или S. Образуется - электронный секстет;
6 - электронов образуют единое сопряженное облако, делокализованное по всему кольцу.
Общей чертой ароматических гетероциклов и производных бензола является высокая термодинамическая устойчивость.
Отличие от бензола:
6 Электронов распределяются по пяти-центровой системе, поэтому такие системы называются суперароматическими, или - избыточными; реакции электрофильного замещения идут легче, чем в бензоле.
Из-за влияния гетероатома электронная плотность увеличена в -положениях кольца (2 и 5), поэтому атака электрофильного реагента происходит предпочтительно в эти положения.
Энергия сопряжения у пятичленных гетероциклических соединений меньше, чем у бензола (22-28 ккал/моль, а у бензола– 36 ккал/моль).
Поэтому легче идут реакции с раскрытием кольца. Например, реакции восстановления.
