
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Основные направления реакционной способности углеводородов в зависимости от их электронного строения
- •Ковалентная связь
- •Циклоалканы
- •Циклопропан с3н6
- •Транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
- •1. Гидрирование:
- •Пропен пропан
- •2. Галогенирование:
- •3. Гидрогалогенирование:
- •6. Полимеризация:
- •Алкадиены Это углеводороды, содержащие две двойные связи. Общая формула Сn h2n-2.
- •1. Гидрирование:
- •2. Гидрогалогенирование:
- •Ароматические углеводороды (арены)
- •Химические свойства
- •1. Галогенирование:
- •2. Нитрование:
- •3.Сульфирование:
- •4. Алкилирование:
- •Тема 2. Спирты. Фенолы. Нафтолы. Тиолы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Кислотность и основность органических соединений
- •Кислоты тон
- •Одноатомные спирты
- •Дегидрирование альдегид
- •Дегидрирование кетон
- •Многоатомные спирты
- •Спирты высшей атомности
- •Свойства фенолов как ароматических соединений. Реакции электрофильного замещения
- •Нафтолы
- •Ароматические спирты
- •Тема 3. Альдегиды и кетоны
- •Пиридоксаль пиридоксальфосфат
- •Этапы занятия и контроль усвоения знаний
- •I. Реакции нуклеофильного присоединения
- •4. Взаимодействие с галогенсодержащими реагентами
- •II. Реакции за счет -сн2-звена
- •Галогенирование:
- •III. Реакции, характерные только для альдегидов
- •Тема 4. Карбоновые кислоты и их функциональные производные
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этановая кислота 2-метилпропановая бутен-3-овая кислота
- •Малеиновая фумаровая кислота
- •Линолевая кислота
- •2. Реакции нуклеофильного замещения (sn ):
- •Двухосновные карбоновые кислоты
- •Трехосновные кислоты
- •Ноос–сн2–с–сн2–соон лимонная 3-гидрокси – 3-карбокси -
- •Специфические реакции двухосновных кислот
- •Тема 5. Липиды
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Омыляемые липиды
- •Омыляемые липиды
- •Жирные кислоты
- •Простые омыляемые липиды
- •Сложные омыляемые липиды
- •Ф осфолипиды
- •Глицерофосфо- сфингофосфо-
- •Гликолипиды
- •Цереброзиды ганглиозиды
- •Цереброзиды
- •Ганглиозиды
- •Неомыляемые липиды
- •Стероиды
- •Классификация стероидов
- •Эстрадиол
- •Тема 6. Соединения со смешанными функциями
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Оксокислоты
- •2. Кето-енольная таутомерия -оксокислот.
- •Оксокислоты
- •Стереоизомерия
- •(Оптические,
- •Энантиомеры
- •Тема 7. Аминокислоты.
- •III. Биологически важные реакции - аминокислот
- •Тема 8. Углеводы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Тема 8-1. Углеводы. Моносахариды Теория
- •Стереоизомерия моносахаридов
- •Важнейшие природные моносахариды а льдопентозы
- •Альдогексозы Кетогексоза
- •Цикло-цепные таутомеры моносахаридов
- •Перспективные формулы Хеуорса
- •Цикло-цепная таутомерия моносахаридов – это существование в водном растворе смеси таутомерных форм, способных превращаться друг в друга через открытую таутомерную форму:
- •3. Мутаротация сахаров При растворении кристаллической таутомерной формы углевода в воде наблюдается явление мутаротации.
- •4. Конформации моносахаридов
- •5. Эпимеризация
- •6. Химические свойства моносахаридов
- •Реакции, характерные для цепной формы углеводов
- •Кислоты
- •Реакции циклических таутомерных форм моносахаридов
- •Тема 8-2. Ди – и полисахариды
- •Дисахариды
- •Цикло-цепная таутомерия дисахаридов
- •Реакция «серебряного зеркала»:
- •Полисахариды
- •Тема 9. Гетероциклические соединения
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятий и контроль усвоения знаний
- •Содержание этапов занятия
- •Электронное строение «пиррольного» атома азота
- •Шестичленные гетероциклические системы с одним гетероатомом
- •Электронное строение «пиридинового» атома азота
- •Химические свойства
- •Пятичленные гетероциклы с двумя гетероатомами
- •Химические свойства
- •Шестичленные гетероциклические соединения с двумя гетероатомами п иримидин
- •Производные пиримидина
- •Полициклические гетероциклы
- •Триптофан
- •Хинолин и изохинолин
- •Нуклеиновые кислоты
- •Общая схема построения нуклеиновых кислот
- •Нуклеиновые кислоты
- •Нуклеотиды
- •Методические разработки по биоорганической химии
- •Методические разработки по биоорганической химии Санкт-Петербург
Цикло-цепные таутомеры моносахаридов
По мере изучения свойств моносахаридов выяснилось, что открытые (цепные) формулы не описывают полностью химическое поведение сахаров. Например, несмотря на наличие в молекуле глюкозы пяти ОН – групп, только одна из них вступает в реакцию со спиртами в присутствии сухого хлористого водорода с образованием гликозидов. Для объяснения подобных противоречий было высказано предположение (1870 г. А. Колли; 1883 г. Б. Толленс), что истинное строение моноз не описывается лишь открытой (цепной) формулой. Моносахариды образуют в водном растворе таутомерные смеси открытых и циклических форм. В основе их образования лежит внутримолекулярная реакция нуклеофильного присоединения спиртовых групп к альдегидной или кетонной группе:

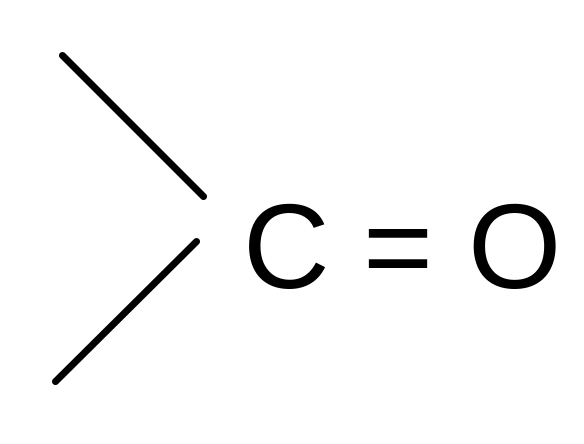 H+
полуацетальный,
H+
полуацетальный,
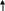
 + HOR
или гликозидный
+ HOR
или гликозидный
 гидроксил
гидроксил

полуацеталь
Т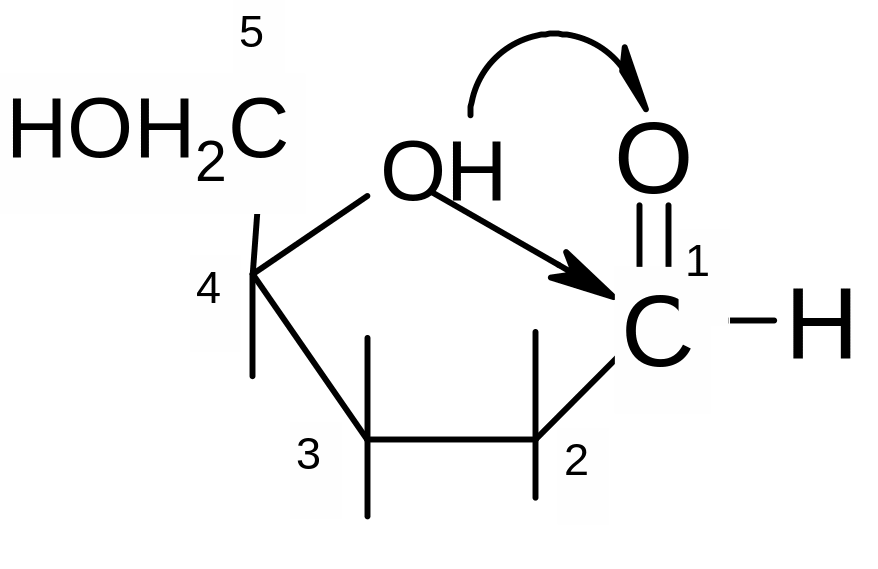 акая
реакция обеспечивается наличием
клешневидной конформации углеродной
цепи углевода:
акая
реакция обеспечивается наличием
клешневидной конформации углеродной
цепи углевода:
В 1925–30 гг. У. Хеуорс экспериментально определил размер возможных циклических таутомеров. Он предложил называть пятичленные циклы углеводов фуранозами, а шестичленные – пиранозами как производные фурана и пирана, соответственно:
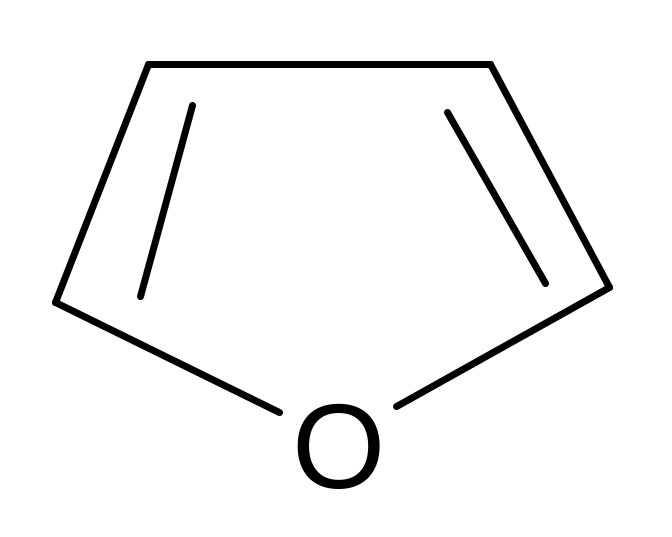
фуран пиран
Пример. Изобразите цикло-цепные таутомеры D-рибозы по Фишеру и Хеуорсу.
Пиранозные формы рибозы образуются путем взаимодействия гидроксильной группы при С5 рибозы с альдегидной группой:
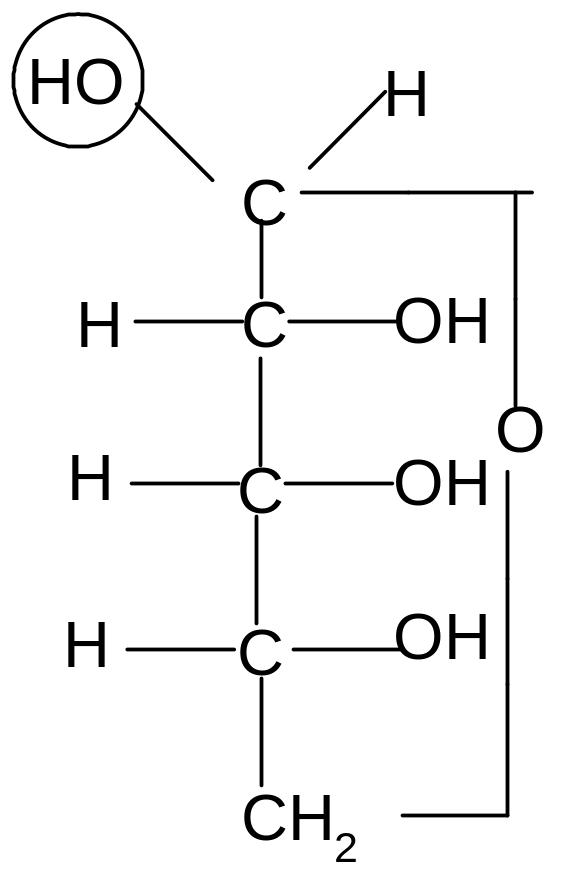
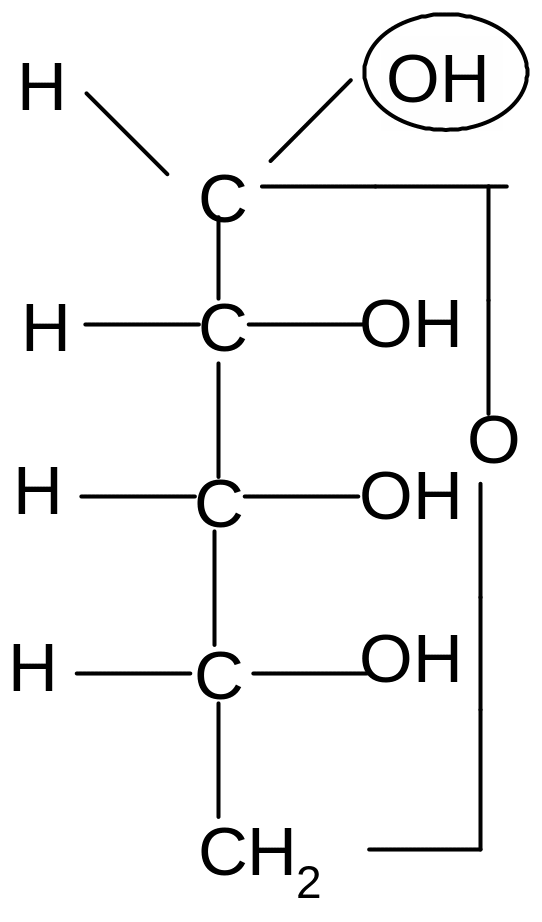
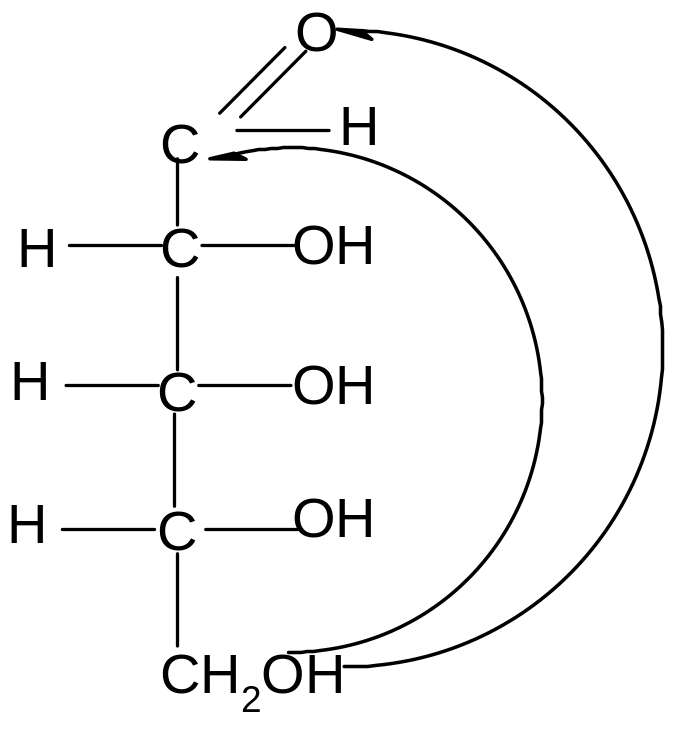
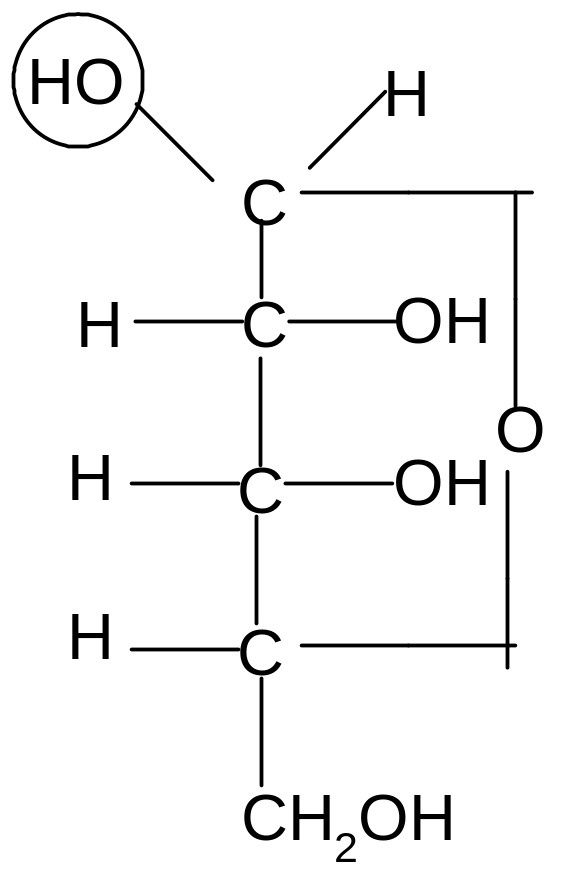
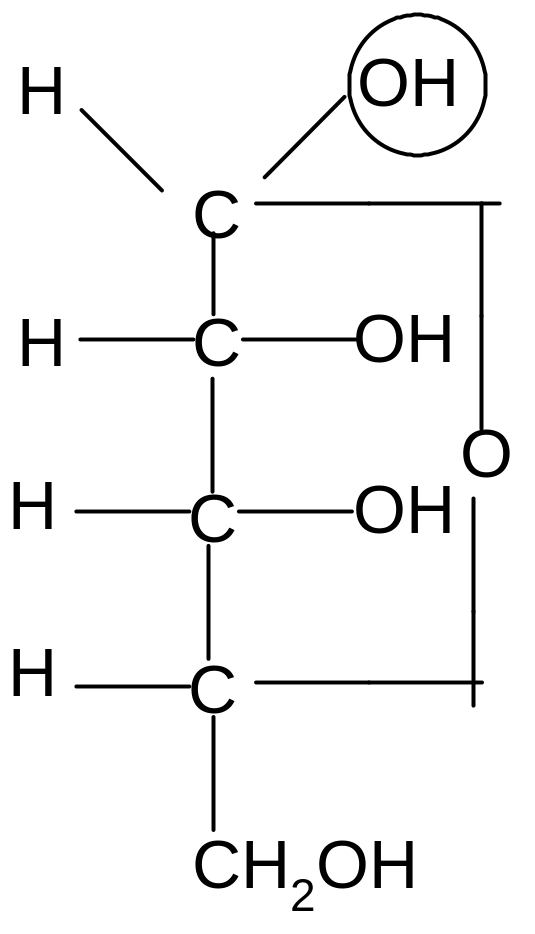
,D–рибопираноза D–рибоза ,D–рибопираноза
Образование циклической полуацетальной формы приводит к появлению нового хирального центра у первого атома углерода, в результате при такой циклизации получаются два диастереомера, которые отличаются конфигурацией только С1 атома и называются - и -аномерами. В - форме полуацетальный (гликозидный) гидроксил справа от углеродной цепи молекулы; он расположен с той же стороны, что и гидроксил, определяющий принадлежность углевода к D-ряду. В - форме эта группа с противоположной стороны, слева.
Аналогично, только с участием гидроксила при атоме С4, происходит образование фуранозных форм:
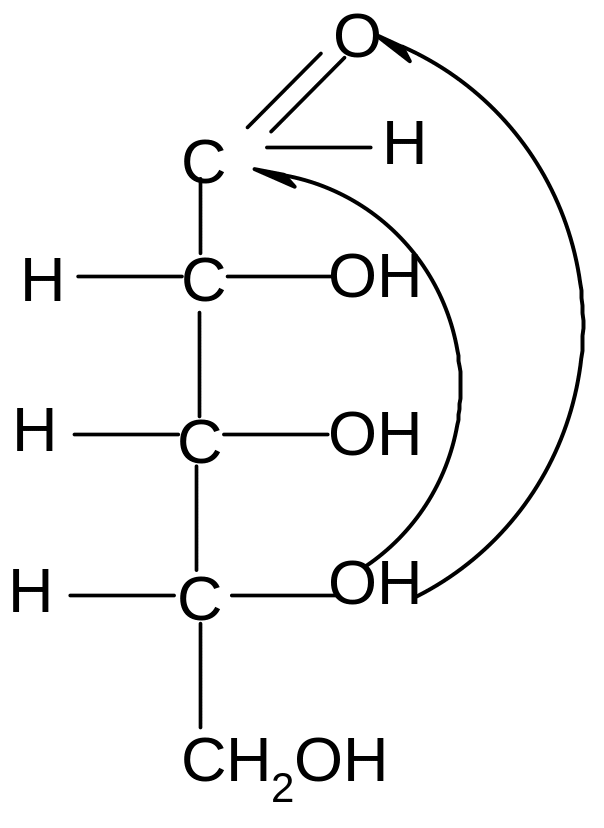
,D–рибофураноза D–рибоза ,D–рибофураноза
Перспективные формулы Хеуорса
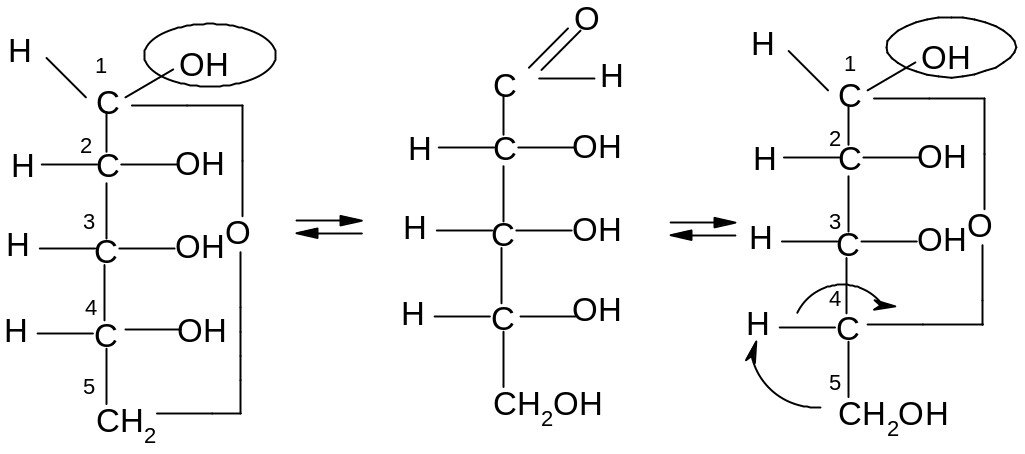
Недостатком проекционных формул Фишера является их несоответствие истинной геометрии молекулы. Поэтому для циклических таутомеров были введены формулы Хеуорса, которые строятся по следующим правилам:
1. Написать формулу Фишера для цепной формы углевода.
2. Написать формулу для циклической таутомерной формы и пронумеровать атомы углерода в ней.
 ,D–рибопираноза
D–рибоза
,D–рибофураноза
,D–рибопираноза
D–рибоза
,D–рибофураноза
(циклическая форма) (открытая форма) (циклическая форма)
Н
 арисовать
необходимый цикл (5- или 6-членный) с
атомом кислорода в правом верхнем углу
и пронумеровать атомы углерода, связанные
с кислородом, по часовой стрелке (см.
рисунок)
арисовать
необходимый цикл (5- или 6-членный) с
атомом кислорода в правом верхнем углу
и пронумеровать атомы углерода, связанные
с кислородом, по часовой стрелке (см.
рисунок)
4. Заместители, стоящие справа от цепи в проекции Фишера, располагают снизу от плоскости цикла, а стоящие слева – сверху.
И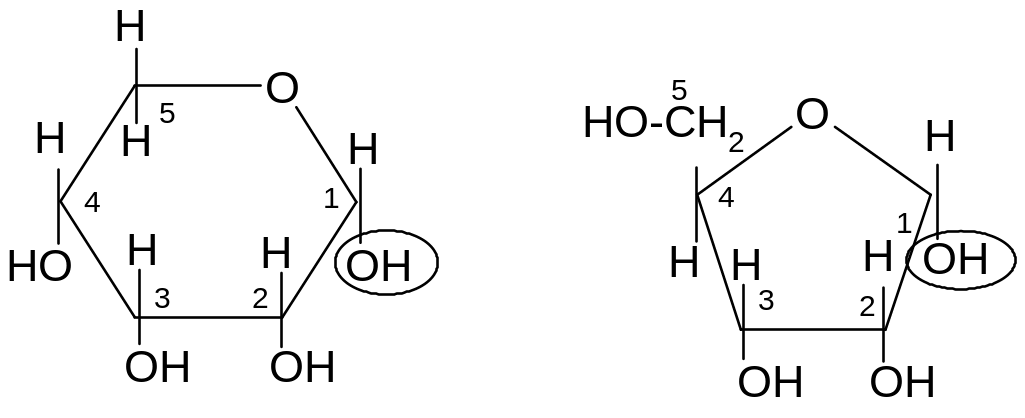 сключение
составляют заместители у того углеродного
атома, при котором происходит циклизация.
У такого атома углерода необходимо
делать циклическую перестановку
заместителей (см. рисунок).
сключение
составляют заместители у того углеродного
атома, при котором происходит циклизация.
У такого атома углерода необходимо
делать циклическую перестановку
заместителей (см. рисунок).
,D –рибопираноза по Хеуорсу , D–рибофураноза по Хеуорсу
