
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Основные направления реакционной способности углеводородов в зависимости от их электронного строения
- •Ковалентная связь
- •Циклоалканы
- •Циклопропан с3н6
- •Транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
- •1. Гидрирование:
- •Пропен пропан
- •2. Галогенирование:
- •3. Гидрогалогенирование:
- •6. Полимеризация:
- •Алкадиены Это углеводороды, содержащие две двойные связи. Общая формула Сn h2n-2.
- •1. Гидрирование:
- •2. Гидрогалогенирование:
- •Ароматические углеводороды (арены)
- •Химические свойства
- •1. Галогенирование:
- •2. Нитрование:
- •3.Сульфирование:
- •4. Алкилирование:
- •Тема 2. Спирты. Фенолы. Нафтолы. Тиолы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Кислотность и основность органических соединений
- •Кислоты тон
- •Одноатомные спирты
- •Дегидрирование альдегид
- •Дегидрирование кетон
- •Многоатомные спирты
- •Спирты высшей атомности
- •Свойства фенолов как ароматических соединений. Реакции электрофильного замещения
- •Нафтолы
- •Ароматические спирты
- •Тема 3. Альдегиды и кетоны
- •Пиридоксаль пиридоксальфосфат
- •Этапы занятия и контроль усвоения знаний
- •I. Реакции нуклеофильного присоединения
- •4. Взаимодействие с галогенсодержащими реагентами
- •II. Реакции за счет -сн2-звена
- •Галогенирование:
- •III. Реакции, характерные только для альдегидов
- •Тема 4. Карбоновые кислоты и их функциональные производные
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этановая кислота 2-метилпропановая бутен-3-овая кислота
- •Малеиновая фумаровая кислота
- •Линолевая кислота
- •2. Реакции нуклеофильного замещения (sn ):
- •Двухосновные карбоновые кислоты
- •Трехосновные кислоты
- •Ноос–сн2–с–сн2–соон лимонная 3-гидрокси – 3-карбокси -
- •Специфические реакции двухосновных кислот
- •Тема 5. Липиды
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Омыляемые липиды
- •Омыляемые липиды
- •Жирные кислоты
- •Простые омыляемые липиды
- •Сложные омыляемые липиды
- •Ф осфолипиды
- •Глицерофосфо- сфингофосфо-
- •Гликолипиды
- •Цереброзиды ганглиозиды
- •Цереброзиды
- •Ганглиозиды
- •Неомыляемые липиды
- •Стероиды
- •Классификация стероидов
- •Эстрадиол
- •Тема 6. Соединения со смешанными функциями
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Оксокислоты
- •2. Кето-енольная таутомерия -оксокислот.
- •Оксокислоты
- •Стереоизомерия
- •(Оптические,
- •Энантиомеры
- •Тема 7. Аминокислоты.
- •III. Биологически важные реакции - аминокислот
- •Тема 8. Углеводы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Тема 8-1. Углеводы. Моносахариды Теория
- •Стереоизомерия моносахаридов
- •Важнейшие природные моносахариды а льдопентозы
- •Альдогексозы Кетогексоза
- •Цикло-цепные таутомеры моносахаридов
- •Перспективные формулы Хеуорса
- •Цикло-цепная таутомерия моносахаридов – это существование в водном растворе смеси таутомерных форм, способных превращаться друг в друга через открытую таутомерную форму:
- •3. Мутаротация сахаров При растворении кристаллической таутомерной формы углевода в воде наблюдается явление мутаротации.
- •4. Конформации моносахаридов
- •5. Эпимеризация
- •6. Химические свойства моносахаридов
- •Реакции, характерные для цепной формы углеводов
- •Кислоты
- •Реакции циклических таутомерных форм моносахаридов
- •Тема 8-2. Ди – и полисахариды
- •Дисахариды
- •Цикло-цепная таутомерия дисахаридов
- •Реакция «серебряного зеркала»:
- •Полисахариды
- •Тема 9. Гетероциклические соединения
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятий и контроль усвоения знаний
- •Содержание этапов занятия
- •Электронное строение «пиррольного» атома азота
- •Шестичленные гетероциклические системы с одним гетероатомом
- •Электронное строение «пиридинового» атома азота
- •Химические свойства
- •Пятичленные гетероциклы с двумя гетероатомами
- •Химические свойства
- •Шестичленные гетероциклические соединения с двумя гетероатомами п иримидин
- •Производные пиримидина
- •Полициклические гетероциклы
- •Триптофан
- •Хинолин и изохинолин
- •Нуклеиновые кислоты
- •Общая схема построения нуклеиновых кислот
- •Нуклеиновые кислоты
- •Нуклеотиды
- •Методические разработки по биоорганической химии
- •Методические разработки по биоорганической химии Санкт-Петербург
Тема 7. Аминокислоты.
пептиды. Первичная структура белков
Цель занятия: сформировать представление о стереохимии и реакционной способности аминокислот на основе их строения; научиться составлять первичную структуру пептидов и характеризовать их физико-химические свойства в зависимости от аминокислотного состава.
Конкретные задачи
1. Студент должен знать: основы стереохимии -аминокислот; структурные формулы и тривиальные названия 20 протеиногенных аминокислот; классификацию аминокислот на основе физико-химических свойств их радикалов; общие и специфические свойства - аминокислот.
2. Студент должен уметь: определять стереохимический ряд аминокислот, писать формулы Фишера для энантиомеров L- и D– ряда; составлять ди-, три-, тетрапептиды и фрагменты первичной структуры белков; изображать пространственное и электронное строение пептидной связи; давать физико-химическую характеристику пептидов на основе свойств радикалов аминокислот, входящих в их состав.
Мотивация. Знание темы необходимо для изучения в курсе биохимии промежуточного обмена аминокислот, структурной организации белковых молекул, а также для понимания взаимосвязи структуры, физико-химических свойств и биологических функций белков.
Вопросы для самоподготовки
1. Напишите общую формулу -аминокислот.
2. Объясните, почему -аминокислоты обладают оптической активностью. Напишите проекционные формулы L- и D–аланина.
3. Дайте классификацию -аминокислот на основе физико-химических свойств их радикалов. Выучите формулы 20 -аминокислот.
4. Опишите химические свойства -аминокислот. Амфотерность, изоэлектрическая точка аминокислот на примере аланина, лизина, глутаминовой кислоты; реакции аминокислот с азотистой кислотой и формальдегидом; реакции декарбоксилирования на примере гистидина, триптофана, глутаминовой кислоты; способность к образованию комплексных солей с катионами Cu2+.
5. Напишите схему образования трипептида: Лиз–Ала–Сер. Охарактеризуйте его свойства.
Этапы занятия и контроль усвоения знаний
Продолжительность занятия – 4 часа.
-
Этапы занятия
Форма проведения этапа
Время
1. Проверка домашнего задания.
Проверка преподавателем домашнего задания в рабочих тетрадях.
15 мин
2. Контроль исходных знаний студентов.
Тест-контроль по теме занятия и оценка его результатов (0, 5, 10 баллов).
15 мин
3. Разбор теоретического материала по теме занятия.
Устный опрос студентов у доски с коррекцией их ответов преподавателем. Объяснение ключевых вопросов темы.
90 мин.
4. Приобретение практических навыков.
Выполнение студентами лабораторных работ по теме.
30 мин.
5. Оформление протоколов лабораторных работ.
Оформление графы “Визуальные наблюдения” протоколов лабораторных работ в рабочих тетрадях. Анализ полученных данных; выводы из проделанных работ.
15 мин.
6. Проверка и защита протоколов лабораторных работ.
Проверка преподавателем протоколов, устный опрос по полученным результатам, оценка практических навыков.
15 мин.
Содержание этапов занятия
1-ый этап. Проверка преподавателем письменного выполнения домашнего задания по теме занятия и оценка его.
2-ой этап. Написание тест-контроля по предложенным билетам и оценка его результатов (0, 5, 10 баллов).
3-й этап. Устный опрос у доски. Написание общей формулы -аминокислот. Обсуждение их физико-химических свойств (оптическая активность и оптическая изомерия, классификация на основе растворимости в воде боковых радикалов, заряд, изоэлектрическая точка). Рассмотрение основных биологически важных химических свойств -аминокислот (амфотерность, способность к образованию биполярных ионов и комплексных солей, декарбоксилирование, пути дезаминирования, образование пептидов). Составление пептидов и характеристика их свойств. Рассмотрение электронного и пространственного строения пептидной связи, значения ее транс-конфигурации для образования вторичной структуры белка.
4-й этап. Самостоятельное изучение студентами принципа метода и этапов выполнения лабораторных работ. Выполнение лабораторных работ по теме.
5-й этап. Оформление протоколов в виде таблицы, данной в рабочих тетрадях.
6-й этап. Проверка преподавателем написания уравнений проделанных реакций, наблюдений, выводов. Обсуждение практической значимости каждой работы, оценка практических навыков, приобретенных студентами.
Теория
Аминокислотами называются органические соединения, содержащие
карбоксильную и аминогруппу: (NH2)m-R –(COOH)n
Классификация:
1) по количеству СООН- и NH2-групп аминокислоты делятся на моноаминокарбоновые, диаминокарбоновые, моноаминоди-карбоновые и т.д.
2) по взаимному расположению двух функциональных групп: , , - и т.д. аминокислоты.
Изомерия:
1) по строению углеродного скелета;
2) по взаимному положению амино- и карбоксильной групп;
3) оптическая (стерео) изомерия.
Например:
Формула |
Название |
Биологическая роль |
NH2-CH-COOH* СН3 |
-Аланин (-аминопро- пионовая кислота) |
Входит в состав пеп- тидов, белков |
H2N-CH2-CH2-COOH |
-Аланин (-аминопро- пионовая кислота) |
Входит в состав пантотеновой кислоты (витамина В3) |
H2N-CH2-CH2- СН2–COOH |
-Аминомасляная кислота (ГАМК) |
Природный транкви- лизатор |
Примечание: * – оптически активна
С биологической точки зрения огромное значение имеют - аминокислоты. Это «кирпичики», из которых построены молекулы белка –протеиногенные аминокислоты. Им будет уделено основное внимание.
Классификация - аминокислот. Общая структурная формула протеиногенных аминокислот:
-
H2N-CH-COOH
R
Различаются они только боковыми цепями (R-группами), которые у разных аминокислот неодинаковы по структуре, суммарному заряду (полярности) и растворимости в воде (гидрофильности или гидрофобности).
Поэтому целесообразно классифицировать протеиногенные кислоты на основе физико-химических свойств их R- групп.
I. Аминокислоты с неполярными (гидрофобными) R-группами (8):
1. Аланин (Ала): 2. Валин (Вал):
 NH2-CH-COOH
NH2-CH-COOH
NH2-CH-COOH
NH2-CH-COOH



CH3 CH3-CH
CH3
3. Изолейцин (Иле) 4. Лейцин (Лей)
NH2-CH-COOH NH2-CH-COOH
 |
|
|
|
 СH-CH3
CH2
СH-CH3
CH2
CH2 CH-CH3
CH3 CH3
5. Метионин (Мет) 6. Фенилаланин (Фен)

NH2-CH-COOH




(СН2)2
S
CH3
7. Триптофан (Три) 8. Пролин (Про)






II. Аминокислоты с полярными (гидрофильными) незаряженными радикалами (7):
1. Глицин (Гли): Не содержит радикала (R=H).
NH2-CH2-COOH
НО-содержащие аминокислоты:
2. Серин (Сер): 3. Треонин (Тре): 4. Тирозин (Тир):
NH2-CH-COOH
NH2-CH-COOH
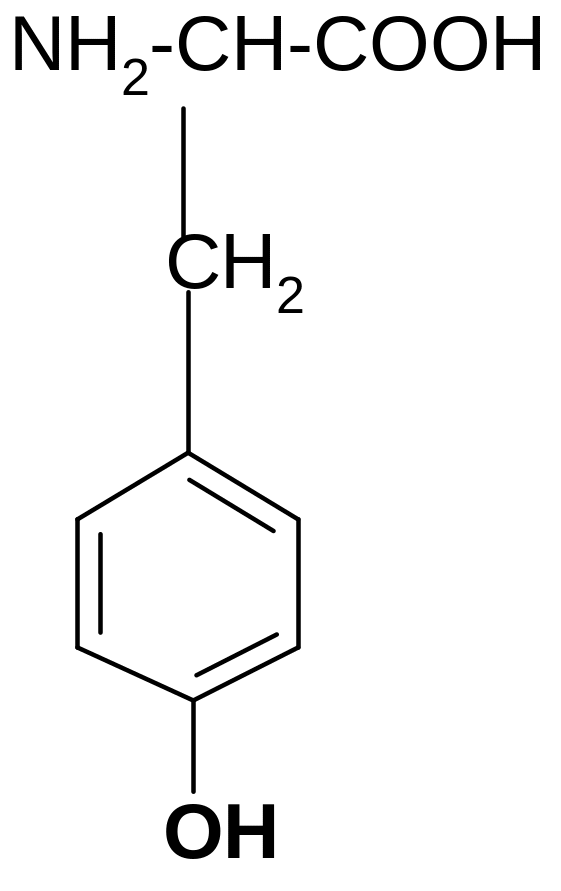
CH2 CH-CH3
OH OH
SH-содержащие аминокислоты:
5. NH2-CH-COOH
CH2
SH
цистеин (Цис)
Cледует отметить, что спиртовые и фенольные ОН-группы и тиоловая SH-группа проявляют в воде очень слабую кислотность по сравнению с карбоксильной –СООН-группой, поэтому их кислотными свойствами можно пренебречь.
Амиды аминокислот, содержащие группу –С=О:
NH2
Аспарагин (Асн): 7. Глутамин (Глн):
NH2-СH-СOOH NH2-CH-COOH
CH2 (CH2)2
C=O C=O
NH2 NH2
![]()
А![]() мидная
- С = О группа проявляет, в отличие от
аминов, очень
мидная
- С = О группа проявляет, в отличие от
аминов, очень
.. слабые основные свойства в силу того, что
N H2
неподеленная электронная пара азота включена в , - сопряжение.
Основностью этой группы тоже можно пренебречь.
III. Аминокислоты с полярными (гидрофильными) положительно заряженными радикалами (3):
1. Лизин (Лиз):
: NH2-CH-COOH +NH3-CH-COO + OH
+H2O
(CH2)4 (CH2)4
: NH2 +NH3
2. Аргинин (Арг):
NH2-CH-COOH + H2O +NH3-CH-COO- + -OH
(CH2)3 (CH2)3
: NH NH
![]() ..
..
C=NH C=+NH2
![]()
:NH2 NH2
В этом случае протонируется атом азота при двойной связи, так как его неподеленная электронная пара не включена в сопряжение.
3. Гистидин (Гис):
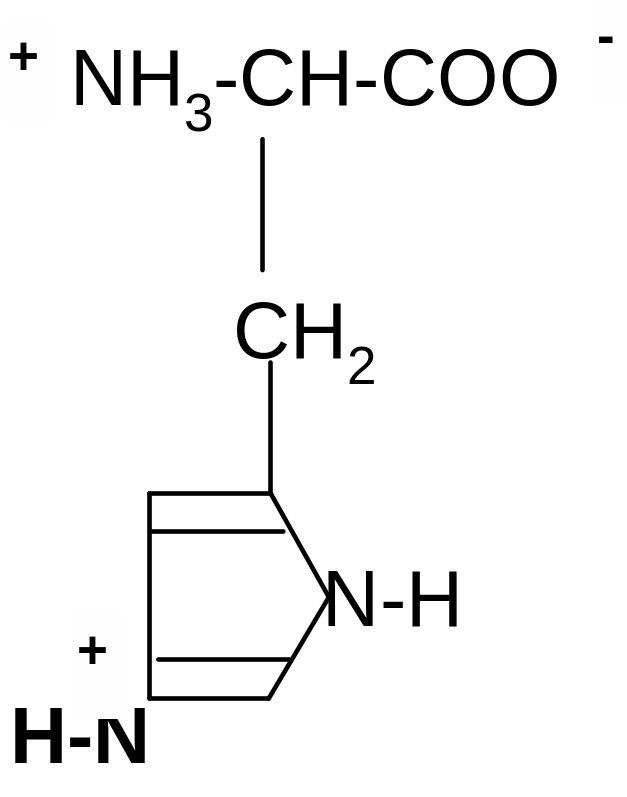
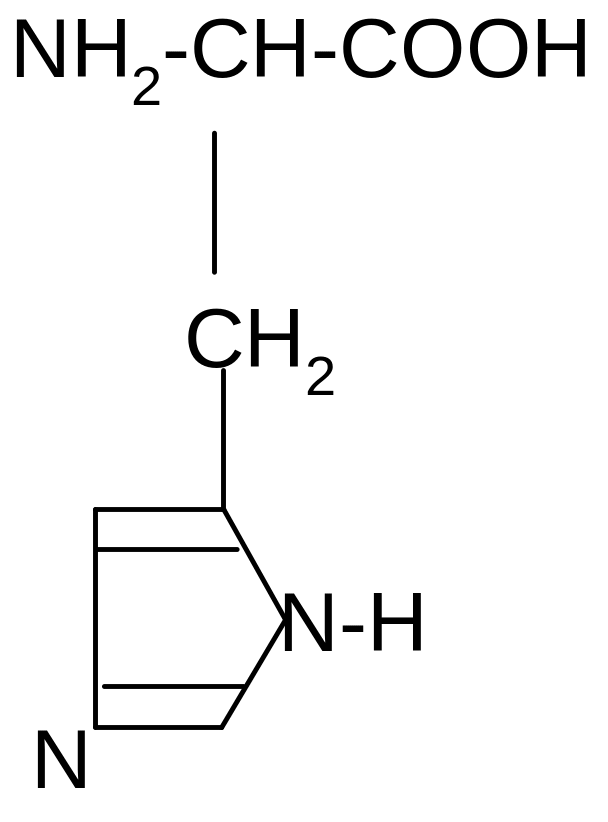 ˉ
ˉ
+ H2O + -OH
+
••
IV. Аминокислоты с полярными (гидрофильными) отрицательно заряженными радикалами (2):
Аспарагиновая кислота (Асп):
NH2-CH-COOH +NH3-CH-COO + H+
CH2 CH2
COOH COO
Глутаминовая кислота (Глу):
NH2-CH-COOH +NH3-CH-COO + H+
(CH2)2 (CH2)2
COOH COO
Во всех -аминокислотах, за исключением глицина, -атом углерода связан с четырьмя различными замещающими группами и, следовательно, является асимметрическим, или хиральным. Такие молекулы встречаются в двух стереоизомерных формах и проявляют оптическую активность.
Все аминокислоты, входящие в состав молекул белков, являются L-стереоизомерами.
Химические свойства аминокислот
I. Общие (неспецифические) свойства. Свойства аминов и карбоновых кислот. Свойства карбоновых кислот обсуждались выше (см. темы №4 и №5).
Свойства аминов
Аминами называются органические производные аммиака, в которых один, два или три атома водорода замещены на углеводородные радикалы (первичные, вторичные и третичные амины).
Все протеиногенные -аминокислоты – за исключением пролина – содержат первичную аминогруппу.
1) Основные свойства (способность образовывать соли с кислотами) обусловлены наличием неподеленной электронной пары на внешнем электронном уровне атома азота:
(СH3)3N + HCl (CH3)3NHCl
триметиламин триметиламмоний хлорид
2) Нуклеофильные свойства проявляются в реакциях:
- алкилирования аминов (получение аминов из аммиака и алкилгалогенидов):
![]()
·· + - + NH3
N H3 + CH3-CH2Cl C2H5NH3Cl
этиламмоний -NH4Cl
хлорид
C2H5-NH2
этиламин
Дальнейшее алкилирование приведет ко вторичному амину, затем к третичному амину, который можно превратить в соль четвертичного аммониевого основания (реакция Гофмана).
– ацилирования аминов: Например:
С H3-CH2-NH2 + CH3-C=O CH3-C=O + HCl
Cl NH-СН2-СН3
Эти реакции встречаются в организме.
Переносчиком ацетильной группы на нуклеофильные субстраты in vivo служит ацетилкофермент А.
 + СН3-С=О
+ KoA-SH
+ СН3-С=О
+ KoA-SH
S-KoA
..
мономер хитина
N-ацетилглюкозамин
Реакция с азотистой кислотой – качественная реакция на класс аминов.
С H3-CH2-NH2 + H-O-N=O N2 + H2O + C2H5OH
первичный амин
+ _
( С2H5)2NH + HONO (C2H5)2NH2ONO (C2H5)2N-N=O
вторичный амин -H2O
N –нитрозодиэтиламин
(желтый раствор)
Третичные амины с азотистой кислотой не образуют устойчивых продуктов.
Первичные ароматические амины дают очень реакционноспособные соли диазония (реакция диазотирования), которые дальше вступают в различные превращения (в том числе реакцию азосочетания, например, с -нафтолом).
4) Реакции аминов с альдегидами и кетонами обсуждались в теме № 3.
II. Специфические свойства обусловлены взаимным влиянием двух функциональных групп. -, - и - Аминокислоты при нагревании вступают в реакции, аналогичные реакциям соответствующих оксикислот.
1. -Аминокислоты при нагревании образуют дикетопиперазины.
Р еакция
идет межмолекулярно через промежуточное
образование дипептидов:
еакция
идет межмолекулярно через промежуточное
образование дипептидов:
R
NH2-CH-C=O
t° t°
OH
+ -H2O -H2O
H
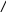 O=C-CH-NH
O=C-CH-NH
Н O
R
O
R
Дипептид
Дикетопиперазин
2. -Аминокислоты образуют непредельные кислоты:
t°
R -CH-CH2-C=O R-CH=CH-C=O
-NH3
NH2 OH OH
3. и - Аминокислоты образуют циклические амиды, называемые - и - лактамами. Для них характерно таутомерное превращение (лактам лактим):
t°
R-CH-CH2-CH2-C=O

-H2O
NH2 OH
лактам
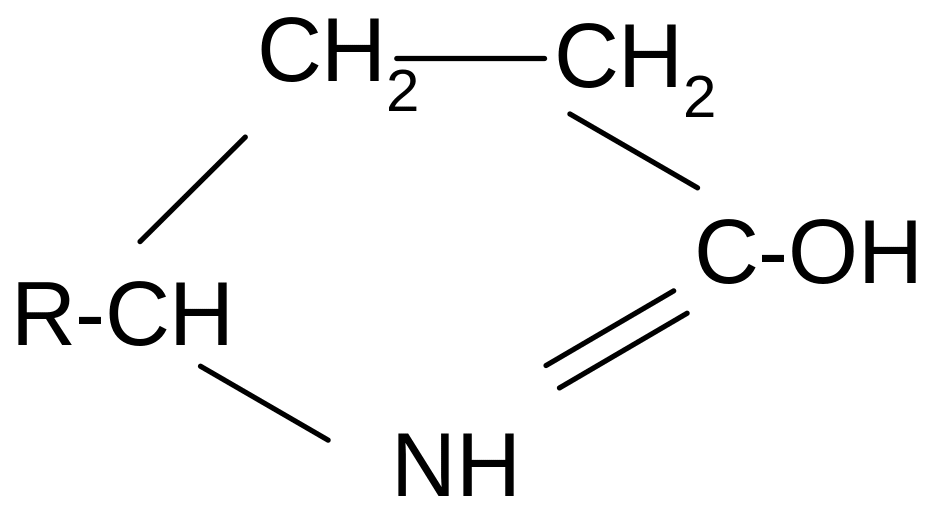
лактим
