
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Основные направления реакционной способности углеводородов в зависимости от их электронного строения
- •Ковалентная связь
- •Циклоалканы
- •Циклопропан с3н6
- •Транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
- •1. Гидрирование:
- •Пропен пропан
- •2. Галогенирование:
- •3. Гидрогалогенирование:
- •6. Полимеризация:
- •Алкадиены Это углеводороды, содержащие две двойные связи. Общая формула Сn h2n-2.
- •1. Гидрирование:
- •2. Гидрогалогенирование:
- •Ароматические углеводороды (арены)
- •Химические свойства
- •1. Галогенирование:
- •2. Нитрование:
- •3.Сульфирование:
- •4. Алкилирование:
- •Тема 2. Спирты. Фенолы. Нафтолы. Тиолы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Кислотность и основность органических соединений
- •Кислоты тон
- •Одноатомные спирты
- •Дегидрирование альдегид
- •Дегидрирование кетон
- •Многоатомные спирты
- •Спирты высшей атомности
- •Свойства фенолов как ароматических соединений. Реакции электрофильного замещения
- •Нафтолы
- •Ароматические спирты
- •Тема 3. Альдегиды и кетоны
- •Пиридоксаль пиридоксальфосфат
- •Этапы занятия и контроль усвоения знаний
- •I. Реакции нуклеофильного присоединения
- •4. Взаимодействие с галогенсодержащими реагентами
- •II. Реакции за счет -сн2-звена
- •Галогенирование:
- •III. Реакции, характерные только для альдегидов
- •Тема 4. Карбоновые кислоты и их функциональные производные
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этановая кислота 2-метилпропановая бутен-3-овая кислота
- •Малеиновая фумаровая кислота
- •Линолевая кислота
- •2. Реакции нуклеофильного замещения (sn ):
- •Двухосновные карбоновые кислоты
- •Трехосновные кислоты
- •Ноос–сн2–с–сн2–соон лимонная 3-гидрокси – 3-карбокси -
- •Специфические реакции двухосновных кислот
- •Тема 5. Липиды
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Омыляемые липиды
- •Омыляемые липиды
- •Жирные кислоты
- •Простые омыляемые липиды
- •Сложные омыляемые липиды
- •Ф осфолипиды
- •Глицерофосфо- сфингофосфо-
- •Гликолипиды
- •Цереброзиды ганглиозиды
- •Цереброзиды
- •Ганглиозиды
- •Неомыляемые липиды
- •Стероиды
- •Классификация стероидов
- •Эстрадиол
- •Тема 6. Соединения со смешанными функциями
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Оксокислоты
- •2. Кето-енольная таутомерия -оксокислот.
- •Оксокислоты
- •Стереоизомерия
- •(Оптические,
- •Энантиомеры
- •Тема 7. Аминокислоты.
- •III. Биологически важные реакции - аминокислот
- •Тема 8. Углеводы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Тема 8-1. Углеводы. Моносахариды Теория
- •Стереоизомерия моносахаридов
- •Важнейшие природные моносахариды а льдопентозы
- •Альдогексозы Кетогексоза
- •Цикло-цепные таутомеры моносахаридов
- •Перспективные формулы Хеуорса
- •Цикло-цепная таутомерия моносахаридов – это существование в водном растворе смеси таутомерных форм, способных превращаться друг в друга через открытую таутомерную форму:
- •3. Мутаротация сахаров При растворении кристаллической таутомерной формы углевода в воде наблюдается явление мутаротации.
- •4. Конформации моносахаридов
- •5. Эпимеризация
- •6. Химические свойства моносахаридов
- •Реакции, характерные для цепной формы углеводов
- •Кислоты
- •Реакции циклических таутомерных форм моносахаридов
- •Тема 8-2. Ди – и полисахариды
- •Дисахариды
- •Цикло-цепная таутомерия дисахаридов
- •Реакция «серебряного зеркала»:
- •Полисахариды
- •Тема 9. Гетероциклические соединения
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятий и контроль усвоения знаний
- •Содержание этапов занятия
- •Электронное строение «пиррольного» атома азота
- •Шестичленные гетероциклические системы с одним гетероатомом
- •Электронное строение «пиридинового» атома азота
- •Химические свойства
- •Пятичленные гетероциклы с двумя гетероатомами
- •Химические свойства
- •Шестичленные гетероциклические соединения с двумя гетероатомами п иримидин
- •Производные пиримидина
- •Полициклические гетероциклы
- •Триптофан
- •Хинолин и изохинолин
- •Нуклеиновые кислоты
- •Общая схема построения нуклеиновых кислот
- •Нуклеиновые кислоты
- •Нуклеотиды
- •Методические разработки по биоорганической химии
- •Методические разработки по биоорганической химии Санкт-Петербург
Ковалентная связь
Основным типом химических связей в органических соединениях является ковалентная связь.
Ковалентной называется химическая связь, образованная за счет обобществления электронов связываемых атомов.
Существуют два типа ковалентной связи в зависимости от симметрии перекрывания АО: - и - связи.
- связи имеют ось симметрии, проходящую через ядра атомов, при этом максимальное перекрывание орбиталей лежит на оси (прямой), связывающей ядра атомов. Наивысшая электронная плотность находится вдоль линии, соединяющей ядра и сферически симметрична по отношению к этой линии.
- связи имеют ось симметрии, проходящую через ядра атомов, но максимальное перекрывание орбиталей лежит перпендикулярно линии между ядрами и осуществляется по обе стороны от нее.
- связи более компактны, - МО находятся ближе к ядру. Они прочные и трудно поляризуются.
- МО выступают далеко за плоскость молекулы, легко поляризуются, легче разрываются.
Ковалентные связи характеризуются энергией, длиной, полярностью, поляризуемостью.
В полярных связях неравномерно распределена электронная плотность – возникает диполь. Полярность количественно оценивается величиной дипольного момента , измеряемого в дебаях.
Наличие в молекуле полярной -связи вызывает поляризацию ближайших - связей. Такой вид передачи влияния атомов называется индуктивным эффектом и обозначается символом .
Т.о., индуктивный эффект – передача электронного влияния заместителей по цепи - связей.
Группы, притягивающие электронную плотность - связей (электроноакцепторы) проявляют отрицательный индуктивный эффект -. Например, галогены, ОН, NO2, COOH, катионы.
Группы, смещающие электронную плотность - связей от себя, (электронодоноры) проявляют + эффект. Например, алкильные группы (метильные, этильные группы), анионы.
+II
+I
+ -
+
![]() -
-
Н3С – СН2 – СН2Cl СН3СН=СН2
- +
Сопряженные системы
Если 2 связи разделены одной простой - связью или рядом с - связью расположен атом с - орбиталью (занятой 1 или 2- электронами или вакантной), то имеет место частичное перекрывание (взаимодействие) формально не связанных -орбиталей.
Возникает общая - электронная система с делокализованной электронной плотностью, энергетически стабильная и реагирующая на внешнее влияние как единое целое.
Такие системы называются сопряженными системами. Они могут быть открытыми или замкнутыми и содержать не только атомы углерода, но и гетероатомы.
Сопряженные системы
Если 2 p связи разделены одной простой s- связью или рядом с p- связью расположен атом с r- орбиталью (занятой 1 или 2r- электронами или вакантной), то имеет место частичное перекрывание (взаимодействие) формально не связанных r-орбиталей.
Возникает общая p- электронная система с делокализованной электронной плотностью, энергетически стабильная и реагирующая на внешнее влияние как единое целое.
Такие системы называются сопряженными системами. Они могут быть открытыми или замкнутыми и содержать не только атомы углерода, но и гетероатомы.
В зависимости от принадлежности r- орбиталей к 2-м p- связям или к p- связи и одному атому с r- орбиталью различают p,p- или r,p- сопряженные системы.
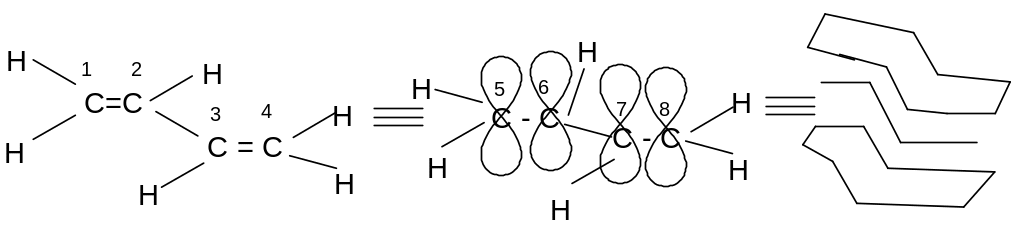
p p - сопряженные системы
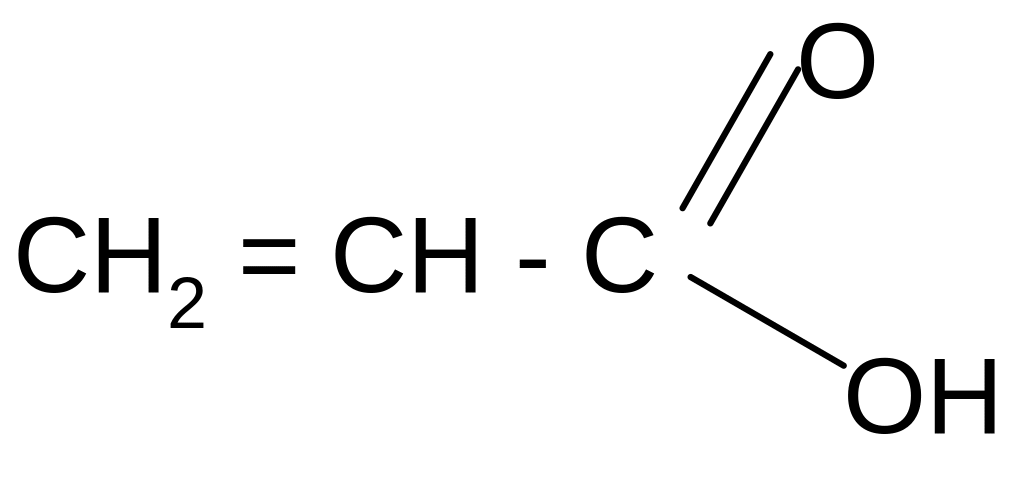

Акриловая кислота бензол
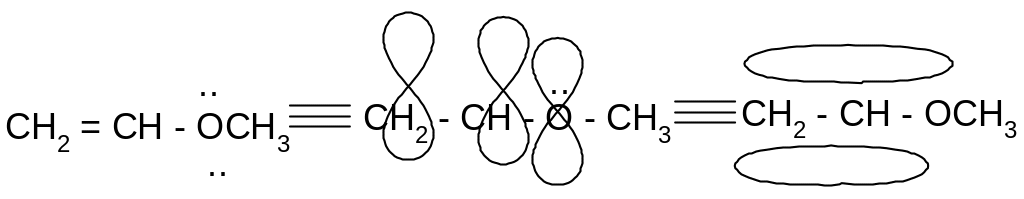
Метилвиниловый эфир
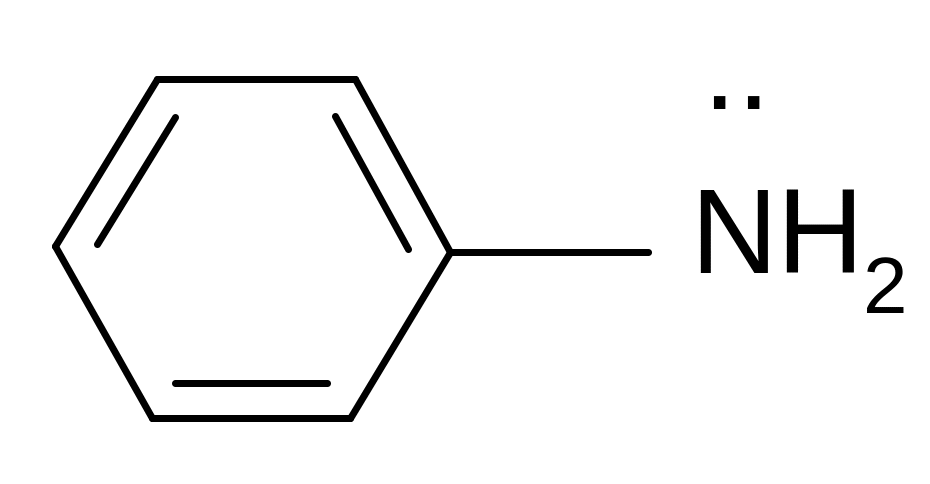
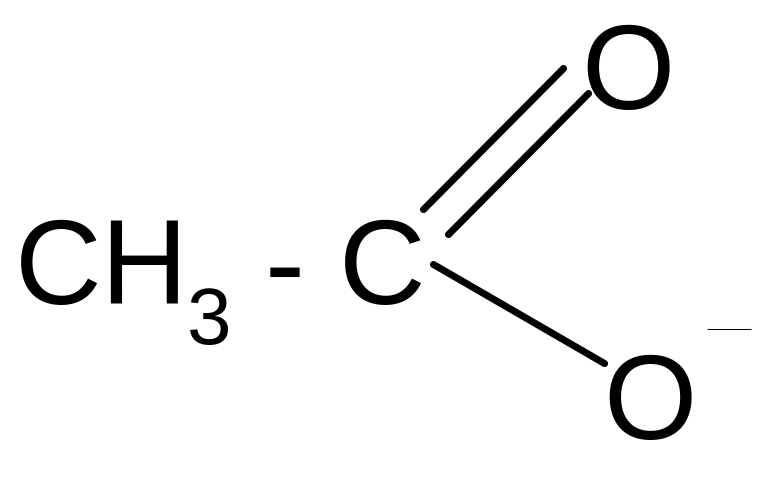
анилин ацетат йон
rp - сопряженные системы
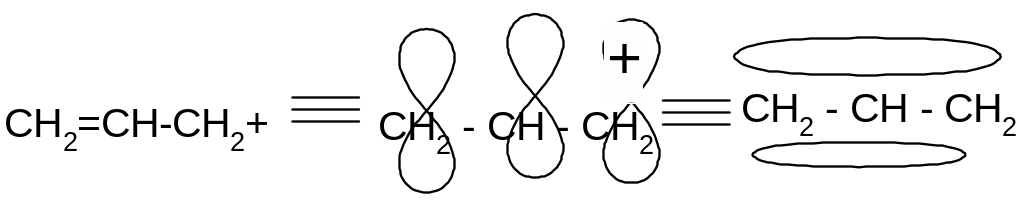
аллил катион
Передача электронного влияния по системе сопряжения называется эффектом сопряжения и обозначается символом .
Заместители – доноры проявляют + эффект. Например: NH2, OH, Сl, OR и другие. Заместители – акцепторы – - – эффект; например: NO2, COOH, C=O, SO3H и др.
Химические свойства
Алканы относительно стабильны к таким реагентам как кислоты, щелочи, окислители при обычных условиях. Это объясняется прочностью С-С и С-Н связей.
Алканы подвергаются 2-м типам реакций:
1. Реакции замещения.
2.Термические и каталитические реакции.
Эти реакции протекают при повышенных температурах или при поглощении световой энергии через образование высоко реактивных свободных радикалов.
Рассмотрим реакцию радикального замещения SR, например, реакцию галогенирования. Она включает несколько этапов.
1-й этап – инициирование. На этом этапе молекула галогена под действием кванта света гомолитически расщепляется на два радикала:
h
 Br:
Br Br + Br
Br:
Br Br + Br
гомолиз
2-й этап – рост радикальной цепи. Радикал галогена атакует молекулу алкана. Связь С:Н расщепляется гомолитически с образованием алкильного радикала:
С Н3-СН-СН2-СН3
+ Br СН3-С-СН2-СН3
+ H : Br.
Н3-СН-СН2-СН3
+ Br СН3-С-СН2-СН3
+ H : Br.
CH3 CH3
Галогенирование алканов обычно приводит к смеси изомеров. Но, в первую очередь, радикальной атаке подвергаются третичные, затем вторичные и в последнюю очередь первичные С-Н- связи:
перв. трет. втор. перв.
СН3 – СН - СН2 - СН3
СН3
перв.
Далее образовавшийся алкил-радикал реагирует с новой молекулой галогена с образованием нового радикала галогена:
Br
.
СН3-С-СН2-СН3 + Br : Br СН3-С-СН2-СН3 +Br
СН3 CH3
Таким образом, развивается радикальная цепь.
3-й этап – обрыв цепи, или рекомбинация радикалов. Он возможен в результате следующих превращений:
а )
Br + Br Br2
)
Br + Br Br2
б )
Br + R
R- Br
)
Br + R
R- Br
в ) R + R R – R
Среди галогенпроизводных алканов наиболее физиологически активны хлорпроизводные. Они проявляют наркотическое действие, понижая кровяное давление. В ряду хлорзамещенных метана: СН3Сl – хлористый метил, CH2Cl2 – хлористый метилен, CHCl3 – хлороформ, CCl4 – четыреххлористый углерод – усиливаются наркотическая активность и токсичность.
2. Окисление. Алканы вступают в реакции окисления только при очень высокой температуре и в присутствии катализаторов.
