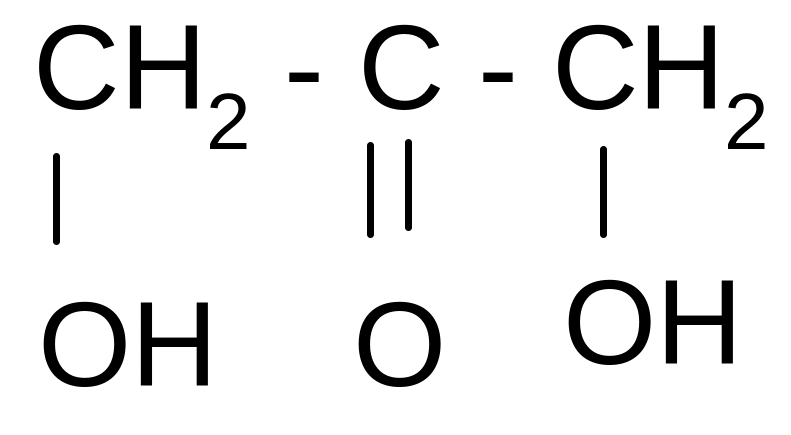- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Основные направления реакционной способности углеводородов в зависимости от их электронного строения
- •Ковалентная связь
- •Циклоалканы
- •Циклопропан с3н6
- •Транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
- •1. Гидрирование:
- •Пропен пропан
- •2. Галогенирование:
- •3. Гидрогалогенирование:
- •6. Полимеризация:
- •Алкадиены Это углеводороды, содержащие две двойные связи. Общая формула Сn h2n-2.
- •1. Гидрирование:
- •2. Гидрогалогенирование:
- •Ароматические углеводороды (арены)
- •Химические свойства
- •1. Галогенирование:
- •2. Нитрование:
- •3.Сульфирование:
- •4. Алкилирование:
- •Тема 2. Спирты. Фенолы. Нафтолы. Тиолы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Кислотность и основность органических соединений
- •Кислоты тон
- •Одноатомные спирты
- •Дегидрирование альдегид
- •Дегидрирование кетон
- •Многоатомные спирты
- •Спирты высшей атомности
- •Свойства фенолов как ароматических соединений. Реакции электрофильного замещения
- •Нафтолы
- •Ароматические спирты
- •Тема 3. Альдегиды и кетоны
- •Пиридоксаль пиридоксальфосфат
- •Этапы занятия и контроль усвоения знаний
- •I. Реакции нуклеофильного присоединения
- •4. Взаимодействие с галогенсодержащими реагентами
- •II. Реакции за счет -сн2-звена
- •Галогенирование:
- •III. Реакции, характерные только для альдегидов
- •Тема 4. Карбоновые кислоты и их функциональные производные
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этановая кислота 2-метилпропановая бутен-3-овая кислота
- •Малеиновая фумаровая кислота
- •Линолевая кислота
- •2. Реакции нуклеофильного замещения (sn ):
- •Двухосновные карбоновые кислоты
- •Трехосновные кислоты
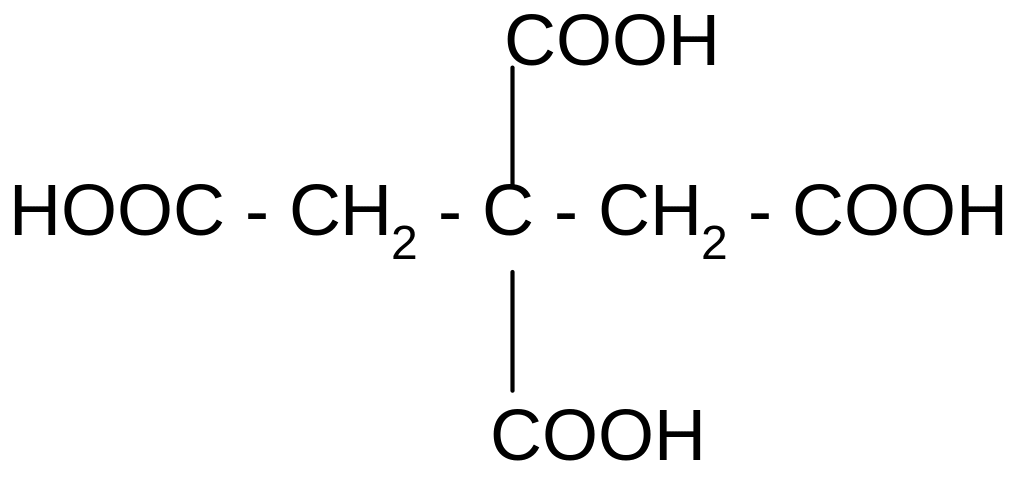
- •Ноос–сн2–с–сн2–соон лимонная 3-гидрокси – 3-карбокси -
- •Специфические реакции двухосновных кислот
- •Тема 5. Липиды
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Омыляемые липиды
- •Омыляемые липиды
- •Жирные кислоты
- •Простые омыляемые липиды
- •Сложные омыляемые липиды
- •Ф осфолипиды
- •Глицерофосфо- сфингофосфо-
- •Гликолипиды
- •Цереброзиды ганглиозиды
- •Цереброзиды
- •Ганглиозиды
- •Неомыляемые липиды
- •Стероиды
- •Классификация стероидов
- •Эстрадиол
- •Тема 6. Соединения со смешанными функциями
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Оксокислоты
- •2. Кето-енольная таутомерия -оксокислот.
- •Оксокислоты
- •Стереоизомерия
- •(Оптические,
- •Энантиомеры
- •Тема 7. Аминокислоты.
- •III. Биологически важные реакции - аминокислот
- •Тема 8. Углеводы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Тема 8-1. Углеводы. Моносахариды Теория
- •Стереоизомерия моносахаридов
- •Важнейшие природные моносахариды а льдопентозы
- •Альдогексозы Кетогексоза
- •Цикло-цепные таутомеры моносахаридов
- •Перспективные формулы Хеуорса
- •Цикло-цепная таутомерия моносахаридов – это существование в водном растворе смеси таутомерных форм, способных превращаться друг в друга через открытую таутомерную форму:
- •3. Мутаротация сахаров При растворении кристаллической таутомерной формы углевода в воде наблюдается явление мутаротации.
- •4. Конформации моносахаридов
- •5. Эпимеризация
- •6. Химические свойства моносахаридов
- •Реакции, характерные для цепной формы углеводов
- •Кислоты
- •Реакции циклических таутомерных форм моносахаридов
- •Тема 8-2. Ди – и полисахариды
- •Дисахариды
- •Цикло-цепная таутомерия дисахаридов
- •Реакция «серебряного зеркала»:
- •Полисахариды
- •Тема 9. Гетероциклические соединения
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятий и контроль усвоения знаний
- •Содержание этапов занятия
- •Электронное строение «пиррольного» атома азота
- •Шестичленные гетероциклические системы с одним гетероатомом
- •Электронное строение «пиридинового» атома азота
- •Химические свойства
- •Пятичленные гетероциклы с двумя гетероатомами
- •Химические свойства
- •Шестичленные гетероциклические соединения с двумя гетероатомами п иримидин
- •Производные пиримидина
- •Полициклические гетероциклы
- •Триптофан
- •Хинолин и изохинолин
- •Нуклеиновые кислоты
- •Общая схема построения нуклеиновых кислот
- •Нуклеиновые кислоты
- •Нуклеотиды
- •Методические разработки по биоорганической химии
- •Методические разработки по биоорганической химии Санкт-Петербург
Этапы занятия и контроль усвоения знаний
Продолжительность занятия – 4 часа.
Этапы занятия |
Формы проведения |
Время |
1. Контроль выполнения домашнего задания. |
Проверка преподавателем выполнения домашнего задания в рабочих тетрадях. |
15 мин. |
2. Контроль самоподготовки. |
Написание тест – контроля и его оценка. |
15 мин |
3. Разбор теоретического материала. |
Опрос студентов у доски, объяснение преподавателем наиболее трудных и важных вопросов, демонстрация моделей, плакатов. |
90 мин |
4. Приобретение практических навыков. |
Выполнение лабораторных работ по теме занятия. |
30 мин |
5. Оформление протоколов лабораторных работ. |
Заполнение графы «Визуальные наблюдения» в протоколах лабораторных работ. Самостоятельный анализ полученных данных и формулировка выводов. |
15 мин |
6. Проверка и защита протоколов. |
Собеседование и оценка практических навыков преподавателем. |
15 мин |
Содержание этапов занятия
1-й этап. Преподаватель проверяет и оценивает по пятибалльной системе выполнение домашнего задания по заданной теме и отвечает на вопросы студентов.
2-й этап. Студенты письменно отвечают на билет тест – контроля. Ответ оценивается по десятибалльной системе (0, 5, 10 баллов).
3-й этап. При обсуждении теоретического материала необходимо вспомнить свойства карбоновых кислот, спиртов, альдегидов и кетонов как соединений, определяющих общие химические свойства гидрокси- и оксокислот. Разобрать специфические свойства: отношение к нагреванию -, -, -гидроксикислот на примере молочной, -гидроксимасляной, -гидроксимасляной кислот; способность - гидроксикислот разлагаться при нагревании в присутствии серной кислоты на примере молочной кислоты; реакции декарбоксилирования пировиноградной и ацетоуксусной кислот; кето-енольную таутомерию на примере ацетоуксусного эфира; оптическую изомерию на примере винной и молочной кислот.
4-й этап. Студенты по 2 человека выполняют лабораторные работы по теме занятия.
5-й этап. Студенты оформляют в рабочей тетради протокол лабораторной работы в виде таблицы. Заполняют графы «Наблюдения и выводы»
6-й этап. Студенты предоставляют оформленный протокол и объясняют полученные результаты. Преподаватель оценивает приобретенные практические навыки.
Теория
Органические соединения, содержащие ОН- и >С=О группы, называются гидроксиальдегидами и гидроксикетонами. Важнейшие представители приведены в таблице 1.
Соединения, содержащие -ОН и -СООН группы, называются гидроксикислотами (таблица 2).
Гидроксикислоты
Классификация
Гидроксикислоты

по атомности по основности по взаимному расположению
двух функциональных групп
-
по количеству -ОН групп, включая и входящую в -СООН, бывают двух- и многоатомными
по количеству -СООН групп бывают одно- и многоосновными
бывают -,. -, - и т.д. гидроксикислотами
Виды изомерии: структурная – по положению 2-й функциональной ОН – группы относительно – СООН; стереоизомерия (энантиомерия, диастереомерия)
Химические свойства.
1. Гидроксикислоты проявляют общие свойства спиртов и кислот. В зависимости от реагентов и условий проведения реакций взаимодействует ОН или -СООН группа или обе одновременно. Как кислоты они более сильны, чем соответствующие карбоновые кислоты (сказывается –I эффект ОН- группы).
2. Гидроксикислоты проявляют специфические свойства, которые обусловлены взаимным влиянием ОН- и СООН- групп.
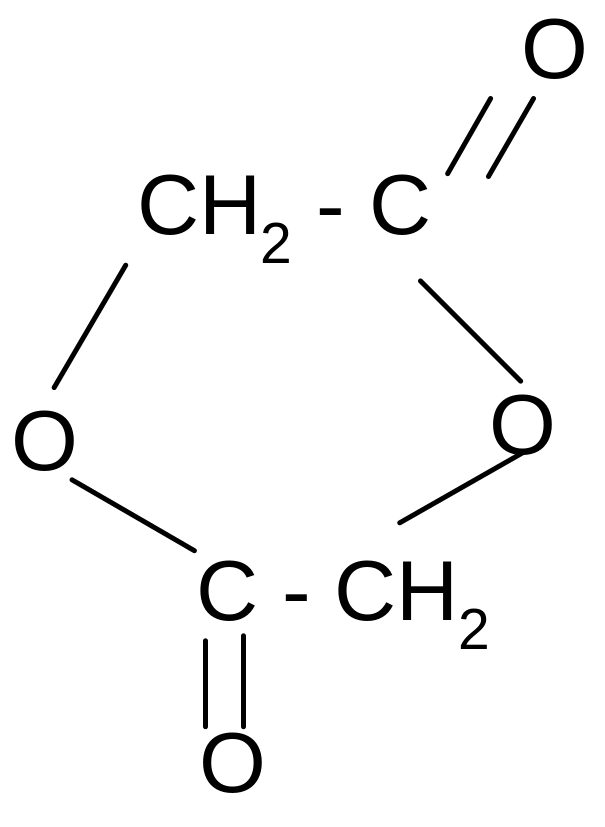
Например, своеобразная реакция отщепления воды при нагревании.
Она позволяет отличить -, -, - и другие гидроксикислоты.
а
 )
)
t°
гидролиз + 2H2O
 +
H+
или OH-
+
H+
или OH-
лактиды
(циклические
 сложные эфиры)
сложные эфиры)
б) t°
-H2O
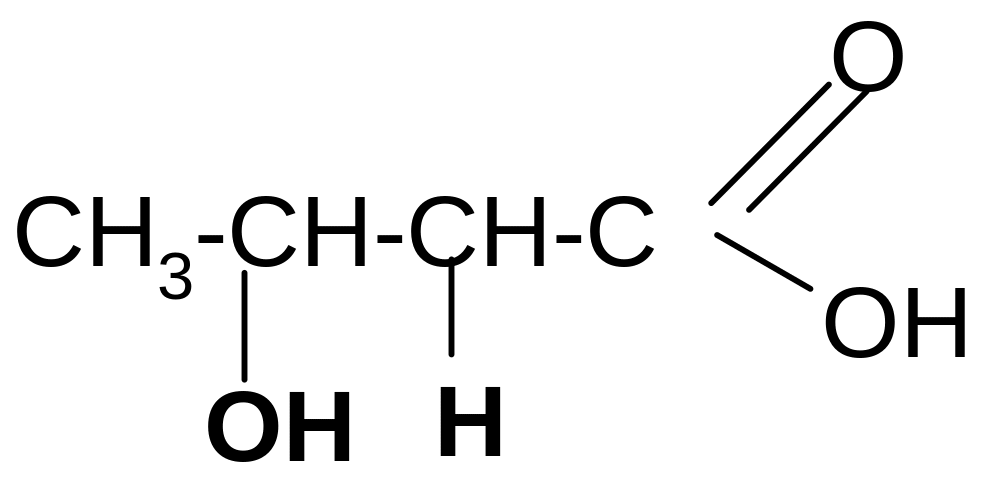
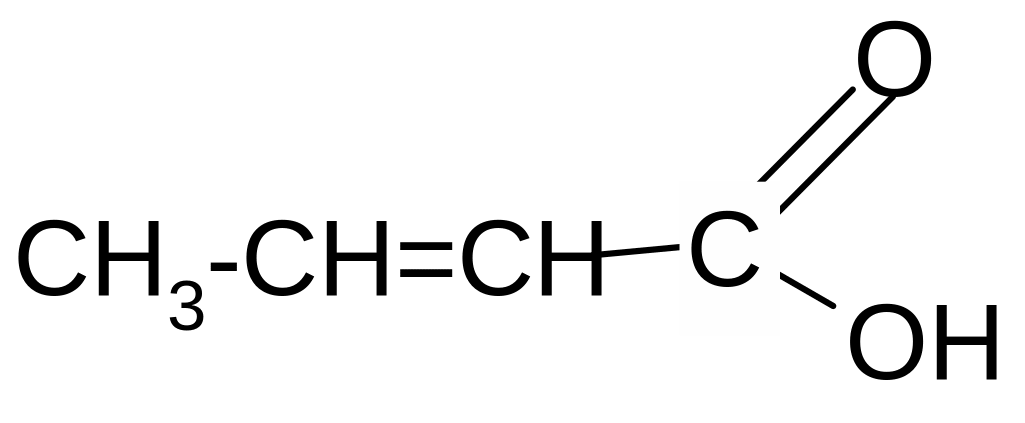
-оксимасляная кротоновая кислота
кислота
в
 )
t°
)
t°
 + H2O
+ H2O
гидролиз
H+
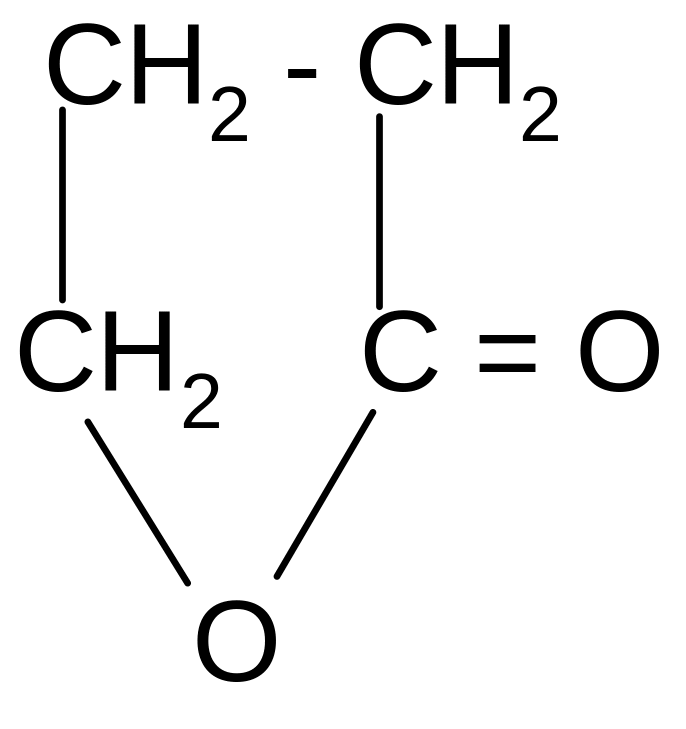
-гидроксимасляная - бутиролактон
кислота (ГОМК)
ГОМК обладает наркотическим действием, нетоксична, применяется в виде натриевой соли как снотворное средство и при неингаляционном наркозе при операциях.
г)
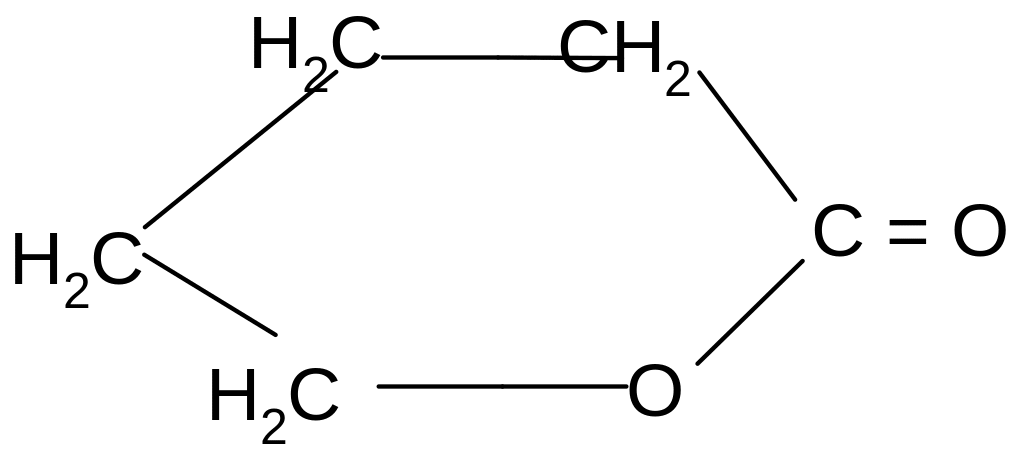
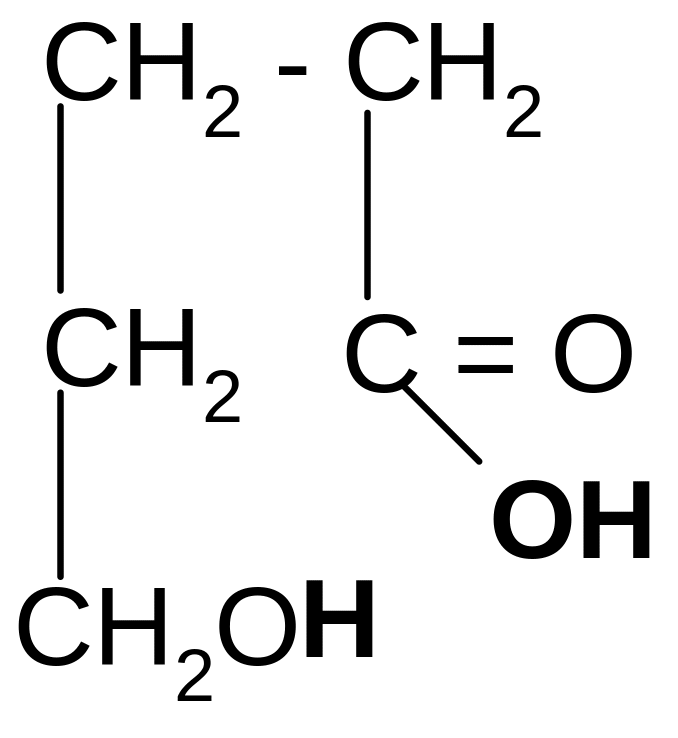 t°
t°

+
H2O
+
H2O
гидролиз
H+
- лактон
Лактиды и лактоны могут гидролизоваться в кислой среде с образованием исходных гидроксикислот.
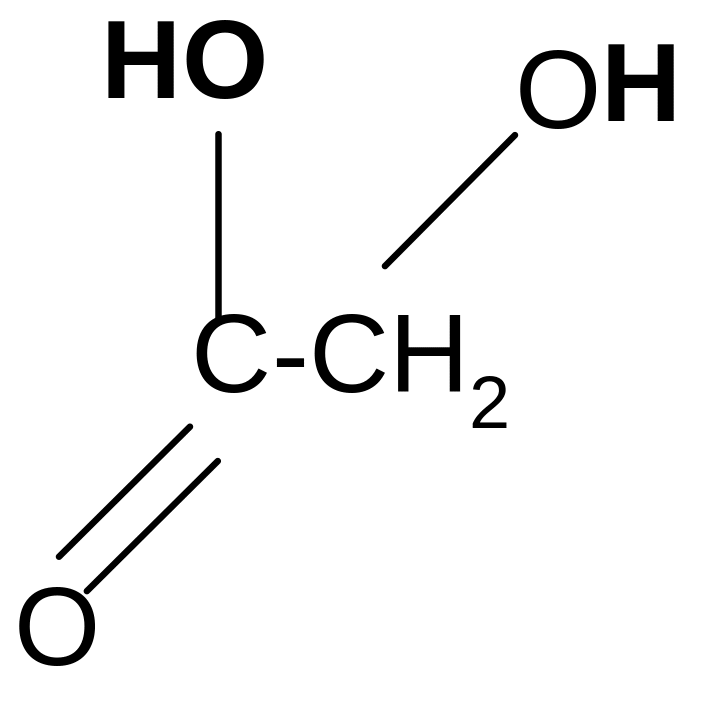
2. Разложение -гидроксикислот при нагревании в присутствии H2SO4:
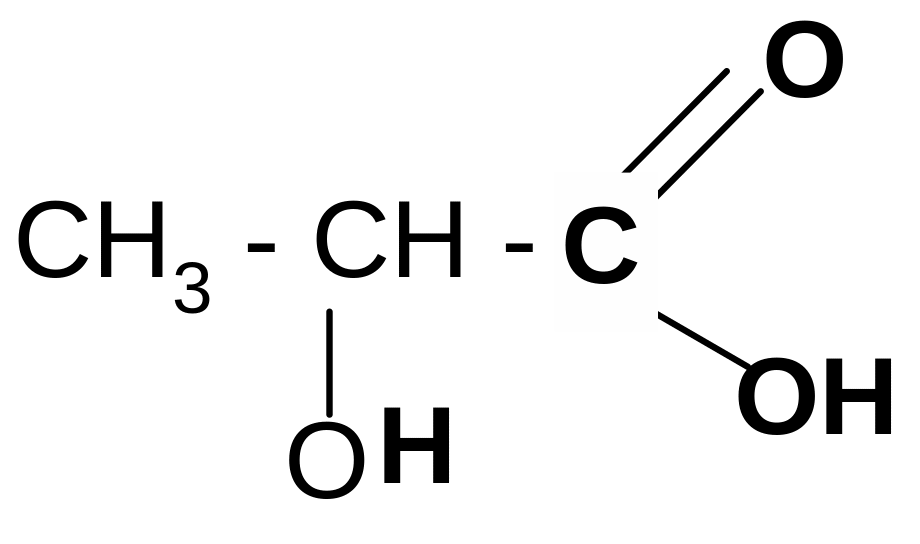
t°, H2SO4
CH3–CHO + HCOOH
Многоосновные кислоты ведут себя так же. Например:
а) при нагревании лимонная кислота будет вести себя как -гидрокси-
кислоты:
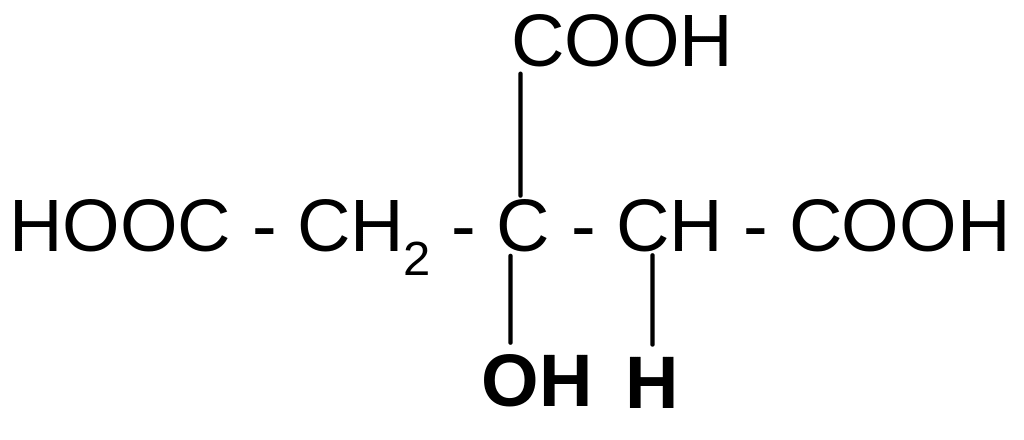
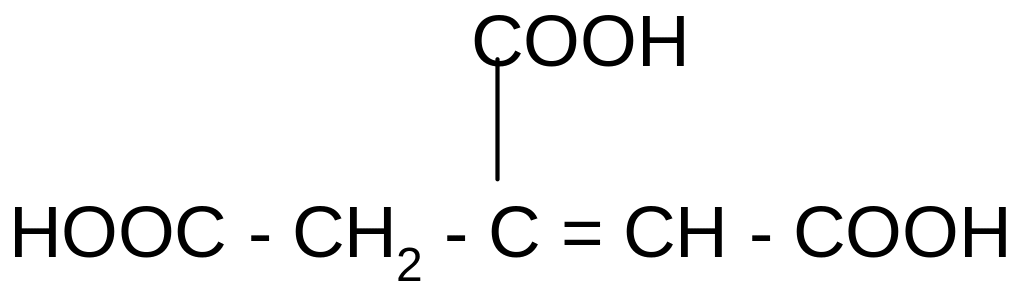
t°
-Н2О
 лимонная кислота
цис-аконитовая к-та
лимонная кислота
цис-аконитовая к-та
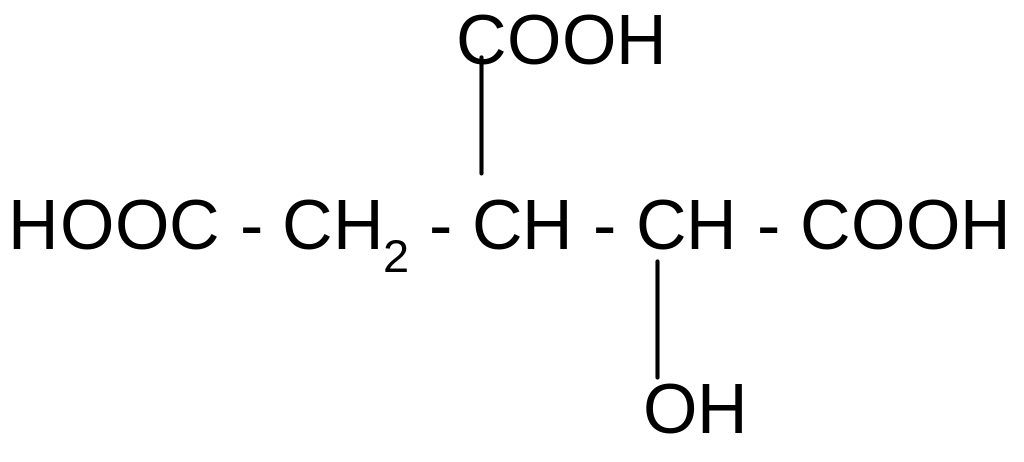
+ Н2О
против правила
Марковникова
изолимонная кислота
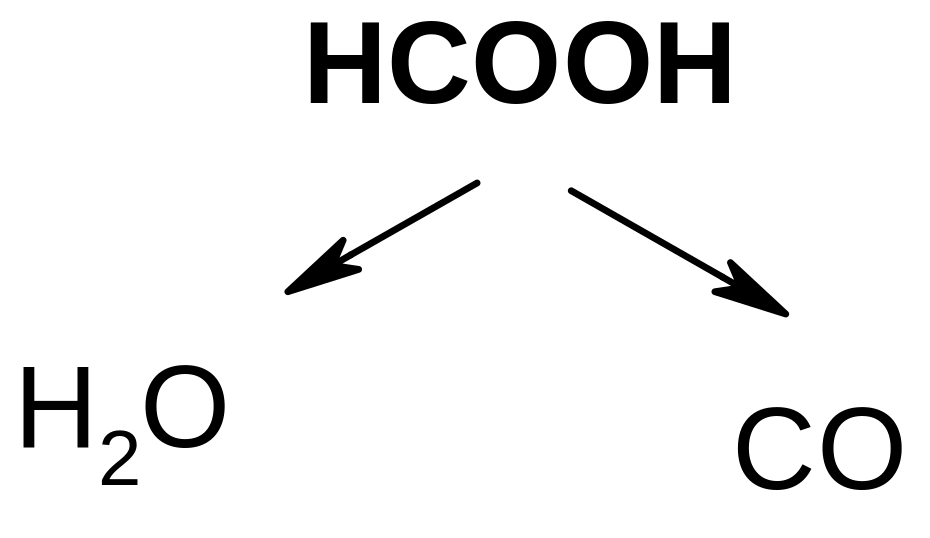
б) при действии H2SO4 и нагревании она ведет себя как -гидроксикислота, т.е. разлагается с выделением муравьиной кислоты:
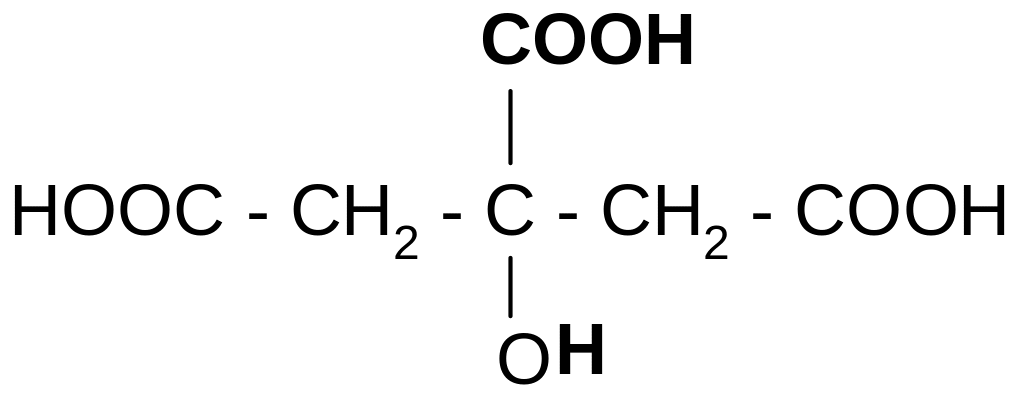
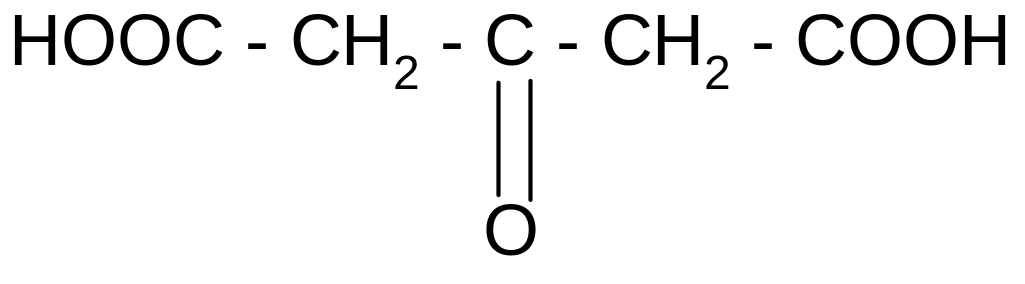 t°,
H2SO4
t°,
H2SO4
+
ацетондикарбоновая


 кислота
кислота
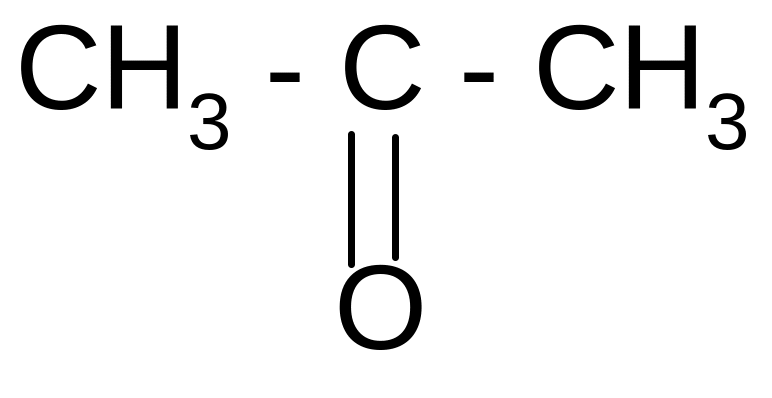 2СO2 +
2СO2 +
Таблица 1
Гидрокси – и оксоальдегиды и кетоны
Формула |
Тривиальное название |
ИЮПАК – номенклатура |
Местонахождение в природе и биологическая роль |
|
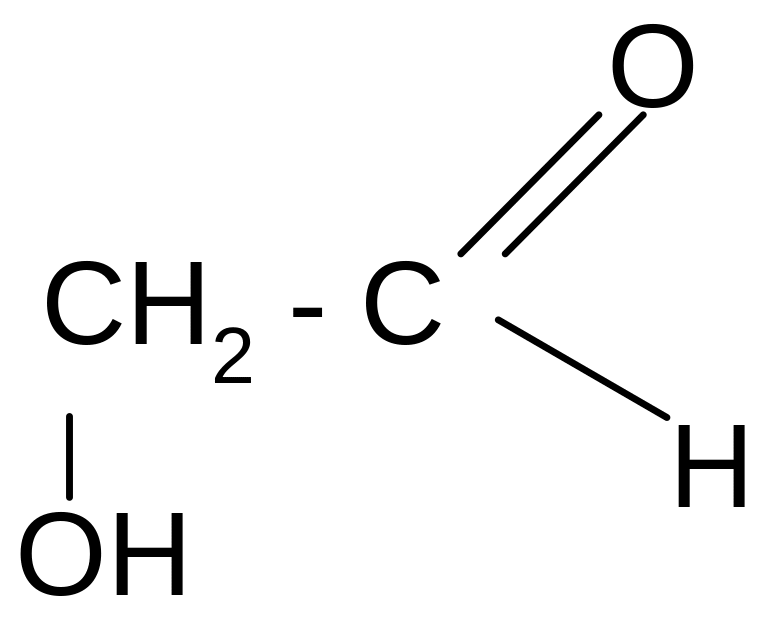
Гликолевый, или гидроксиуксусный альдегид |
2– гидрокси-этаналь |
Предшественник гликолевой кислоты |
|
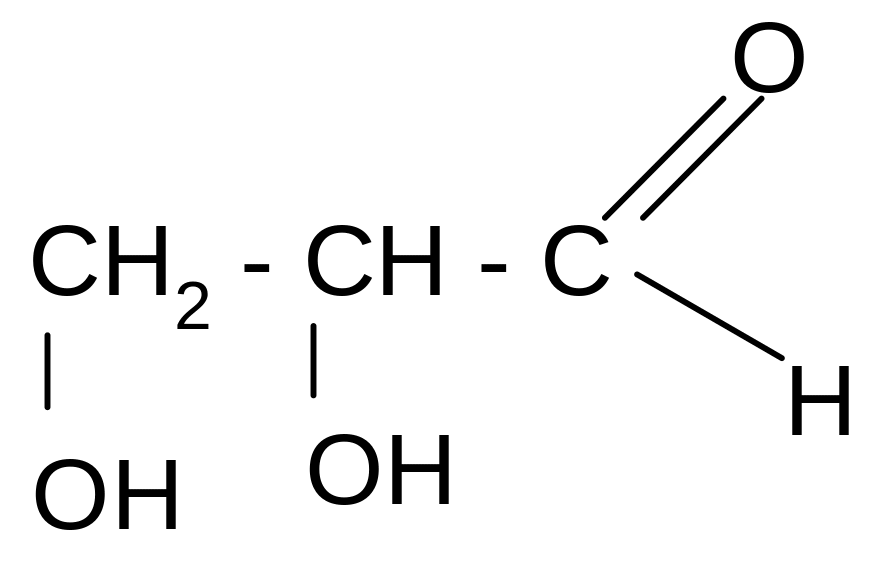
Глицериновый альдегид |
2,3 – дигидрокси-пропаналь |
Стандарт конфигурации всех «хиральных» соединений: гидрокси- и аминокислот, углеводов и др. |
|
Дигидроксиацетон |
1,3 – дигидрокси-2-пропанон
|
В виде фосфорно-кислого эфира встречается как промежуточный продукт при окислении глюкозы в организме |