
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Основные направления реакционной способности углеводородов в зависимости от их электронного строения
- •Ковалентная связь
- •Циклоалканы
- •Циклопропан с3н6
- •Транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
- •1. Гидрирование:
- •Пропен пропан
- •2. Галогенирование:
- •3. Гидрогалогенирование:
- •6. Полимеризация:
- •Алкадиены Это углеводороды, содержащие две двойные связи. Общая формула Сn h2n-2.
- •1. Гидрирование:
- •2. Гидрогалогенирование:
- •Ароматические углеводороды (арены)
- •Химические свойства
- •1. Галогенирование:
- •2. Нитрование:
- •3.Сульфирование:
- •4. Алкилирование:
- •Тема 2. Спирты. Фенолы. Нафтолы. Тиолы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Кислотность и основность органических соединений
- •Кислоты тон
- •Одноатомные спирты
- •Дегидрирование альдегид
- •Дегидрирование кетон
- •Многоатомные спирты
- •Спирты высшей атомности
- •Свойства фенолов как ароматических соединений. Реакции электрофильного замещения
- •Нафтолы
- •Ароматические спирты
- •Тема 3. Альдегиды и кетоны
- •Пиридоксаль пиридоксальфосфат
- •Этапы занятия и контроль усвоения знаний
- •I. Реакции нуклеофильного присоединения
- •4. Взаимодействие с галогенсодержащими реагентами
- •II. Реакции за счет -сн2-звена
- •Галогенирование:
- •III. Реакции, характерные только для альдегидов
- •Тема 4. Карбоновые кислоты и их функциональные производные
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этановая кислота 2-метилпропановая бутен-3-овая кислота
- •Малеиновая фумаровая кислота
- •Линолевая кислота
- •2. Реакции нуклеофильного замещения (sn ):
- •Двухосновные карбоновые кислоты
- •Трехосновные кислоты
- •Ноос–сн2–с–сн2–соон лимонная 3-гидрокси – 3-карбокси -
- •Специфические реакции двухосновных кислот
- •Тема 5. Липиды
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Омыляемые липиды
- •Омыляемые липиды
- •Жирные кислоты
- •Простые омыляемые липиды
- •Сложные омыляемые липиды
- •Ф осфолипиды
- •Глицерофосфо- сфингофосфо-
- •Гликолипиды
- •Цереброзиды ганглиозиды
- •Цереброзиды
- •Ганглиозиды
- •Неомыляемые липиды
- •Стероиды
- •Классификация стероидов
- •Эстрадиол
- •Тема 6. Соединения со смешанными функциями
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Оксокислоты
- •2. Кето-енольная таутомерия -оксокислот.
- •Оксокислоты
- •Стереоизомерия
- •(Оптические,
- •Энантиомеры
- •Тема 7. Аминокислоты.
- •III. Биологически важные реакции - аминокислот
- •Тема 8. Углеводы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Тема 8-1. Углеводы. Моносахариды Теория
- •Стереоизомерия моносахаридов
- •Важнейшие природные моносахариды а льдопентозы
- •Альдогексозы Кетогексоза
- •Цикло-цепные таутомеры моносахаридов
- •Перспективные формулы Хеуорса
- •Цикло-цепная таутомерия моносахаридов – это существование в водном растворе смеси таутомерных форм, способных превращаться друг в друга через открытую таутомерную форму:
- •3. Мутаротация сахаров При растворении кристаллической таутомерной формы углевода в воде наблюдается явление мутаротации.
- •4. Конформации моносахаридов
- •5. Эпимеризация
- •6. Химические свойства моносахаридов
- •Реакции, характерные для цепной формы углеводов
- •Кислоты
- •Реакции циклических таутомерных форм моносахаридов
- •Тема 8-2. Ди – и полисахариды
- •Дисахариды
- •Цикло-цепная таутомерия дисахаридов
- •Реакция «серебряного зеркала»:
- •Полисахариды
- •Тема 9. Гетероциклические соединения
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятий и контроль усвоения знаний
- •Содержание этапов занятия
- •Электронное строение «пиррольного» атома азота
- •Шестичленные гетероциклические системы с одним гетероатомом
- •Электронное строение «пиридинового» атома азота
- •Химические свойства
- •Пятичленные гетероциклы с двумя гетероатомами
- •Химические свойства
- •Шестичленные гетероциклические соединения с двумя гетероатомами п иримидин
- •Производные пиримидина
- •Полициклические гетероциклы
- •Триптофан
- •Хинолин и изохинолин
- •Нуклеиновые кислоты
- •Общая схема построения нуклеиновых кислот
- •Нуклеиновые кислоты
- •Нуклеотиды
- •Методические разработки по биоорганической химии
- •Методические разработки по биоорганической химии Санкт-Петербург
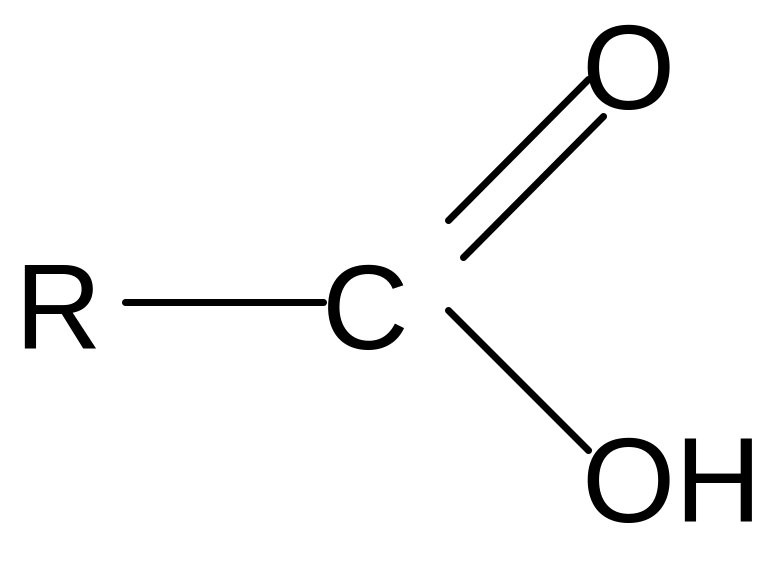
2. Реакции нуклеофильного замещения (sn ):
а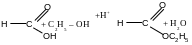 )
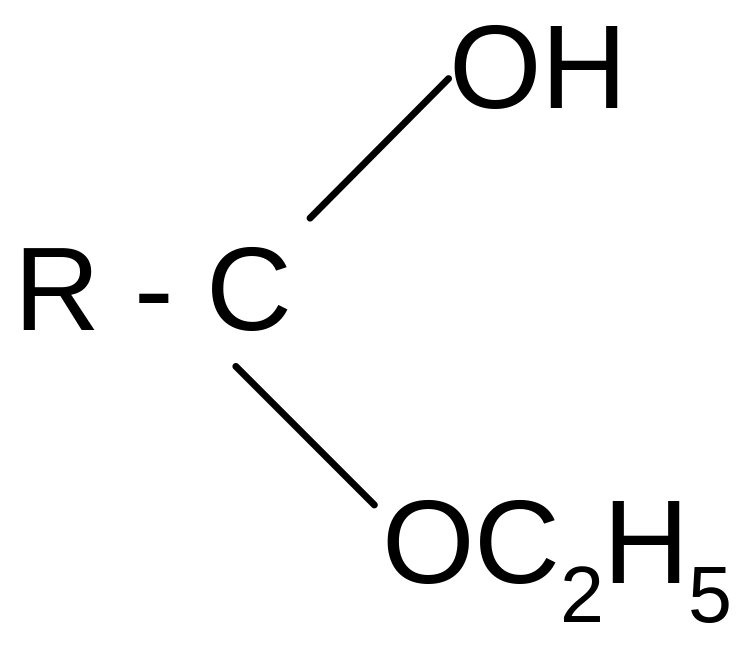
реакция этерификации:
)
реакция этерификации:
этилформиат
 Механизм реакции:
Механизм реакции:


 ..
..
НОС2Н5 -Н2О
 + Н+
+
+ Н+
+


 -Н+
-Н+
+
Реакция этерификации – обратимый процесс: прямая реакция – образование сложного эфира, обратная – его кислотный или щелочной гидролиз. Чтобы сдвинуть равновесие вправо, необходимо из реакционной смеси удалить воду;
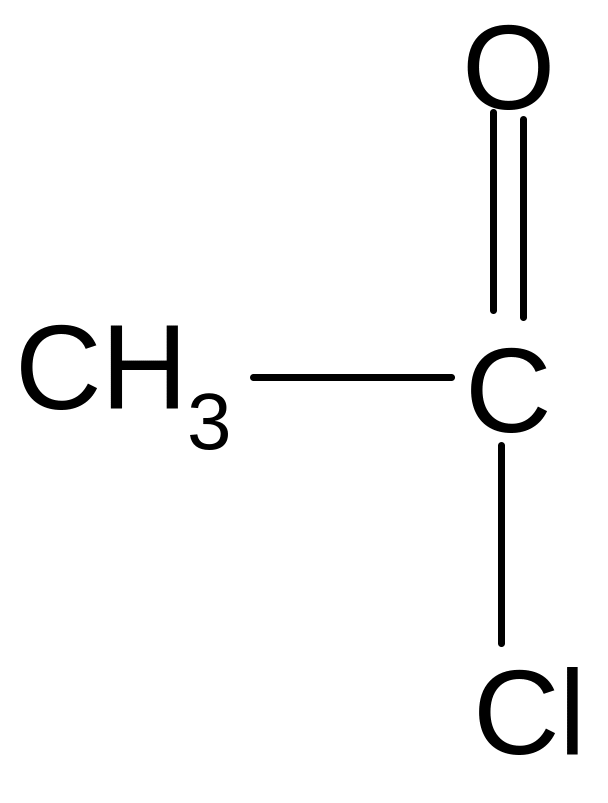
б) образование галогенангидридов:
С реди
галогенангидридов наибольшее значение
имеют хлорангидриды, которые получают
при действии хлоридов фосфора (III)
или фосфора (V):
реди
галогенангидридов наибольшее значение
имеют хлорангидриды, которые получают
при действии хлоридов фосфора (III)
или фосфора (V):
 + PCl5
+ POCl3
+ HCl
+ PCl5
+ POCl3
+ HCl
хлористый ацетил
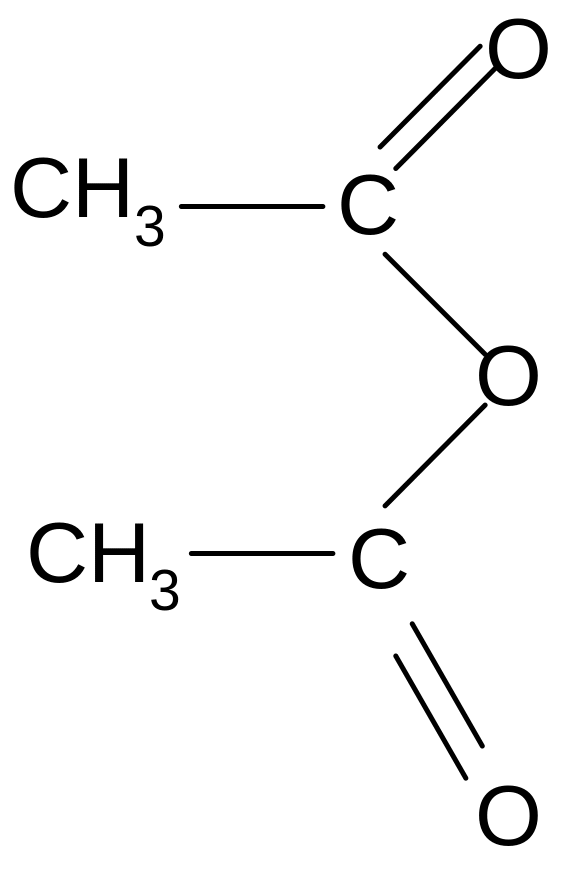
в) образование ангидридов кислот: При действии сильных водоотнимающих агентов (P2O5, Al2O3) образуются ангидриды кислот:
___
Al2O3 + H2O

Большое практическое значение имеет уксусный ангидрид, используемый для получения волокон (ацетатный шелк), многих лекарственных веществ. Применяется также для ацетилирования соединений.
Галогенангидриды и ангидриды очень реакционноспособны. При взаимодействии галогенангидридов с соединениями, содержащими атом металла или активный атом водорода, происходит замена его кислотным остатком. Подобные реакции называются ацилированием, в частности ацетилированием, если в молекулу входит ацетил, остаток уксусной кислоты.
В организме ацетилирующим реагентом является ацетилкофермент А - ключевой метаболит всех видов обмена в клетке.
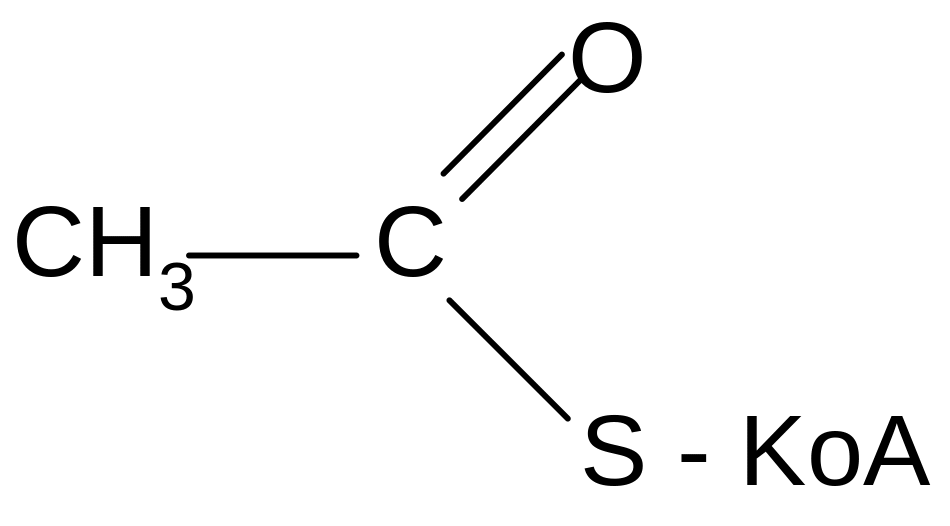
г) образование амидов:

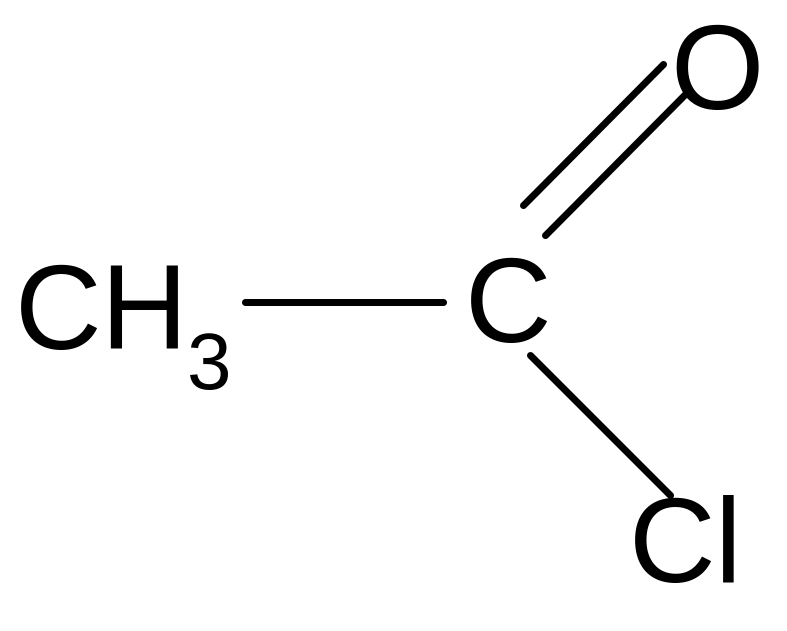
+ NH3 + HCl
ацетамид
(амид уксусной
 кислоты)
кислоты)
 O
t° С
O
t° С
+ NH3 CH3 – C + H2O
 ONH4
ONH4
Амиды можно получить взаимодействием карбоновых кислот с аммиаком. Вначале образуются аммонийные соли, которые при нагревании теряют воду и превращаются в амиды. Амиды кислот подвержены различным превращениям. При нагревании с Р2О5 отщепляется вода и образуются нитрилы кислот:
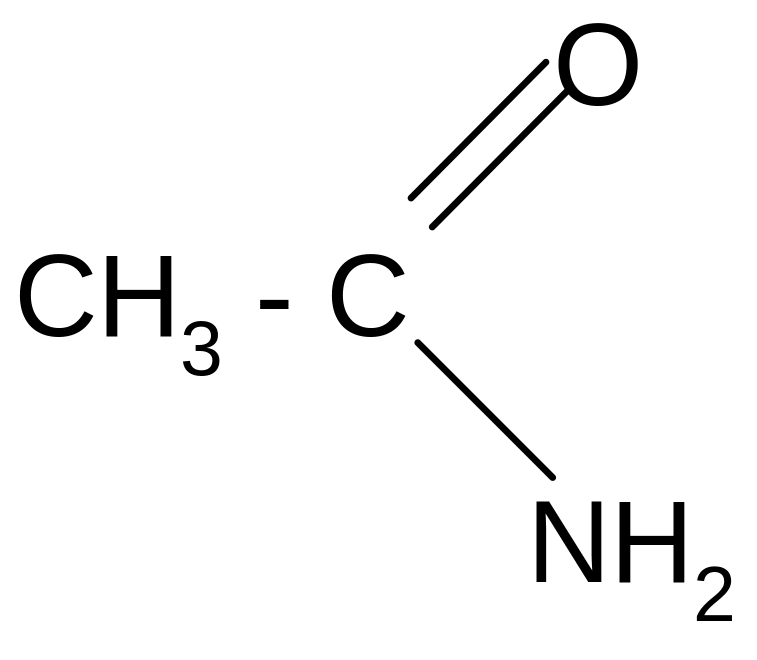 __
__
t°, P2O5
CH3–C=N + H2O
Нитрил
уксусной
кислоты
В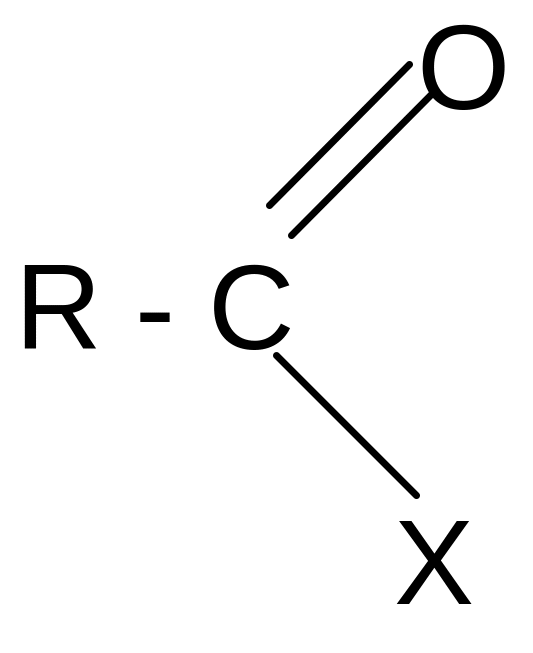
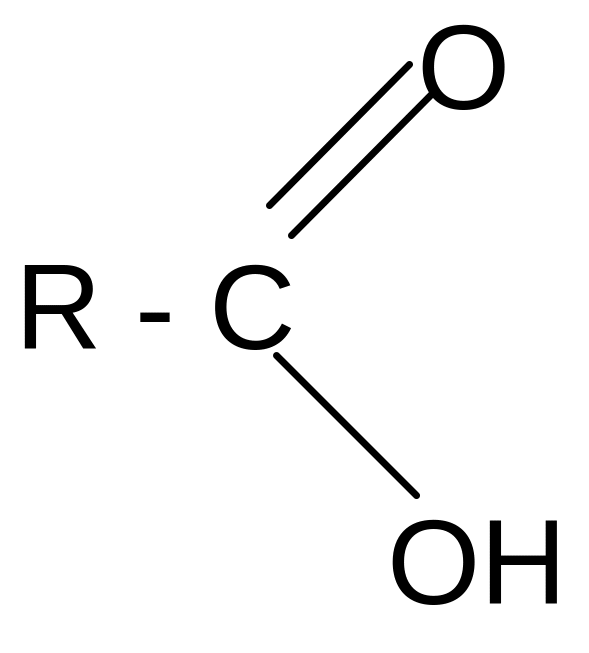 се
функциональные производные способны
гидролизоваться с образованием карбоновых
кислот:
се
функциональные производные способны
гидролизоваться с образованием карбоновых
кислот:
+ Н2О + НХ

 ___
___
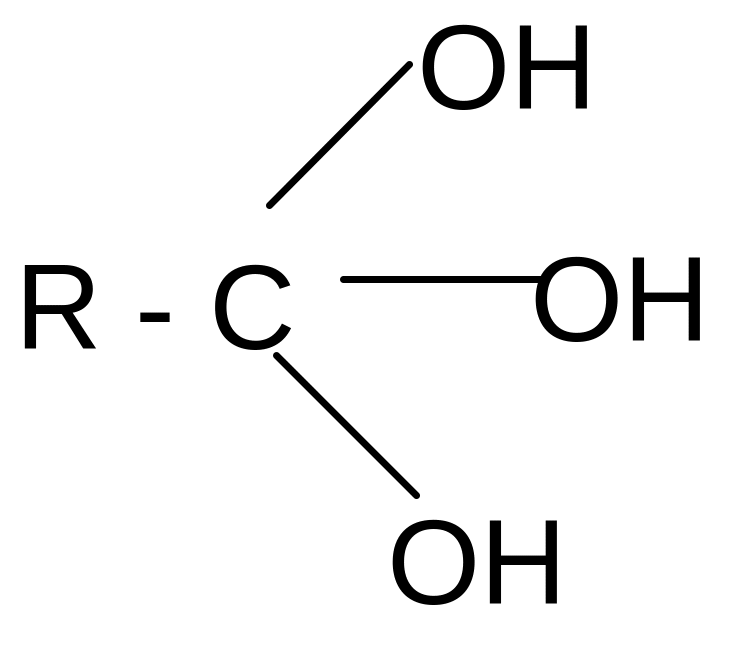 ______
______
HOH
R -C= N + HOH ___
HOH - NH3 -H2O
При образовании функциональных производных карбоновых кислот мы сталкиваемся с двумя видами кислотных радикалов:
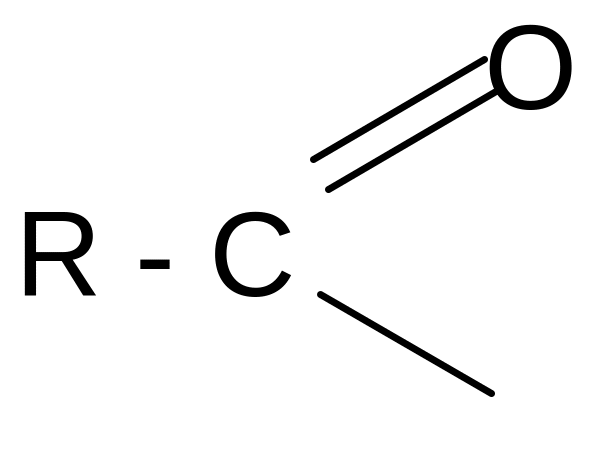

ацил ацилат
-![]() ---------------------------------------------------------------------------------------------
---------------------------------------------------------------------------------------------
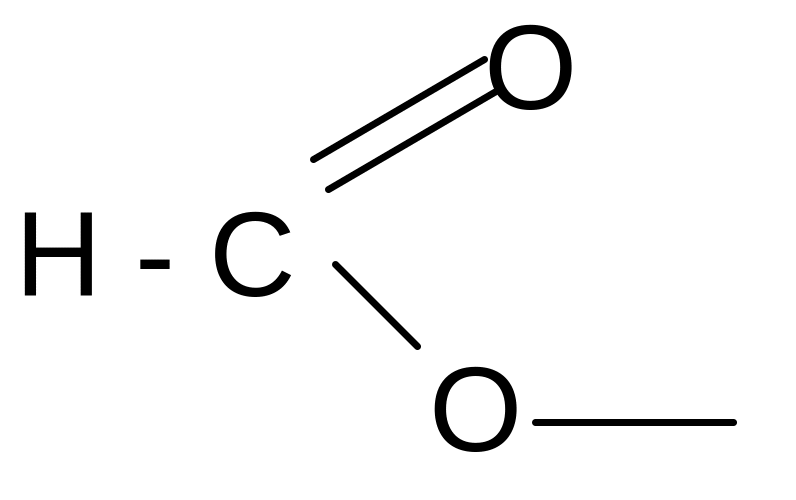
формил формиат
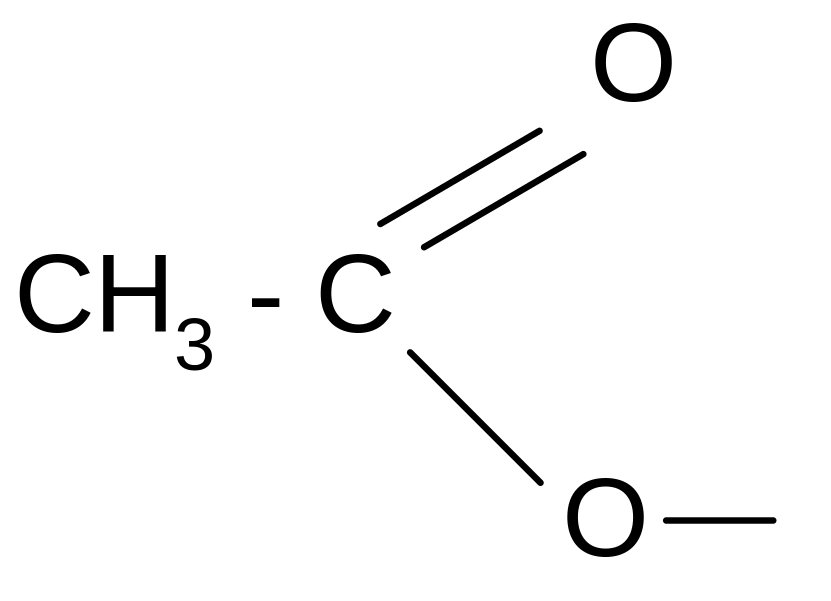
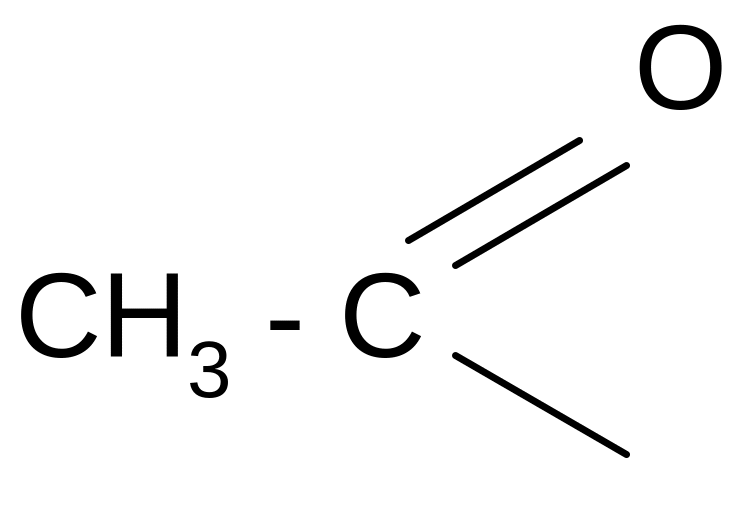
ацетил ацетат
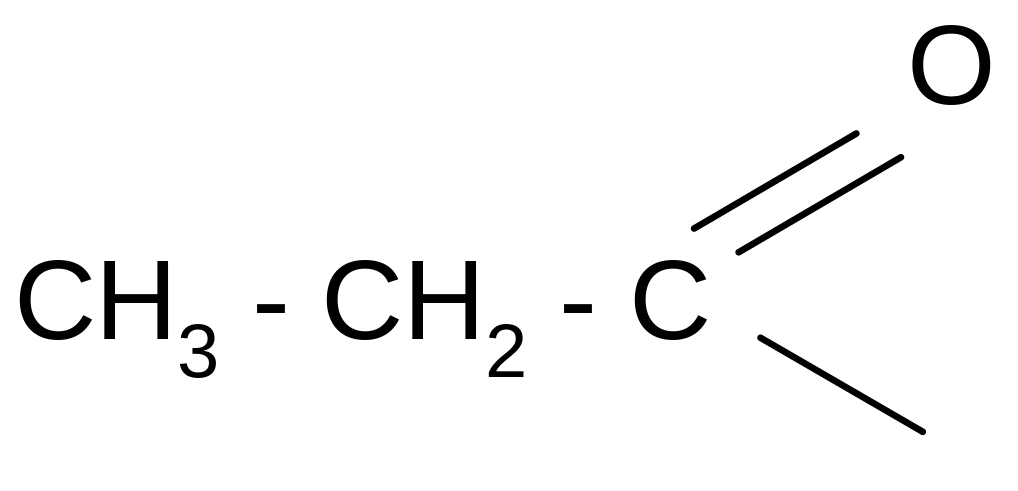
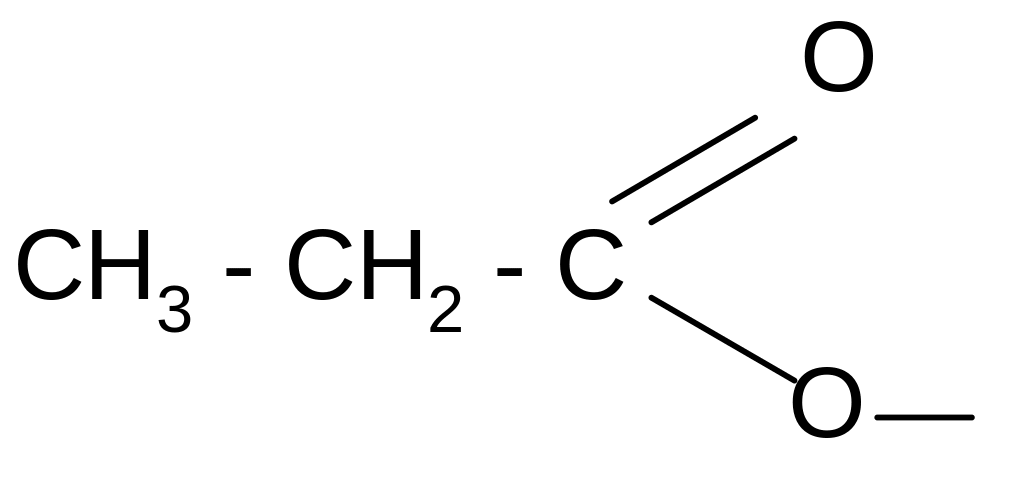
пропионил пропионат

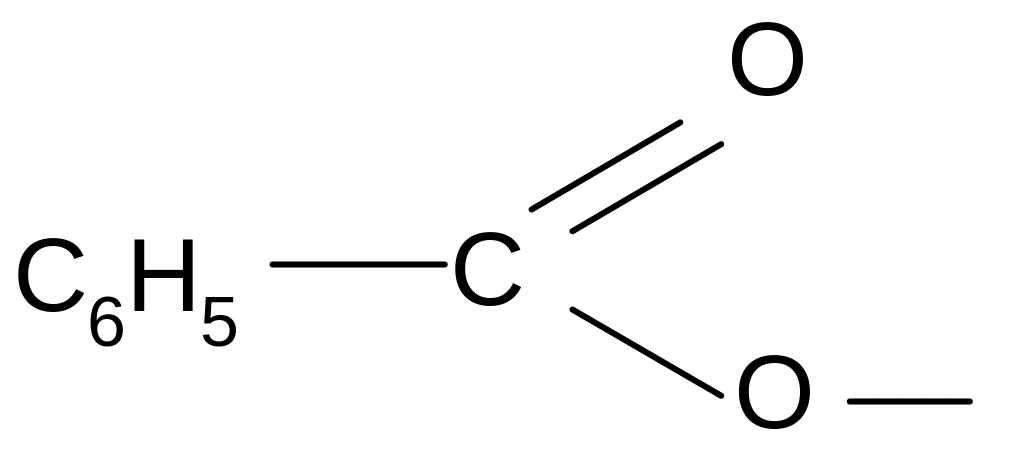
бензоил бензоат
Названия функциональных производных строятся по названию кислотных радикалов.
3. Реакции с участием радикалов монокарбоновых кислот. Углеводородные радикалы в карбоновых кислотах проявляют типичные химические свойства, соответствующие их природе: замещение – в насыщенных и ароматических углеводородных остатках кислот; присоединение, окисление, полимеризация – в ненасыщенных. При этом указанные реакции имеют некоторые особенности, обусловленные наличием карбоксильной группы:
а) галогенирование насыщенных алифатических кислот:
t°
С Н3
– СH2 – СH
– СООН + Br2
CH3 – CH2
– CH – COOH
+ HBr
Н3
– СH2 – СH
– СООН + Br2
CH3 – CH2
– CH – COOH
+ HBr
H Br
Замещение под действием галогенов идет избирательно у - углеродного атома. Это объясняется появлением СН – кислотного центра у - атома углерода под действием – I эффекта карбоксильной группы. Реакция используется для получения гетерофункциональных кислот - -окси и -аминокислот;
б) реакции присоединения к ненасыщенным кислотам: если в ненасыщенных кислотах карбоксильная группа вступает во взаимодействие с двойной связью, образуя систему сопряжения, то благодаря –М эффекту СООН – группы вся -система смещена в сторону СООН – группы, что приводит к нарушению правила Марковникова в реакциях присоединения по двойной связи в углеводородном радикале:
+
![]() -
-
СH2==CH COOH + HBr CH2 – CH – COOH
Br H
в) реакции окисления и полимеризации ненасыщенных кислот: эти реакции протекают аналогично тем же реакциям алкенов:
KMnO4, H2O
 СН2
= СН – СООН СН2 –
СН - СООН
СН2
= СН – СООН СН2 –
СН - СООН
ОН ОН
пропеновая 2,3 –дигидроксипропановая
 (акриловая)
(акриловая)

 n
n
метиловый эфир метакриловой полиметилметакрилат
кислоты (плексиглас, органическое стекло)
г) реакции электрофильного замещения в ароматических кислотах:
Карбоксильная группа за счет (–М) и (–I) - эффектов смещает электронную плотность бензольного кольца и направляет вновь поступающие электрофильные группы преимущественно в мета-положение. Например:
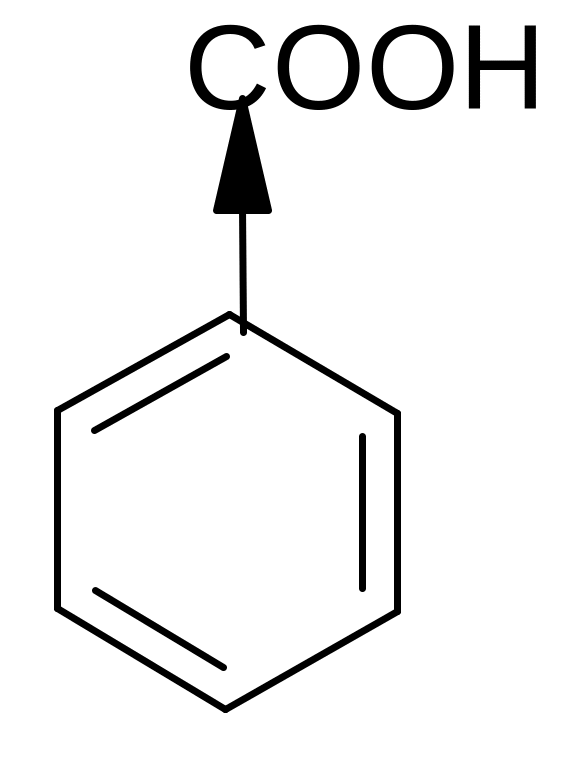
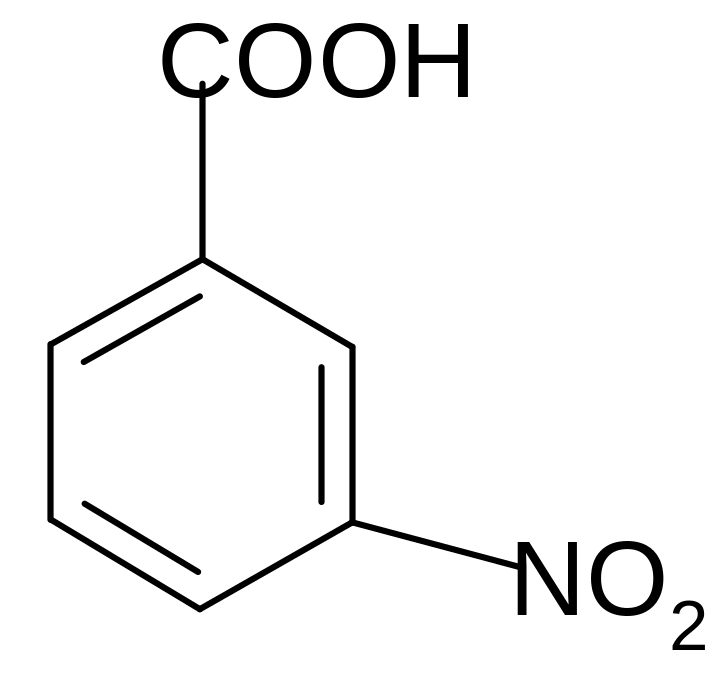
t0
- -![]() + HO – NO2
+ Н2О
+ HO – NO2
+ Н2О
![]()
3 – нитробензойная кислота
