
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Основные направления реакционной способности углеводородов в зависимости от их электронного строения
- •Ковалентная связь
- •Циклоалканы
- •Циклопропан с3н6
- •Транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
- •1. Гидрирование:
- •Пропен пропан
- •2. Галогенирование:
- •3. Гидрогалогенирование:
- •6. Полимеризация:
- •Алкадиены Это углеводороды, содержащие две двойные связи. Общая формула Сn h2n-2.
- •1. Гидрирование:
- •2. Гидрогалогенирование:
- •Ароматические углеводороды (арены)
- •Химические свойства
- •1. Галогенирование:
- •2. Нитрование:
- •3.Сульфирование:
- •4. Алкилирование:
- •Тема 2. Спирты. Фенолы. Нафтолы. Тиолы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Кислотность и основность органических соединений
- •Кислоты тон
- •Одноатомные спирты
- •Дегидрирование альдегид
- •Дегидрирование кетон
- •Многоатомные спирты
- •Спирты высшей атомности
- •Свойства фенолов как ароматических соединений. Реакции электрофильного замещения
- •Нафтолы
- •Ароматические спирты
- •Тема 3. Альдегиды и кетоны
- •Пиридоксаль пиридоксальфосфат
- •Этапы занятия и контроль усвоения знаний
- •I. Реакции нуклеофильного присоединения
- •4. Взаимодействие с галогенсодержащими реагентами
- •II. Реакции за счет -сн2-звена
- •Галогенирование:
- •III. Реакции, характерные только для альдегидов
- •Тема 4. Карбоновые кислоты и их функциональные производные
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этановая кислота 2-метилпропановая бутен-3-овая кислота
- •Малеиновая фумаровая кислота
- •Линолевая кислота
- •2. Реакции нуклеофильного замещения (sn ):
- •Двухосновные карбоновые кислоты
- •Трехосновные кислоты
- •Ноос–сн2–с–сн2–соон лимонная 3-гидрокси – 3-карбокси -
- •Специфические реакции двухосновных кислот
- •Тема 5. Липиды
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Омыляемые липиды
- •Омыляемые липиды
- •Жирные кислоты
- •Простые омыляемые липиды
- •Сложные омыляемые липиды
- •Ф осфолипиды
- •Глицерофосфо- сфингофосфо-
- •Гликолипиды
- •Цереброзиды ганглиозиды
- •Цереброзиды
- •Ганглиозиды
- •Неомыляемые липиды
- •Стероиды
- •Классификация стероидов
- •Эстрадиол
- •Тема 6. Соединения со смешанными функциями
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Оксокислоты
- •2. Кето-енольная таутомерия -оксокислот.
- •Оксокислоты
- •Стереоизомерия
- •(Оптические,
- •Энантиомеры
- •Тема 7. Аминокислоты.
- •III. Биологически важные реакции - аминокислот
- •Тема 8. Углеводы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Тема 8-1. Углеводы. Моносахариды Теория
- •Стереоизомерия моносахаридов
- •Важнейшие природные моносахариды а льдопентозы
- •Альдогексозы Кетогексоза
- •Цикло-цепные таутомеры моносахаридов
- •Перспективные формулы Хеуорса
- •Цикло-цепная таутомерия моносахаридов – это существование в водном растворе смеси таутомерных форм, способных превращаться друг в друга через открытую таутомерную форму:
- •3. Мутаротация сахаров При растворении кристаллической таутомерной формы углевода в воде наблюдается явление мутаротации.
- •4. Конформации моносахаридов
- •5. Эпимеризация
- •6. Химические свойства моносахаридов
- •Реакции, характерные для цепной формы углеводов
- •Кислоты
- •Реакции циклических таутомерных форм моносахаридов
- •Тема 8-2. Ди – и полисахариды
- •Дисахариды
- •Цикло-цепная таутомерия дисахаридов
- •Реакция «серебряного зеркала»:
- •Полисахариды
- •Тема 9. Гетероциклические соединения
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятий и контроль усвоения знаний
- •Содержание этапов занятия
- •Электронное строение «пиррольного» атома азота
- •Шестичленные гетероциклические системы с одним гетероатомом
- •Электронное строение «пиридинового» атома азота
- •Химические свойства
- •Пятичленные гетероциклы с двумя гетероатомами
- •Химические свойства
- •Шестичленные гетероциклические соединения с двумя гетероатомами п иримидин
- •Производные пиримидина
- •Полициклические гетероциклы
- •Триптофан
- •Хинолин и изохинолин
- •Нуклеиновые кислоты
- •Общая схема построения нуклеиновых кислот
- •Нуклеиновые кислоты
- •Нуклеотиды
- •Методические разработки по биоорганической химии
- •Методические разработки по биоорганической химии Санкт-Петербург
Малеиновая фумаровая кислота
кислота транс–изомер
цис–изомер
Ненасыщенные ВЖК чаще всего имеют цис-конфигурацию:

Линолевая кислота
Большей энергетической устойчивостью обладают транс-изомеры.
Физические свойства. Молекулы карбоновых кислот полярны. Они способны, как и спирты, образовывать водородные связи. Температура кипения кислот значительно выше, чем спиртов и альдегидов, так как кислоты образуют ассоциаты за счет межмолекулярных водородных связей линейной и циклической структуры.
 ……
……

…… ... … … …
димерный ассоциат линейный ассоциат
Низшие карбоновые кислоты (С1 – С9) представляют собой жидкости, высшие алифатические и ароматические кислоты – твердые вещества. Первые гомологи – муравьиная, уксусная и пропионовая кислоты – обладают резким раздражающим запахом, при попадании на слизистые оболочки вызывают ожоги, с водой смешиваются в любых соотношениях. По мере увеличения гидрофобной углеводородной части молекулы растворимость в воде уменьшается. Двухосновные кислоты – бесцветные кристаллические вещества, растворимые в воде.
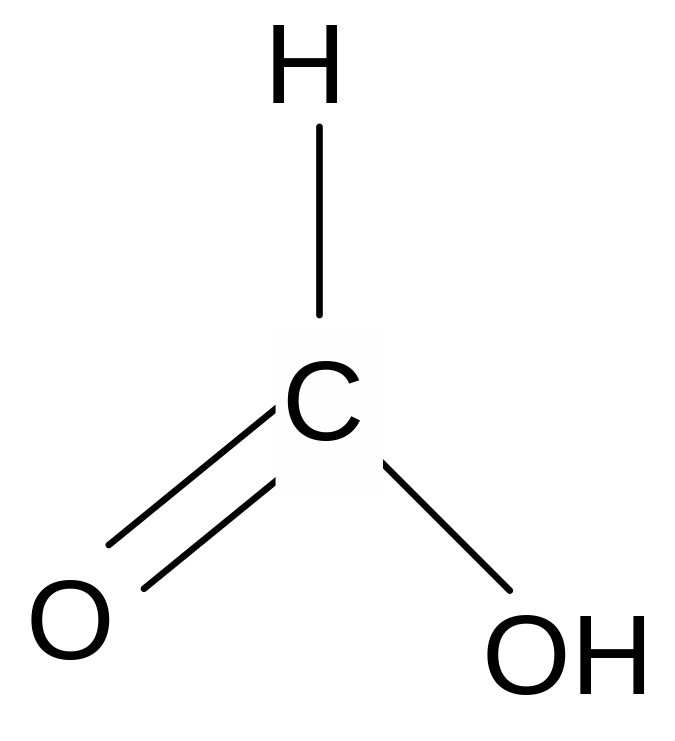
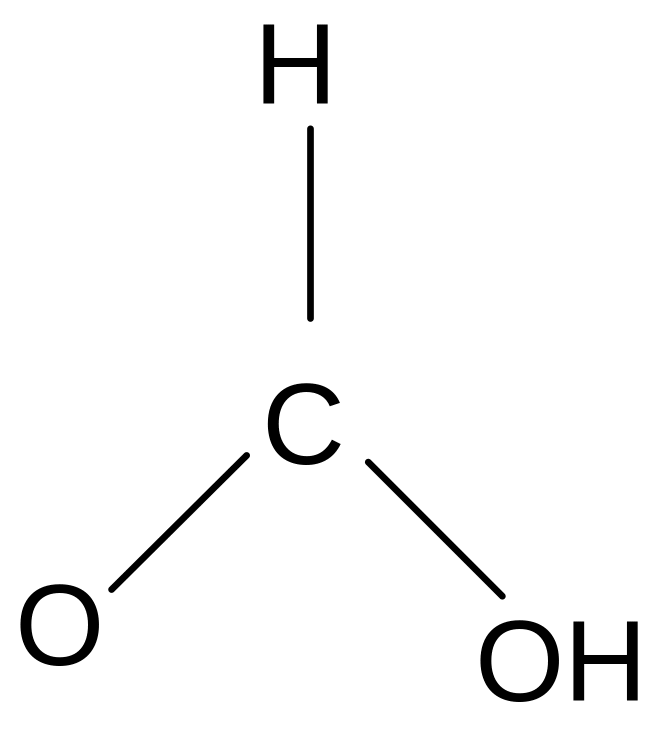
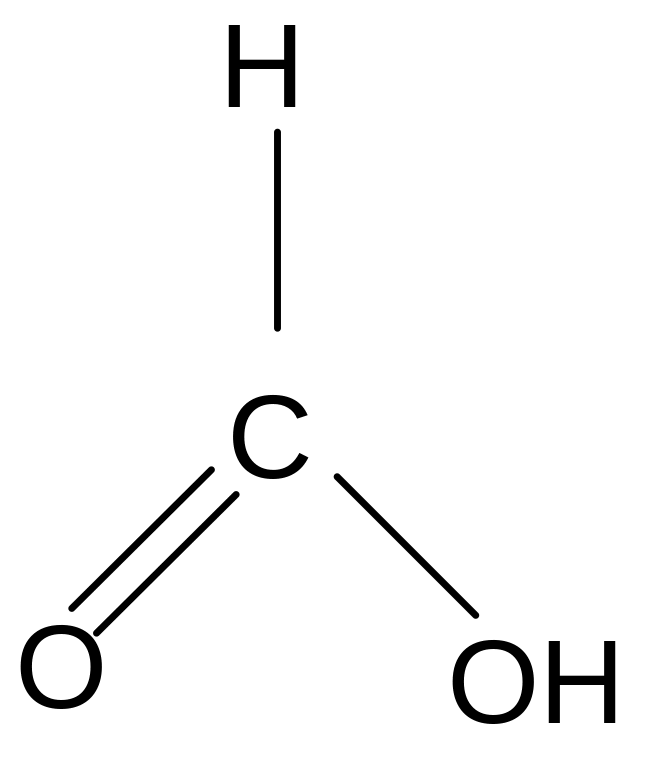
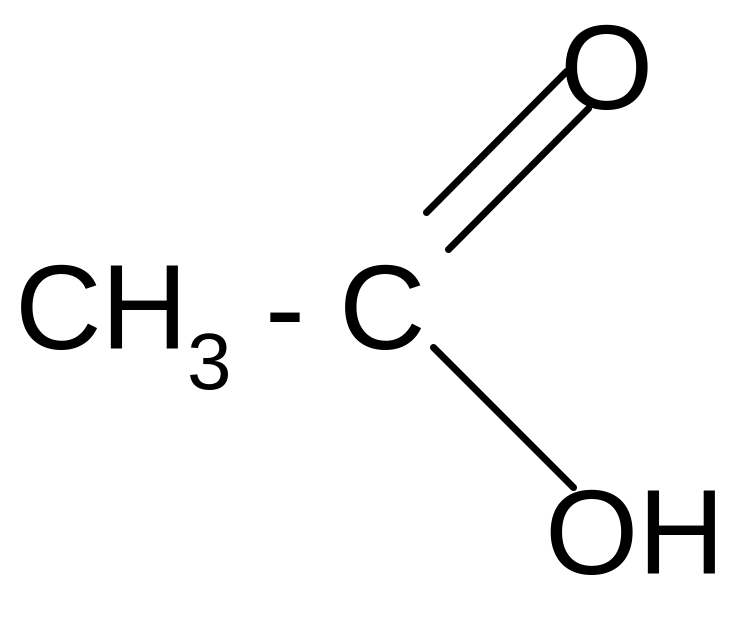
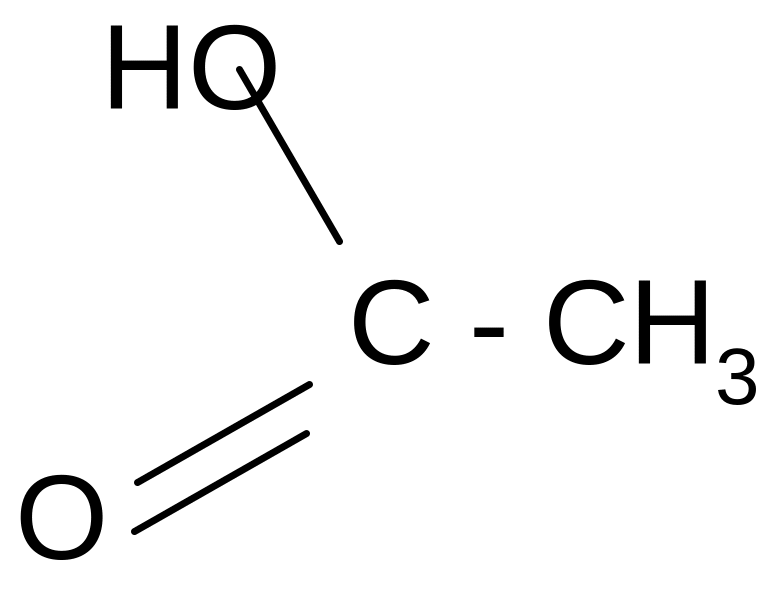
Химические свойства. Карбоксильная группа карбоновых кислот имеет сложное строение: она состоит из карбонильной группы С = О и гидроксильной группы –ОН, которые влияют друг на друга.
Благодаря +M –эффекту ОН - группы в карбоксильной группе возникает -сопряжение, происходит выравнивание электронной плотности в ней и сведение полярности карбонильной группы до минимума. Этим объясняется инертность карбонильной группы в кислотах. +М –эффект гидроксильной группы объясняет также смещение электронной плотности в ней в сторону более электроотрицательного атома кислорода и диссоциацию кислот.
( -
I) – эффект гидроксильной
группы поляризует связь СОН
и делает возможным ее отщепление: группа
ОН может отщепляться, что обусловливает
реакции нуклеофильного замещения. Таким
образом, главные реакции идут либо за
счет замещения ОН - группы, либо за счет
водорода этой группы:
-
I) – эффект гидроксильной
группы поляризует связь СОН
и делает возможным ее отщепление: группа
ОН может отщепляться, что обусловливает
реакции нуклеофильного замещения. Таким
образом, главные реакции идут либо за
счет замещения ОН - группы, либо за счет
водорода этой группы:
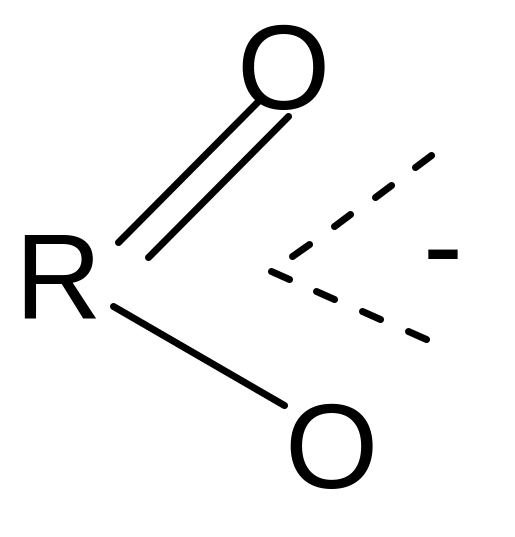
Кислотные свойства Сила карбоновых кислот зависит от стабильности аниона, образующегося после отрыва протона. Стабильность аниона определяется прежде всего степенью делокализации отрицательного заряда: чем выше степень делокализации, тем стабильнее анион.
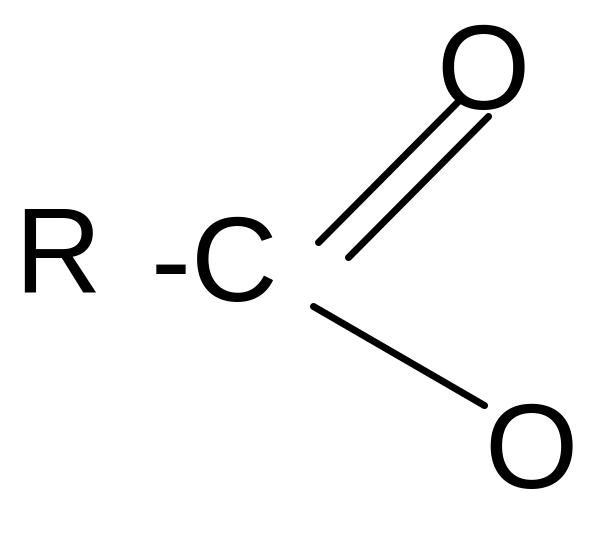
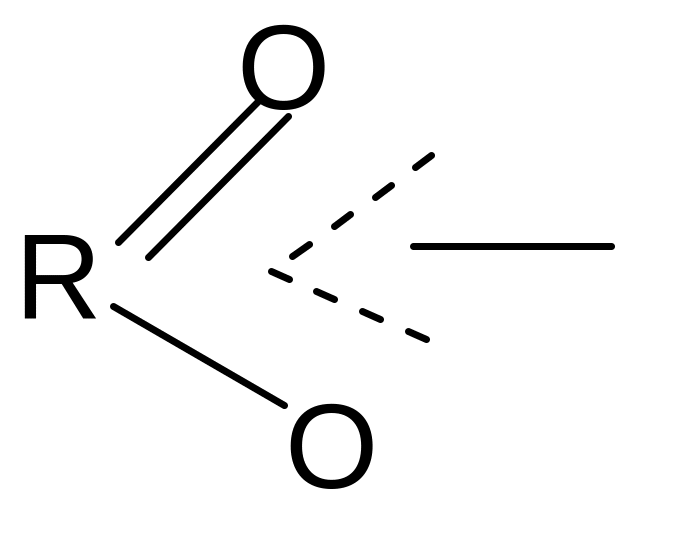
В карбоксилат-анионе заряд делокализуется по сопряженной системе, т. е. равномерно распределяется между двумя атомами кислорода карбоксилат–аниона, что придает ему стабильность:
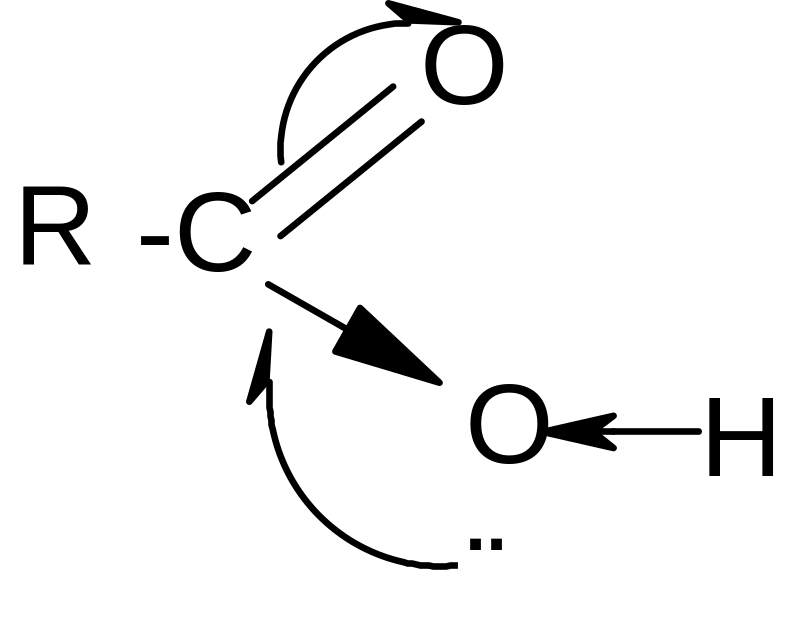
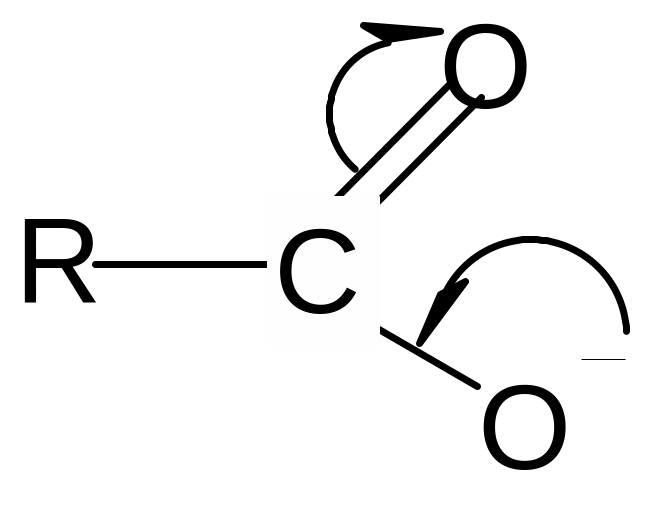
+ Н+
 O
O
 R – C
R – C
 (-)
(-)
 (–)
O
(–)
O
В рамках класса сила кислот зависит от строения углеводородных радикалов и заместителей в них. Электронодонорные заместители ослабляют кислотные свойства, т.к. дестабилизируют карбоксилат–анион; электроноакцепторные заместители, оттягивая электронную плотность, способствуют делокализации заряда в карбоксилат – анионе и тем самым стабилизируют его, т.е. усиливают кислотные свойства.
Так, при введении в углеводородный радикал уксусной кислоты атомов хлора кислотность будет увеличиваться за счет электроноакцепторных свойств атома хлора:
Cl
СН3СООН СН2СООН СlСНСООН СlССООН
Сl Cl Cl
рКа 4,76 2,85 1,25 0,66
Ароматические кислоты имеют более сильные кислотные свойства, чем незамещенные алифатические (для бензойной кислоты С6Н5-СООН рКа=4,19) – сказывается электронное влияние фенильного радикала (-I).
Кислотные свойства проявляются в реакции нейтрализации:
С
 Н3
– СООН + NaOH
CH3COONa
+ H2O
Н3
– СООН + NaOH
CH3COONa
+ H2O
