
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Основные направления реакционной способности углеводородов в зависимости от их электронного строения
- •Ковалентная связь
- •Циклоалканы
- •Циклопропан с3н6
- •Транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
- •1. Гидрирование:
- •Пропен пропан
- •2. Галогенирование:
- •3. Гидрогалогенирование:
- •6. Полимеризация:
- •Алкадиены Это углеводороды, содержащие две двойные связи. Общая формула Сn h2n-2.
- •1. Гидрирование:
- •2. Гидрогалогенирование:
- •Ароматические углеводороды (арены)
- •Химические свойства
- •1. Галогенирование:
- •2. Нитрование:
- •3.Сульфирование:
- •4. Алкилирование:
- •Тема 2. Спирты. Фенолы. Нафтолы. Тиолы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Кислотность и основность органических соединений
- •Кислоты тон
- •Одноатомные спирты
- •Дегидрирование альдегид
- •Дегидрирование кетон
- •Многоатомные спирты
- •Спирты высшей атомности
- •Свойства фенолов как ароматических соединений. Реакции электрофильного замещения
- •Нафтолы
- •Ароматические спирты
- •Тема 3. Альдегиды и кетоны
- •Пиридоксаль пиридоксальфосфат
- •Этапы занятия и контроль усвоения знаний
- •I. Реакции нуклеофильного присоединения
- •4. Взаимодействие с галогенсодержащими реагентами
- •II. Реакции за счет -сн2-звена
- •Галогенирование:
- •III. Реакции, характерные только для альдегидов
- •Тема 4. Карбоновые кислоты и их функциональные производные
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этановая кислота 2-метилпропановая бутен-3-овая кислота
- •Малеиновая фумаровая кислота
- •Линолевая кислота
- •2. Реакции нуклеофильного замещения (sn ):
- •Двухосновные карбоновые кислоты
- •Трехосновные кислоты
- •Ноос–сн2–с–сн2–соон лимонная 3-гидрокси – 3-карбокси -
- •Специфические реакции двухосновных кислот
- •Тема 5. Липиды
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Омыляемые липиды
- •Омыляемые липиды
- •Жирные кислоты
- •Простые омыляемые липиды
- •Сложные омыляемые липиды
- •Ф осфолипиды
- •Глицерофосфо- сфингофосфо-
- •Гликолипиды
- •Цереброзиды ганглиозиды
- •Цереброзиды
- •Ганглиозиды
- •Неомыляемые липиды
- •Стероиды
- •Классификация стероидов
- •Эстрадиол
- •Тема 6. Соединения со смешанными функциями
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Оксокислоты
- •2. Кето-енольная таутомерия -оксокислот.
- •Оксокислоты
- •Стереоизомерия
- •(Оптические,
- •Энантиомеры
- •Тема 7. Аминокислоты.
- •III. Биологически важные реакции - аминокислот
- •Тема 8. Углеводы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Тема 8-1. Углеводы. Моносахариды Теория
- •Стереоизомерия моносахаридов
- •Важнейшие природные моносахариды а льдопентозы
- •Альдогексозы Кетогексоза
- •Цикло-цепные таутомеры моносахаридов
- •Перспективные формулы Хеуорса
- •Цикло-цепная таутомерия моносахаридов – это существование в водном растворе смеси таутомерных форм, способных превращаться друг в друга через открытую таутомерную форму:
- •3. Мутаротация сахаров При растворении кристаллической таутомерной формы углевода в воде наблюдается явление мутаротации.
- •4. Конформации моносахаридов
- •5. Эпимеризация
- •6. Химические свойства моносахаридов
- •Реакции, характерные для цепной формы углеводов
- •Кислоты
- •Реакции циклических таутомерных форм моносахаридов
- •Тема 8-2. Ди – и полисахариды
- •Дисахариды
- •Цикло-цепная таутомерия дисахаридов
- •Реакция «серебряного зеркала»:
- •Полисахариды
- •Тема 9. Гетероциклические соединения
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятий и контроль усвоения знаний
- •Содержание этапов занятия
- •Электронное строение «пиррольного» атома азота
- •Шестичленные гетероциклические системы с одним гетероатомом
- •Электронное строение «пиридинового» атома азота
- •Химические свойства
- •Пятичленные гетероциклы с двумя гетероатомами
- •Химические свойства
- •Шестичленные гетероциклические соединения с двумя гетероатомами п иримидин
- •Производные пиримидина
- •Полициклические гетероциклы
- •Триптофан
- •Хинолин и изохинолин
- •Нуклеиновые кислоты
- •Общая схема построения нуклеиновых кислот
- •Нуклеиновые кислоты
- •Нуклеотиды
- •Методические разработки по биоорганической химии
- •Методические разработки по биоорганической химии Санкт-Петербург
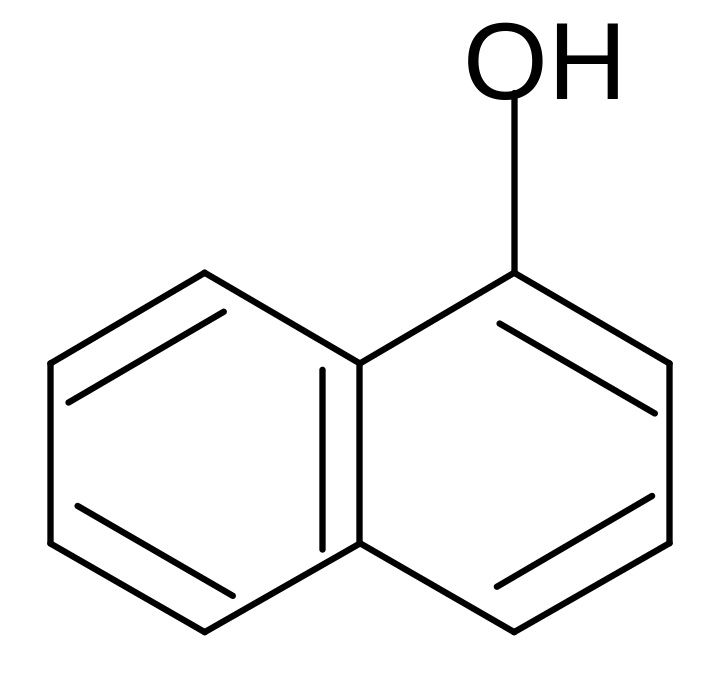
Нафтолы
Н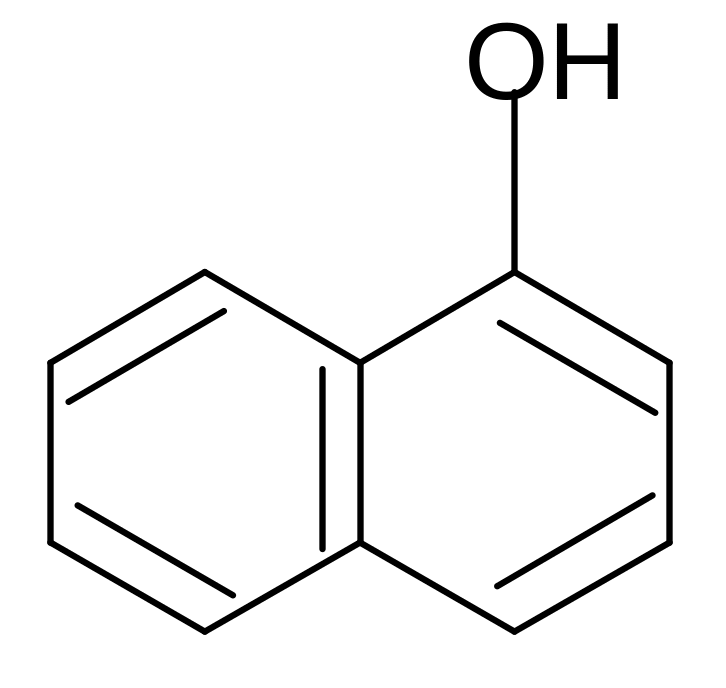 аибольший
интерес представляют гидроксипроизводные
нафталина – - и
-нафтолы:
аибольший
интерес представляют гидроксипроизводные
нафталина – - и
-нафтолы:

- нафтол - нафтол
О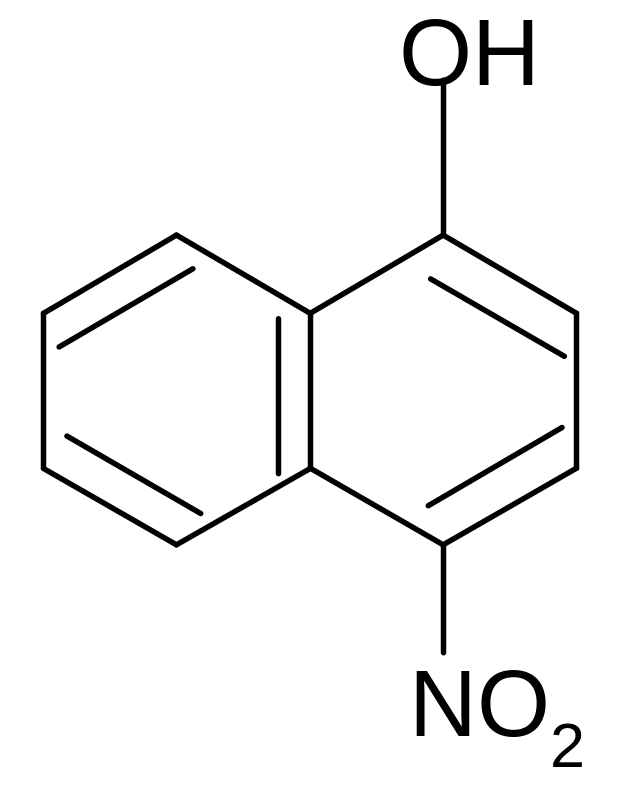 ни
обладают свойствами фенолов, растворяются
в едких щелочах. Оба вещества трудно
растворяются в воде, дают окрашивание
с хлорным железом. Реакции замещения
нафтолов идут сначала в том же ядре, где
находится оксигруппа:
ни
обладают свойствами фенолов, растворяются
в едких щелочах. Оба вещества трудно
растворяются в воде, дают окрашивание
с хлорным железом. Реакции замещения
нафтолов идут сначала в том же ядре, где
находится оксигруппа:
+ HNO3 +H2O
4-нитро--нафтол
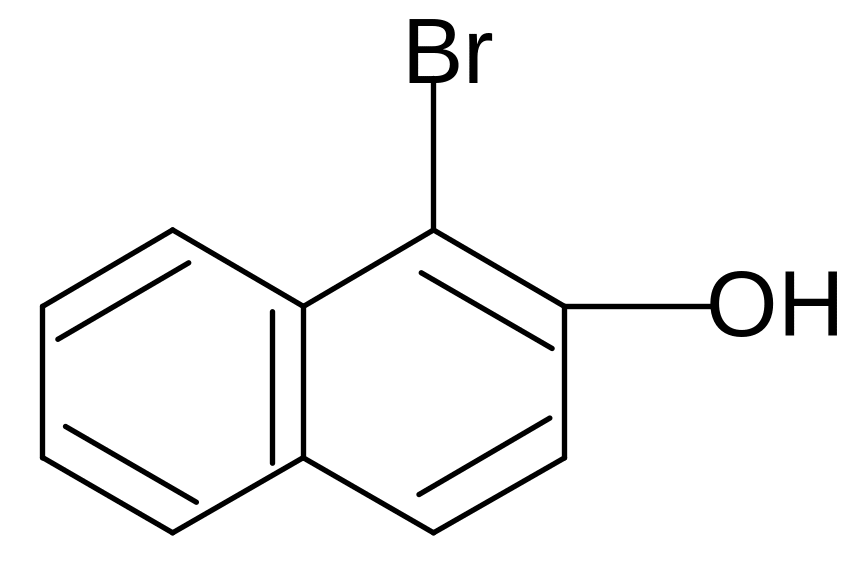
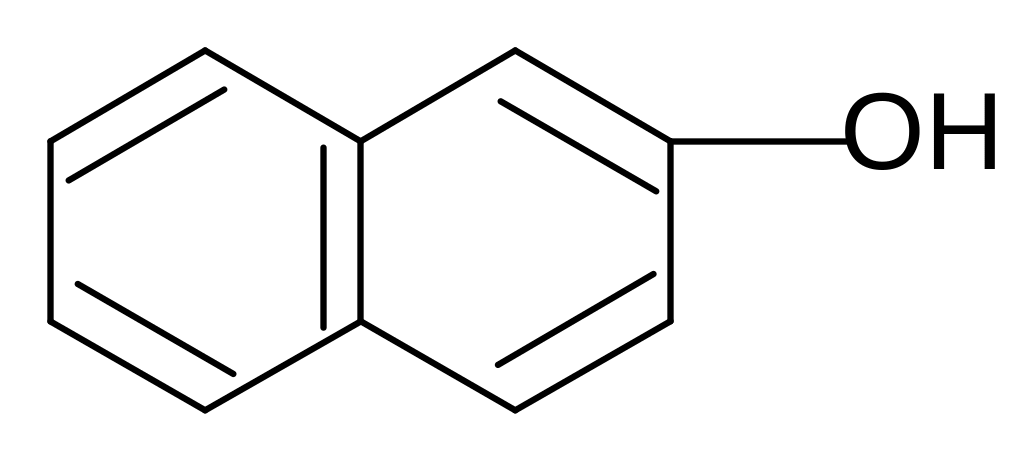
+ Br2
-HBr
-бром--нафтол
Нафтолы и их производные, особенно сульфопроизводные, широко используются в производстве азокрасителей.
Ароматические спирты
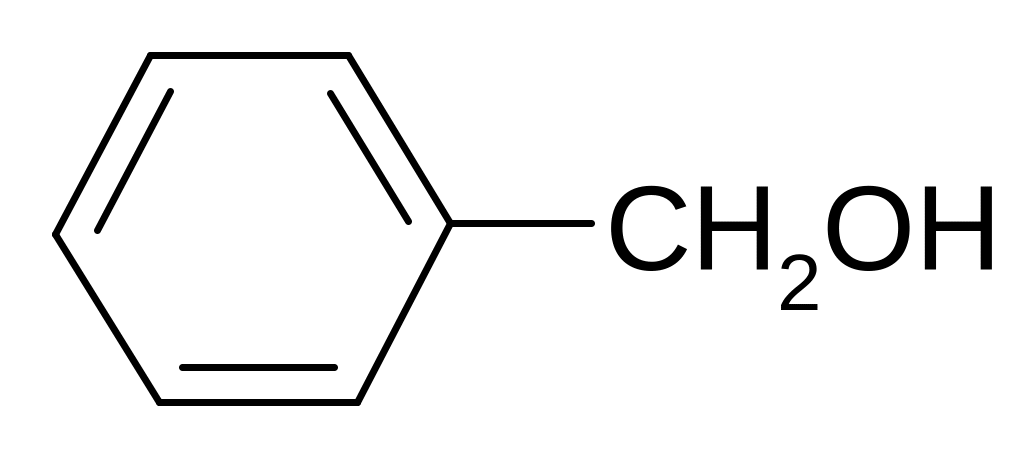
Если гидроксильная группа удалена от ароматического ядра, то соединение относят к ароматическим спиртам. Гидролизом хлористого бензила может быть получен бензиловый спирт:
 +НОН
+НОН
+ HСl
ОНˉ
бензиловый спирт
Для них характерны как обычные реакции спиртового (но не фенольного гидроксила), так и реакции ароматического ядра (группа СН2ОН является заместителем первого рода, т.е. электронодонором). -Фенилэтиловый спирт Н5С6-СН2-СН2-ОН является основным компонентом природного розового масла и широко используется в парфюмерии.
Тиолы
Подобно тому, как спирты и простые эфиры являются органическими аналогами воды, тиолы (тиоспирты) или меркаптаны (R-SH), и сульфиды (R-S-R) представляют собой органические аналоги сероводорода.
Н-О-Н вода |
Н-S-H сероводород |
R – O-H спирт R-O-R простой эфир H-O-O-H пероксид водорода |
R-S-H тиол R-S-R сульфид R-S-S-R -дисульфид |
Несколько типичных представителей подобных соединений:
СН3-SH метантиол (метил меркаптан)
C6H5-SH тиофенол
CH3-S-CH3 диметилсульфид
CH3-S-С6Н5 метилфенилсульфид
CH3-S-S-CH3 диметилдисульфид
Тиолы обладают характерным, очень навязчивым запахом, более сильным и неприятным, чем запах сероводорода. Для низших тиолов запах ощущается при концентрации 1 часть на 400 млн. частей воздуха. Добавкой к природному газу ничтожных количеств изопентантиола пользуются для лучшего обнаружения по запаху утечки газа в жилых помещениях. Тиолы и их производные встречаются в растительном и животном мире, например пропантиол С3Н7SH – в свеженарезанном луке, бутантиол C4H9SH – в выделениях скунса. Сера входит в состав некоторых белковых аминокислот (цистеин, цистин, метионин). Тиоспирты – жидкости с температурой кипения более низкой, чем у соответствующих спиртов. Это объясняется меньшей склонностью тиолов к образованию межмолекулярной водородной связи.
Меркаптаны плохо растворимы в воде.
Химические свойства
Кислотность тиоспиртов выше, чем у спиртов, поэтому они в отличие от последних образуют соли не только со свободными металлами, но и со щелочами; соли их гидролизуются водой.
СH3-CH2-SH + KOH CH3-CH2-SK + H2O
этилмеркаптан этилмеркаптид
калия
С тяжелыми металлами (ртуть, мышьяк, свинец, кадмий, цинк) и их окислами тиолы образуют нерастворимые соли – меркаптиды
2 СН3-СН2-SH + HgO (CH3-CH2-S)2Hg
-H2O этилмеркаптид ртути
Способность тиолов связывать ионы тяжелых металлов позволяет использовать их как противоядия (антидоты) при отравлениях соединениями этих металлов. Одним из таких препаратов является отечественный препарат унитиол (димеркаптопропансульфонат натрия):
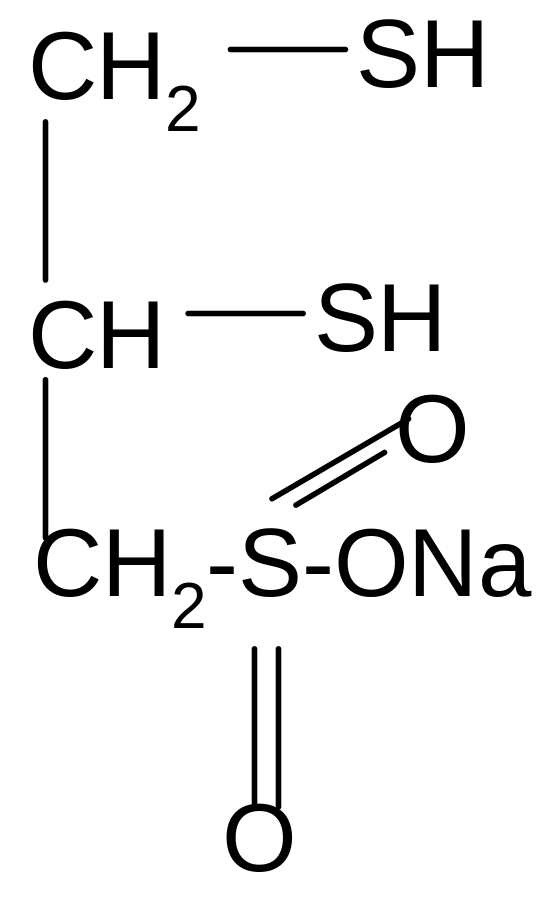
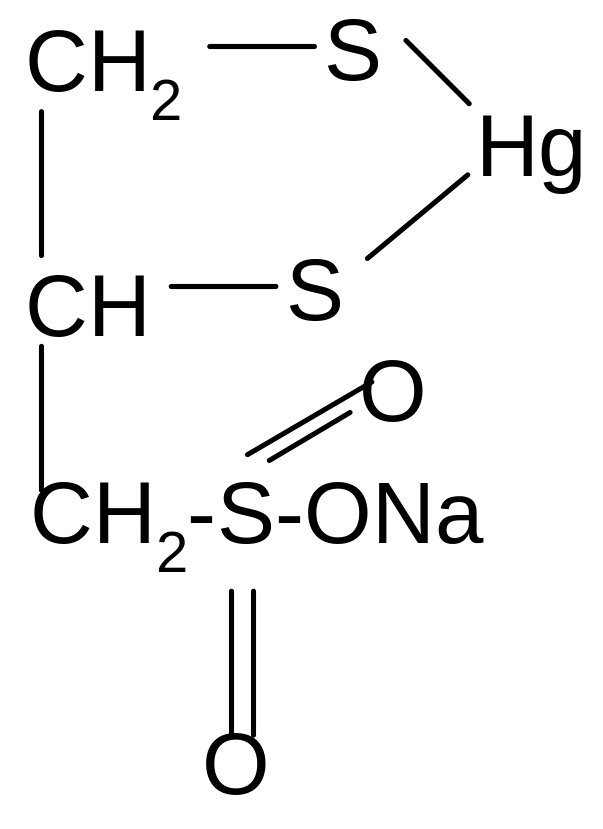
+ HgCl2 + 2HCl
Меркаптаны в отличие от спиртов окисляются даже на воздухе с образованием диалкилдисульфида:
O
H 3C-CH2-SH + CH3-CH2-SH CH3-CH2-S-S-CH2-CH3 + H2O
диэтилдисульфид
Дисульфиды легко восстанавливаются в тиолы. Процесс окисления тиолов и восстановления дисульфидов играет важную роль в химии белков и пептидов. При жестком окислении тиолов (азотной кислотой) образуются сульфокислоты:
O
С H3SH CH3SO3H
метантиол метансульфокислота
Аналогично спиртам тиолы реагируют с хлористыми ацилами образуя тиоаналоги сложных эфиров:
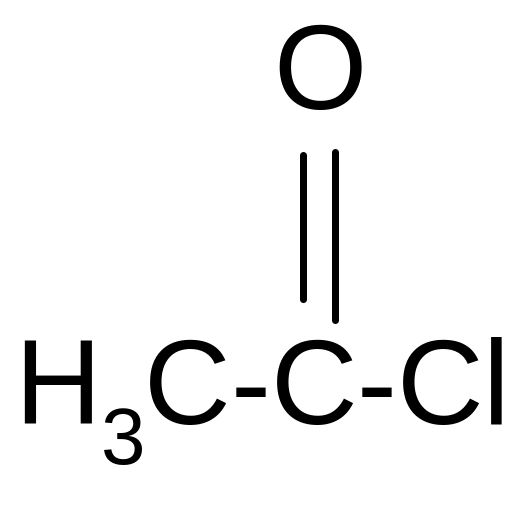
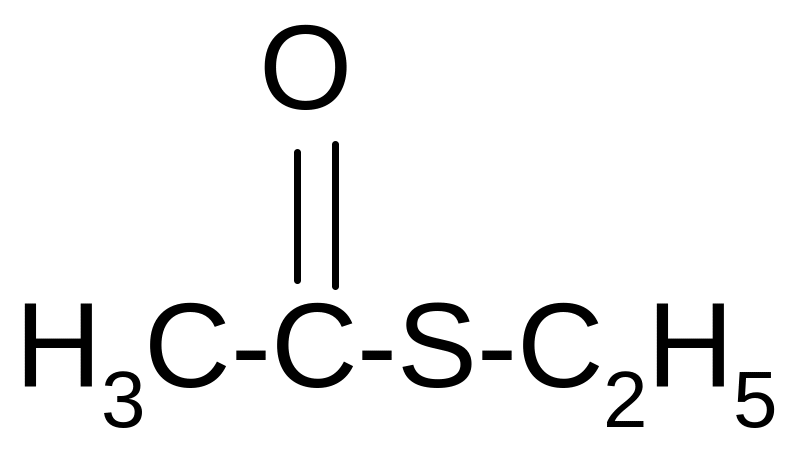
+ C2H5SH + HCl
этилтиоацетат
К классу сульфидов относится боевое отравляющее вещество кожно-нарывного действия иприт (, 1-дихлордиэтилсульфид). Это бесцветная жидкость с чесночным запахом. Для дегазации иприта используется хлорная известь или хлорамин. Дегазаторы превращают иприт в сульфоксид и другие вещества. Получают иприт при действии на этилен хлористой серы:
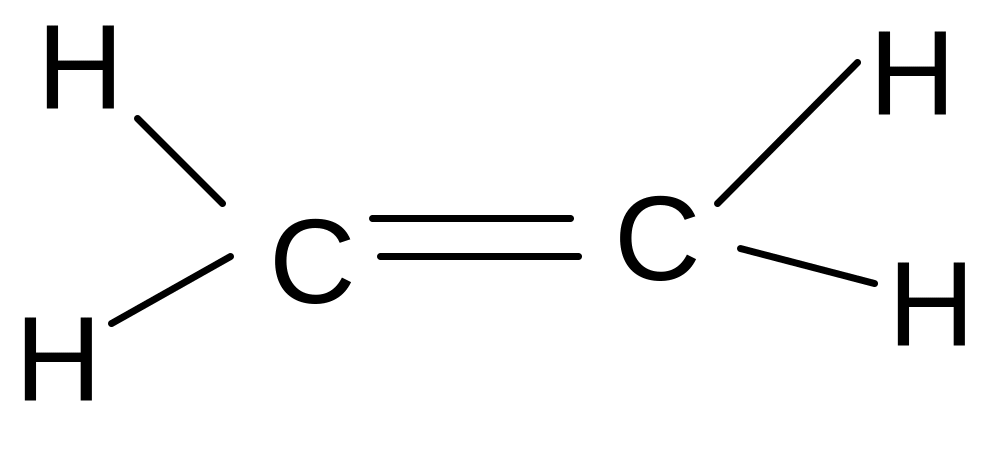
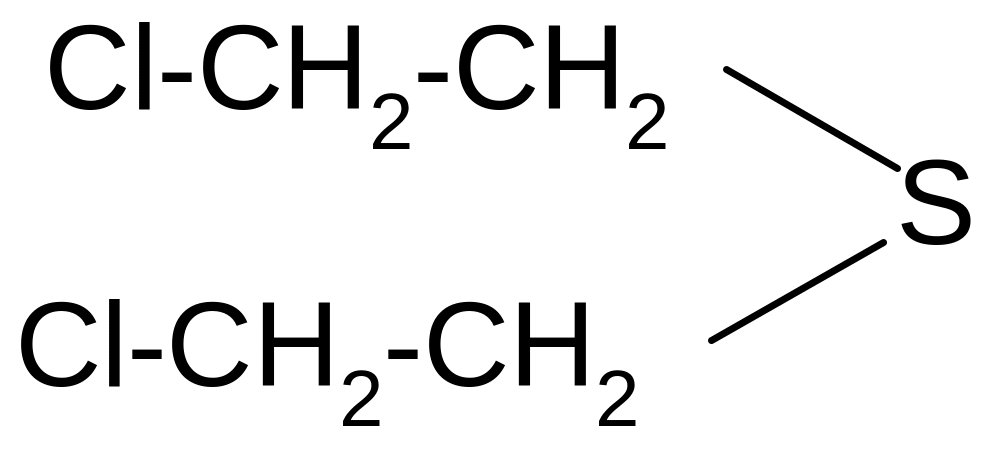
2 + S2Cl2 S +
