
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Основные направления реакционной способности углеводородов в зависимости от их электронного строения
- •Ковалентная связь
- •Циклоалканы
- •Циклопропан с3н6
- •Транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
- •1. Гидрирование:
- •Пропен пропан
- •2. Галогенирование:
- •3. Гидрогалогенирование:
- •6. Полимеризация:
- •Алкадиены Это углеводороды, содержащие две двойные связи. Общая формула Сn h2n-2.
- •1. Гидрирование:
- •2. Гидрогалогенирование:
- •Ароматические углеводороды (арены)
- •Химические свойства
- •1. Галогенирование:
- •2. Нитрование:
- •3.Сульфирование:
- •4. Алкилирование:
- •Тема 2. Спирты. Фенолы. Нафтолы. Тиолы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Кислотность и основность органических соединений
- •Кислоты тон
- •Одноатомные спирты
- •Дегидрирование альдегид
- •Дегидрирование кетон
- •Многоатомные спирты
- •Спирты высшей атомности
- •Свойства фенолов как ароматических соединений. Реакции электрофильного замещения
- •Нафтолы
- •Ароматические спирты
- •Тема 3. Альдегиды и кетоны
- •Пиридоксаль пиридоксальфосфат
- •Этапы занятия и контроль усвоения знаний
- •I. Реакции нуклеофильного присоединения
- •4. Взаимодействие с галогенсодержащими реагентами
- •II. Реакции за счет -сн2-звена
- •Галогенирование:
- •III. Реакции, характерные только для альдегидов
- •Тема 4. Карбоновые кислоты и их функциональные производные
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этановая кислота 2-метилпропановая бутен-3-овая кислота
- •Малеиновая фумаровая кислота
- •Линолевая кислота
- •2. Реакции нуклеофильного замещения (sn ):
- •Двухосновные карбоновые кислоты
- •Трехосновные кислоты
- •Ноос–сн2–с–сн2–соон лимонная 3-гидрокси – 3-карбокси -
- •Специфические реакции двухосновных кислот
- •Тема 5. Липиды
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Омыляемые липиды
- •Омыляемые липиды
- •Жирные кислоты
- •Простые омыляемые липиды
- •Сложные омыляемые липиды
- •Ф осфолипиды
- •Глицерофосфо- сфингофосфо-
- •Гликолипиды
- •Цереброзиды ганглиозиды
- •Цереброзиды
- •Ганглиозиды
- •Неомыляемые липиды
- •Стероиды
- •Классификация стероидов
- •Эстрадиол
- •Тема 6. Соединения со смешанными функциями
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Оксокислоты
- •2. Кето-енольная таутомерия -оксокислот.
- •Оксокислоты
- •Стереоизомерия
- •(Оптические,
- •Энантиомеры
- •Тема 7. Аминокислоты.
- •III. Биологически важные реакции - аминокислот
- •Тема 8. Углеводы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Тема 8-1. Углеводы. Моносахариды Теория
- •Стереоизомерия моносахаридов
- •Важнейшие природные моносахариды а льдопентозы
- •Альдогексозы Кетогексоза
- •Цикло-цепные таутомеры моносахаридов
- •Перспективные формулы Хеуорса
- •Цикло-цепная таутомерия моносахаридов – это существование в водном растворе смеси таутомерных форм, способных превращаться друг в друга через открытую таутомерную форму:
- •3. Мутаротация сахаров При растворении кристаллической таутомерной формы углевода в воде наблюдается явление мутаротации.
- •4. Конформации моносахаридов
- •5. Эпимеризация
- •6. Химические свойства моносахаридов
- •Реакции, характерные для цепной формы углеводов
- •Кислоты
- •Реакции циклических таутомерных форм моносахаридов
- •Тема 8-2. Ди – и полисахариды
- •Дисахариды
- •Цикло-цепная таутомерия дисахаридов
- •Реакция «серебряного зеркала»:
- •Полисахариды
- •Тема 9. Гетероциклические соединения
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятий и контроль усвоения знаний
- •Содержание этапов занятия
- •Электронное строение «пиррольного» атома азота
- •Шестичленные гетероциклические системы с одним гетероатомом
- •Электронное строение «пиридинового» атома азота
- •Химические свойства
- •Пятичленные гетероциклы с двумя гетероатомами
- •Химические свойства
- •Шестичленные гетероциклические соединения с двумя гетероатомами п иримидин
- •Производные пиримидина
- •Полициклические гетероциклы
- •Триптофан
- •Хинолин и изохинолин
- •Нуклеиновые кислоты
- •Общая схема построения нуклеиновых кислот
- •Нуклеиновые кислоты
- •Нуклеотиды
- •Методические разработки по биоорганической химии
- •Методические разработки по биоорганической химии Санкт-Петербург
Спирты высшей атомности
Четырех-(тетриты), пяти-(пентиты) и шестиатомные (гекситы) спирты могут быть получены из простых сахаров при восстановлении.
СH2-OH CH2OH CH2OH СН2ОН
CH-OH H-C-OH H-C-OH Н-С-ОН
CH-OH HO-C-H HO-C-H НО-С-Н
CH2OH H-C-OH H-C-OH НО-С-Н
CH2OH H-C-OH Н-С-ОН
эритрит ксилит
СН2ОН СН2ОН
сорбит дульцит
Эти спирты являются заменителями сахара при заболевании сахарным диабетом.
В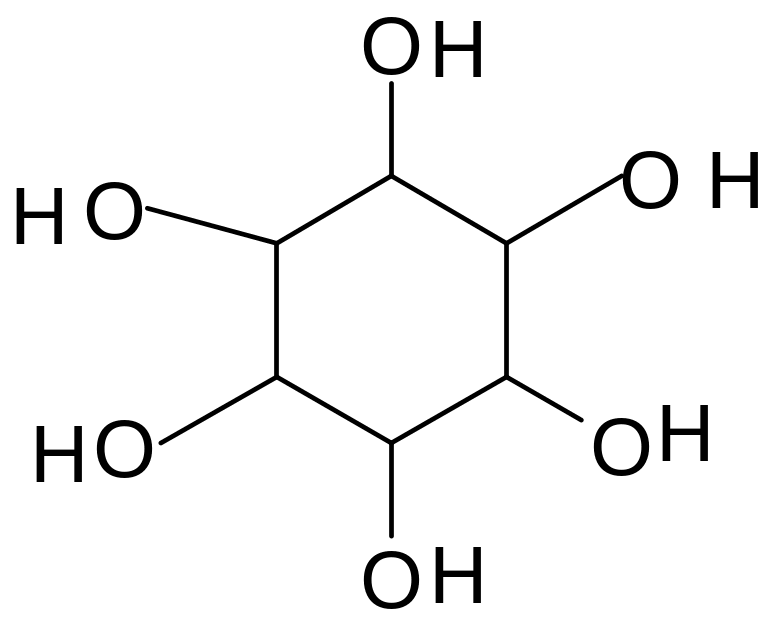 составе животных организмов (печень,
почки, мозг, мышцы и т.д.), а также ряде
растений (бобы, горох и т.д.) содержится
циклический шестиатомный спирт инозит
(циклогексангексол):
составе животных организмов (печень,
почки, мозг, мышцы и т.д.), а также ряде
растений (бобы, горох и т.д.) содержится
циклический шестиатомный спирт инозит
(циклогексангексол):
Фенолы
Фенолы – гидроксилсодержащие ароматические соединения, в молекулах которых гидроксил связан непосредственно с углеродным атомом бензольного ядра. По числу гидроксильных групп различают одно-, двух- и многоатомные фенолы:
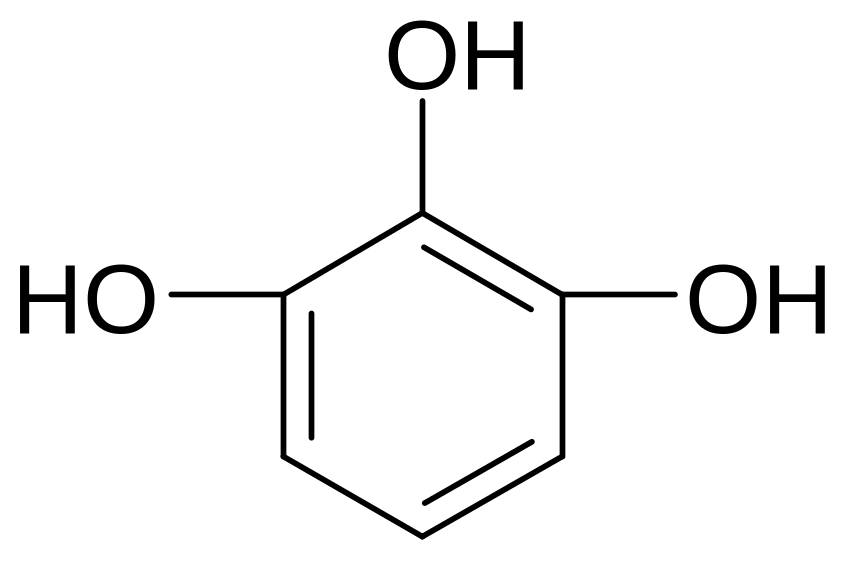
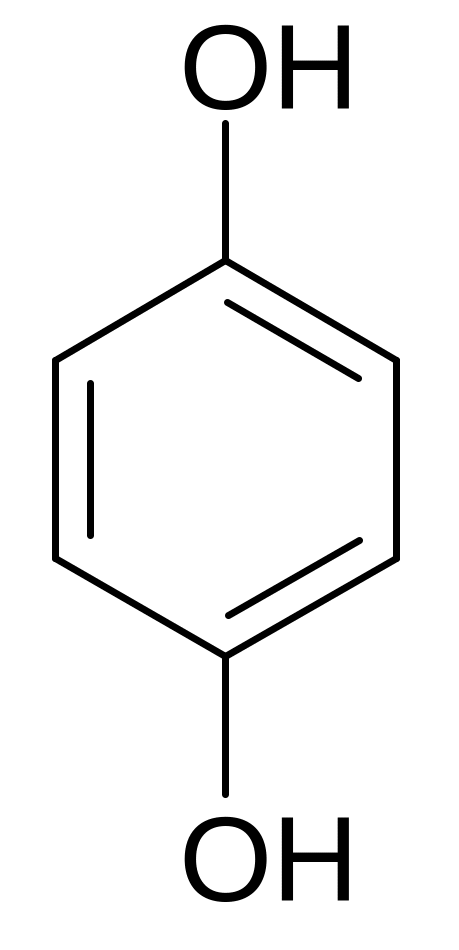

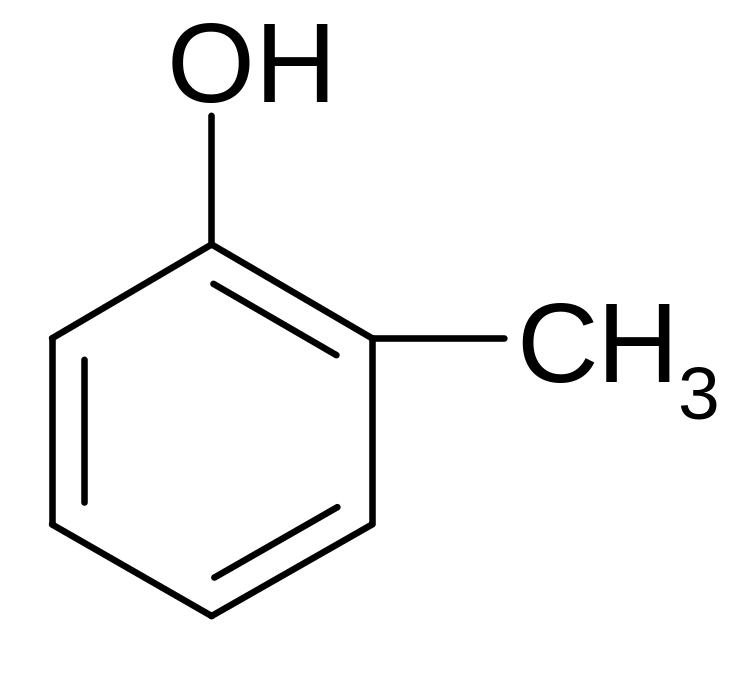
фенол о-крезол гидрохинон пирогаллол
(гидрокси- (2-гидрокси- (1,4-дигидро- (1,2,3-тригидрокси-
бензол) толуол) ксибензол) бензол)
Изомерия 2-х атомных фенолов обусловлена взаимным расположением гидроксилов:


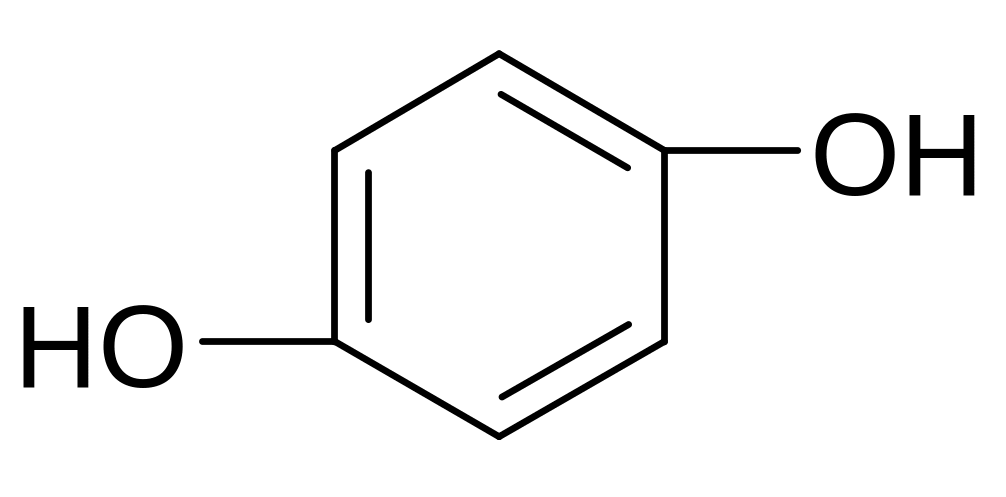
орто-изомер мета-изомер пара-изомер
пирокатехин резорцин гидрохинон
По своему строению фенолы аналогичны спиртам, однако гидроксильная группа и непосредственно связанное с ней бензольное ядро оказывают сильное влияние друг на друга.
С6Н5ОН Н2О С2Н5ОН
Б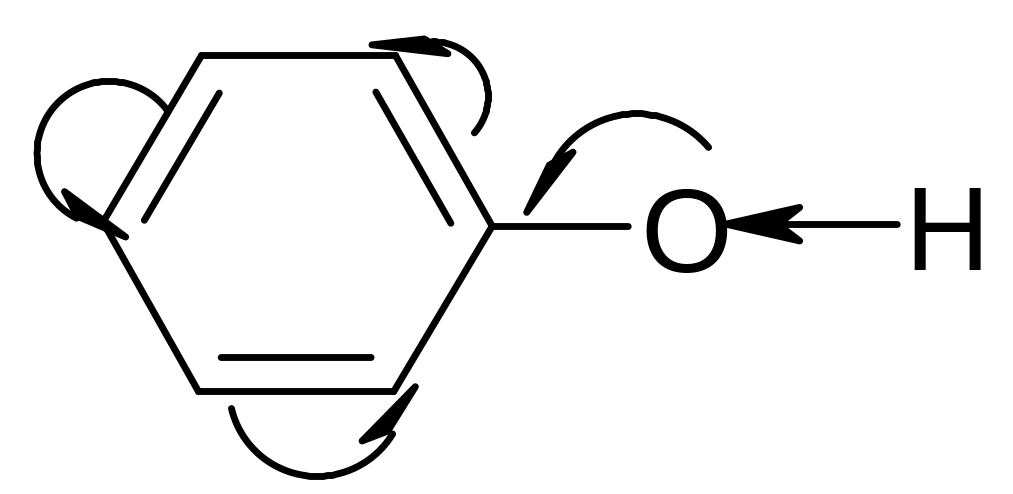 олее
сильный кислотный характер фенолов по
сравнению со спиртами объясняется
влиянием бензольного ядра. Неподеленная
пара электронов атома кислорода вступает
в сопряжение с -
электронами бензольного ядра. В результате
электронная плотность кислородного
атома смещается частично в сторону
кольца, что сильнее поляризует связь О
Н:
олее
сильный кислотный характер фенолов по
сравнению со спиртами объясняется
влиянием бензольного ядра. Неподеленная
пара электронов атома кислорода вступает
в сопряжение с -
электронами бензольного ядра. В результате
электронная плотность кислородного
атома смещается частично в сторону
кольца, что сильнее поляризует связь О
Н:
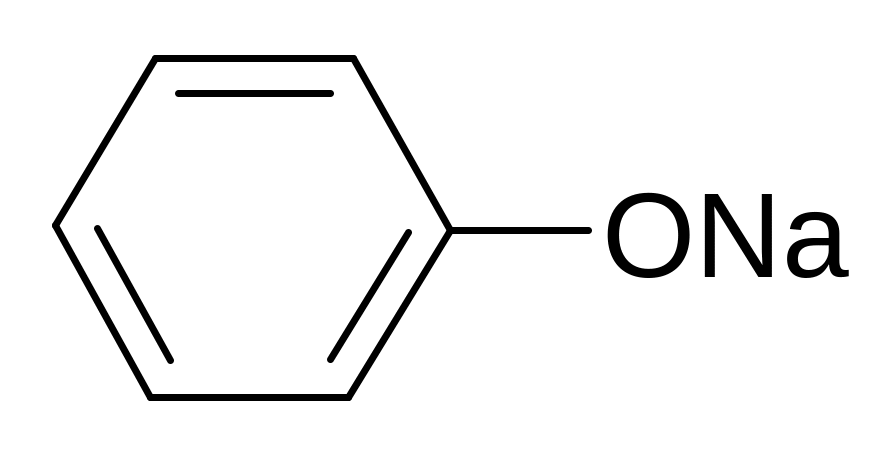
П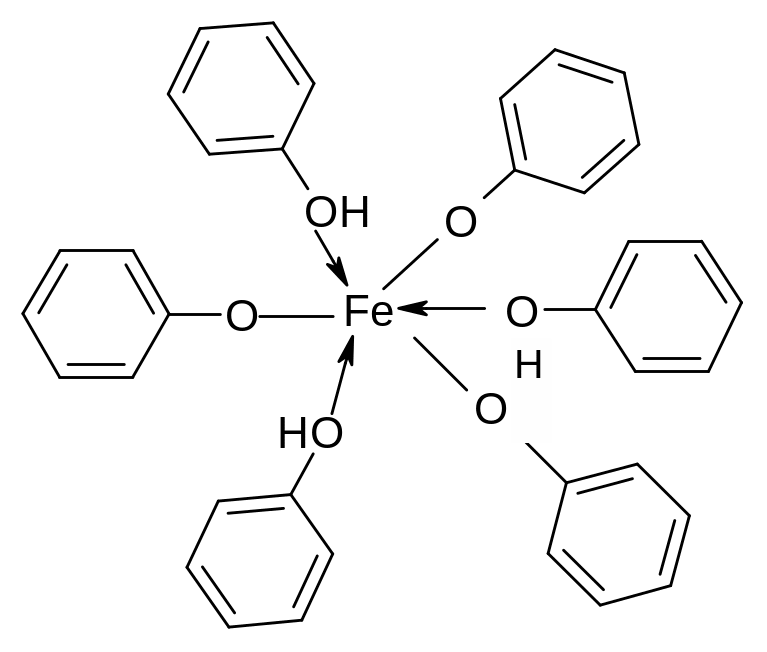 оэтому
в отличие от спиртов фенолы вступают
в реакцию с водными растворами щелочей,
образуя феноляты. Они также взаимодействуют
с гидроксидами тяжелых металлов, например
с Fe(OH)3,
с образованием «хелатов». Эту реакцию
используют для качественного обнаружения
фенолов:
оэтому
в отличие от спиртов фенолы вступают
в реакцию с водными растворами щелочей,
образуя феноляты. Они также взаимодействуют
с гидроксидами тяжелых металлов, например
с Fe(OH)3,
с образованием «хелатов». Эту реакцию
используют для качественного обнаружения
фенолов:

6 + FeCl3
Простые эфиры фенолов образуются аналогично простым эфирам спиртов:
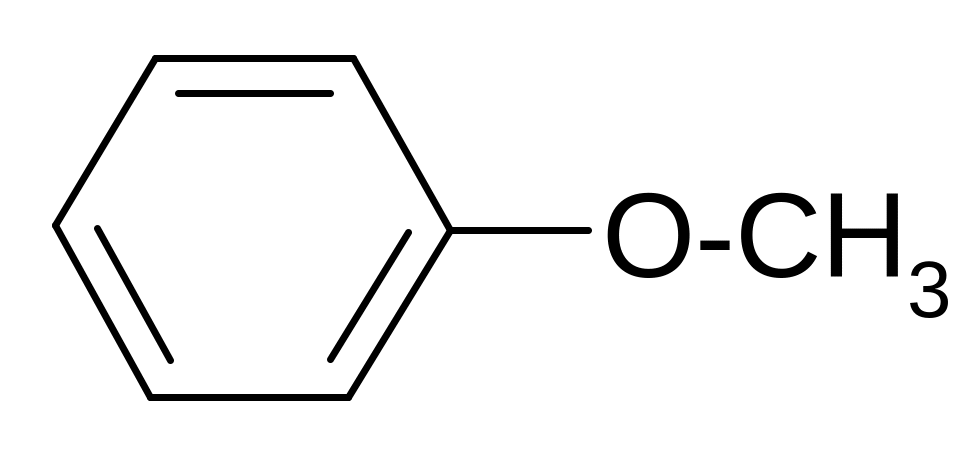
+CH3Cl + NaCl
В отличие от спиртов фенолы не образуют сложных эфиров при непосредственном действии кислот. Обычно их получают при действии на фенолы хлорангидридами:
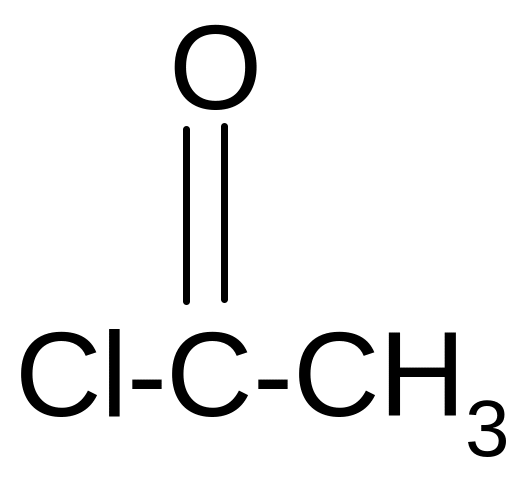
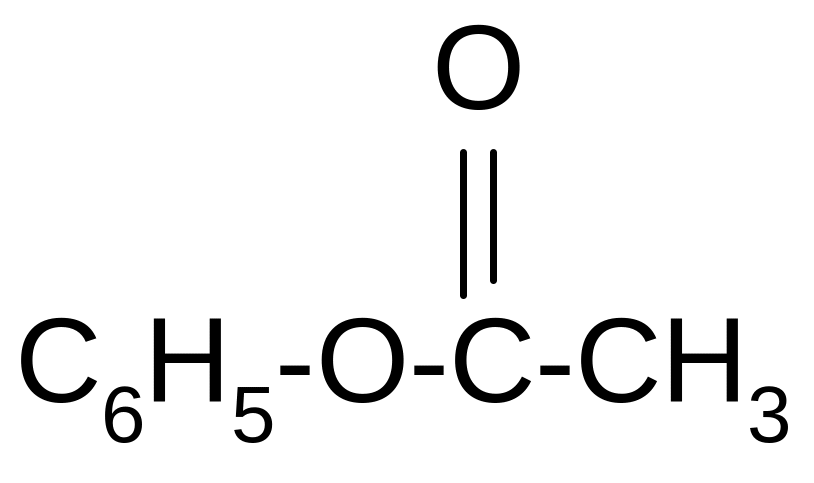
C6H5OH
+
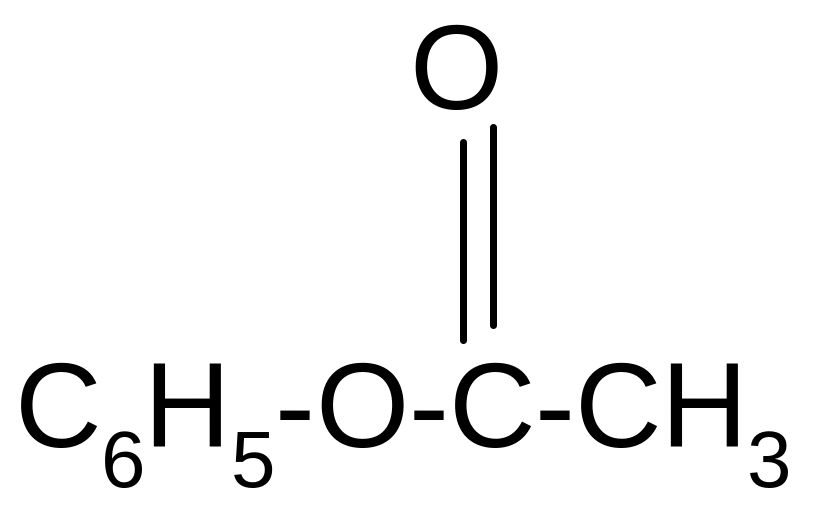 + HCl
+ HCl
Хлорангидрид
уксусной
кислоты
При перегонке фенолов с цинковой пылью гидроксильная группа восстанавливается:
Zn
 + ZnO
+ ZnO
