
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Основные направления реакционной способности углеводородов в зависимости от их электронного строения
- •Ковалентная связь
- •Циклоалканы
- •Циклопропан с3н6
- •Транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
- •1. Гидрирование:
- •Пропен пропан
- •2. Галогенирование:
- •3. Гидрогалогенирование:
- •6. Полимеризация:
- •Алкадиены Это углеводороды, содержащие две двойные связи. Общая формула Сn h2n-2.
- •1. Гидрирование:
- •2. Гидрогалогенирование:
- •Ароматические углеводороды (арены)
- •Химические свойства
- •1. Галогенирование:
- •2. Нитрование:
- •3.Сульфирование:
- •4. Алкилирование:
- •Тема 2. Спирты. Фенолы. Нафтолы. Тиолы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Кислотность и основность органических соединений
- •Кислоты тон
- •Одноатомные спирты
- •Дегидрирование альдегид
- •Дегидрирование кетон
- •Многоатомные спирты
- •Спирты высшей атомности
- •Свойства фенолов как ароматических соединений. Реакции электрофильного замещения
- •Нафтолы
- •Ароматические спирты
- •Тема 3. Альдегиды и кетоны
- •Пиридоксаль пиридоксальфосфат
- •Этапы занятия и контроль усвоения знаний
- •I. Реакции нуклеофильного присоединения
- •4. Взаимодействие с галогенсодержащими реагентами
- •II. Реакции за счет -сн2-звена
- •Галогенирование:
- •III. Реакции, характерные только для альдегидов
- •Тема 4. Карбоновые кислоты и их функциональные производные
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этановая кислота 2-метилпропановая бутен-3-овая кислота
- •Малеиновая фумаровая кислота
- •Линолевая кислота
- •2. Реакции нуклеофильного замещения (sn ):
- •Двухосновные карбоновые кислоты
- •Трехосновные кислоты
- •Ноос–сн2–с–сн2–соон лимонная 3-гидрокси – 3-карбокси -
- •Специфические реакции двухосновных кислот
- •Тема 5. Липиды
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Омыляемые липиды
- •Омыляемые липиды
- •Жирные кислоты
- •Простые омыляемые липиды
- •Сложные омыляемые липиды
- •Ф осфолипиды
- •Глицерофосфо- сфингофосфо-
- •Гликолипиды
- •Цереброзиды ганглиозиды
- •Цереброзиды
- •Ганглиозиды
- •Неомыляемые липиды
- •Стероиды
- •Классификация стероидов
- •Эстрадиол
- •Тема 6. Соединения со смешанными функциями
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Оксокислоты
- •2. Кето-енольная таутомерия -оксокислот.
- •Оксокислоты
- •Стереоизомерия
- •(Оптические,
- •Энантиомеры
- •Тема 7. Аминокислоты.
- •III. Биологически важные реакции - аминокислот
- •Тема 8. Углеводы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Тема 8-1. Углеводы. Моносахариды Теория
- •Стереоизомерия моносахаридов
- •Важнейшие природные моносахариды а льдопентозы
- •Альдогексозы Кетогексоза
- •Цикло-цепные таутомеры моносахаридов
- •Перспективные формулы Хеуорса
- •Цикло-цепная таутомерия моносахаридов – это существование в водном растворе смеси таутомерных форм, способных превращаться друг в друга через открытую таутомерную форму:
- •3. Мутаротация сахаров При растворении кристаллической таутомерной формы углевода в воде наблюдается явление мутаротации.
- •4. Конформации моносахаридов
- •5. Эпимеризация
- •6. Химические свойства моносахаридов
- •Реакции, характерные для цепной формы углеводов
- •Кислоты
- •Реакции циклических таутомерных форм моносахаридов
- •Тема 8-2. Ди – и полисахариды
- •Дисахариды
- •Цикло-цепная таутомерия дисахаридов
- •Реакция «серебряного зеркала»:
- •Полисахариды
- •Тема 9. Гетероциклические соединения
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятий и контроль усвоения знаний
- •Содержание этапов занятия
- •Электронное строение «пиррольного» атома азота
- •Шестичленные гетероциклические системы с одним гетероатомом
- •Электронное строение «пиридинового» атома азота
- •Химические свойства
- •Пятичленные гетероциклы с двумя гетероатомами
- •Химические свойства
- •Шестичленные гетероциклические соединения с двумя гетероатомами п иримидин
- •Производные пиримидина
- •Полициклические гетероциклы
- •Триптофан
- •Хинолин и изохинолин
- •Нуклеиновые кислоты
- •Общая схема построения нуклеиновых кислот
- •Нуклеиновые кислоты
- •Нуклеотиды
- •Методические разработки по биоорганической химии
- •Методические разработки по биоорганической химии Санкт-Петербург
Дегидрирование альдегид
С Н3-СН2-ОН
Н3-СН2-ОН
п ервичный
спирт О2 О
 Н2О
+
Н2О
+
катализатор кислота

каталитическое
Н2 +
Дегидрирование кетон
СН3-СН-СН3
ОН О2
в торичный Н2О +
спирт катализатор
6. Замена гидроксила на аминогруппу: в жестких условиях (300°С, окись алюминия) гидроксильная группа может быть заменена на аминогруппу:
Al2O3
С Н3-ОН
+ NH3
CH3
– NH2
Н3-ОН
+ NH3
CH3
– NH2
-H2O метиламин
Многоатомные спирты
Многоатомные спирты (гликоли, глицерины) хорошо растворимы в воде, имеют высокие температуры кипения, имеют сладкий вкус. В химические реакции вступают как одна, так и все гидроксильные группы, давая полные и неполные продукты реакции (см. «Одноатомные спирты»).
Увеличение числа гидроксильных групп усиливает кислотный характер. Поэтому многоатомные спирты образуют соли под действием не только щелочных металлов, но и гидроксидов тяжелых металлов. При этом образующиеся соли имеют комплексный характер и называются «хелатами» («клешня краба»):
H
С
 Н2-О
Н
НО HO–CH2
СH2-O
O-CH2
Н2-О
Н
НО HO–CH2
СH2-O
O-CH2

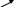 CuOH
Cu .
CuOH
Cu .
СН2-ОН H O-CH2 -2H2O CH2-O O-CH2
Н
этиленгликоль гликолят меди
При нагревании глицерина с водоотнимающими веществами (например, бисульфат калия) образуется простейший непредельный альдегид акролеин, обладающий острым неприятным запахом и раздражающим действием на слизистые оболочки глаз, носа и дыхательных путей:
изомеризация
- 2 Н2О
глицерин акролеин
При действии галогенидов фосфора замещаются галогеном все три гидроксила:
СН2ОН СH2-Br
СН – ОН + PBr3 CH-Br + P(OH)3
СН2-ОН CH2-Br
1,2,3-трибромпропан
Из производных глицерина наибольший интерес представляет тринитроглицерин – сложный эфир (взрывчатое вещество, применяемое для изготовления динамита). В малых количествах оно используется как средство для расширения кровеносных сосудов сердца:
СН2-О-NO2
CH –O-NO2
CH2-O-NO2
Сложный эфир с высшими органическими кислотами представляет собой жир:
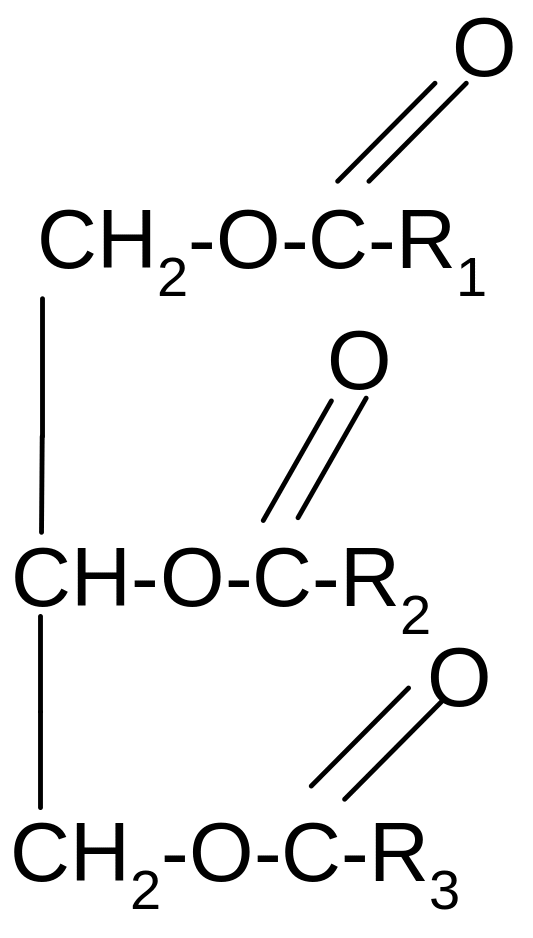
R1,R2,R3 –остатки высших жирных кислот
