
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Основные направления реакционной способности углеводородов в зависимости от их электронного строения
- •Ковалентная связь
- •Циклоалканы
- •Циклопропан с3н6
- •Транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
- •1. Гидрирование:
- •Пропен пропан
- •2. Галогенирование:
- •3. Гидрогалогенирование:
- •6. Полимеризация:
- •Алкадиены Это углеводороды, содержащие две двойные связи. Общая формула Сn h2n-2.
- •1. Гидрирование:
- •2. Гидрогалогенирование:
- •Ароматические углеводороды (арены)
- •Химические свойства
- •1. Галогенирование:
- •2. Нитрование:
- •3.Сульфирование:
- •4. Алкилирование:
- •Тема 2. Спирты. Фенолы. Нафтолы. Тиолы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Кислотность и основность органических соединений
- •Кислоты тон
- •Одноатомные спирты
- •Дегидрирование альдегид
- •Дегидрирование кетон
- •Многоатомные спирты
- •Спирты высшей атомности
- •Свойства фенолов как ароматических соединений. Реакции электрофильного замещения
- •Нафтолы
- •Ароматические спирты
- •Тема 3. Альдегиды и кетоны
- •Пиридоксаль пиридоксальфосфат
- •Этапы занятия и контроль усвоения знаний
- •I. Реакции нуклеофильного присоединения
- •4. Взаимодействие с галогенсодержащими реагентами
- •II. Реакции за счет -сн2-звена
- •Галогенирование:
- •III. Реакции, характерные только для альдегидов
- •Тема 4. Карбоновые кислоты и их функциональные производные
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этановая кислота 2-метилпропановая бутен-3-овая кислота
- •Малеиновая фумаровая кислота
- •Линолевая кислота
- •2. Реакции нуклеофильного замещения (sn ):
- •Двухосновные карбоновые кислоты
- •Трехосновные кислоты
- •Ноос–сн2–с–сн2–соон лимонная 3-гидрокси – 3-карбокси -
- •Специфические реакции двухосновных кислот
- •Тема 5. Липиды
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Омыляемые липиды
- •Омыляемые липиды
- •Жирные кислоты
- •Простые омыляемые липиды
- •Сложные омыляемые липиды
- •Ф осфолипиды
- •Глицерофосфо- сфингофосфо-
- •Гликолипиды
- •Цереброзиды ганглиозиды
- •Цереброзиды
- •Ганглиозиды
- •Неомыляемые липиды
- •Стероиды
- •Классификация стероидов
- •Эстрадиол
- •Тема 6. Соединения со смешанными функциями
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Оксокислоты
- •2. Кето-енольная таутомерия -оксокислот.
- •Оксокислоты
- •Стереоизомерия
- •(Оптические,
- •Энантиомеры
- •Тема 7. Аминокислоты.
- •III. Биологически важные реакции - аминокислот
- •Тема 8. Углеводы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Тема 8-1. Углеводы. Моносахариды Теория
- •Стереоизомерия моносахаридов
- •Важнейшие природные моносахариды а льдопентозы
- •Альдогексозы Кетогексоза
- •Цикло-цепные таутомеры моносахаридов
- •Перспективные формулы Хеуорса
- •Цикло-цепная таутомерия моносахаридов – это существование в водном растворе смеси таутомерных форм, способных превращаться друг в друга через открытую таутомерную форму:
- •3. Мутаротация сахаров При растворении кристаллической таутомерной формы углевода в воде наблюдается явление мутаротации.
- •4. Конформации моносахаридов
- •5. Эпимеризация
- •6. Химические свойства моносахаридов
- •Реакции, характерные для цепной формы углеводов
- •Кислоты
- •Реакции циклических таутомерных форм моносахаридов
- •Тема 8-2. Ди – и полисахариды
- •Дисахариды
- •Цикло-цепная таутомерия дисахаридов
- •Реакция «серебряного зеркала»:
- •Полисахариды
- •Тема 9. Гетероциклические соединения
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятий и контроль усвоения знаний
- •Содержание этапов занятия
- •Электронное строение «пиррольного» атома азота
- •Шестичленные гетероциклические системы с одним гетероатомом
- •Электронное строение «пиридинового» атома азота
- •Химические свойства
- •Пятичленные гетероциклы с двумя гетероатомами
- •Химические свойства
- •Шестичленные гетероциклические соединения с двумя гетероатомами п иримидин
- •Производные пиримидина
- •Полициклические гетероциклы
- •Триптофан
- •Хинолин и изохинолин
- •Нуклеиновые кислоты
- •Общая схема построения нуклеиновых кислот
- •Нуклеиновые кислоты
- •Нуклеотиды
- •Методические разработки по биоорганической химии
- •Методические разработки по биоорганической химии Санкт-Петербург
Одноатомные спирты
Изомерия, номенклатура:
1) изомерия углеродного скелета;
2) изомерия по положению гидроксильной группы.
Некоторые представители:
Формула |
ИЮПАК номенклатура |
Тривиальная номенклатура |
СH3-ОH |
метанол |
метиловый спирт |
C2H5-OH |
этанол |
этиловый спирт |
CH3-CH2-CH2OH |
1-пропанол |
первичный пропиловый спирт |
СH3-CH-CH3 OH |
2-пропанол |
вторичный пропиловый спирт |
- +
Физические свойства. Вследствие полярности ОН – связи и наличия диполя для спиртов характерно образование так называемых водородных связей (Н-связей). Н-связь – это связь по типу диполь-дипольного притяжения между электроотрицательным элементом одной молекулы (таким, как O, N, F, Cl, S), являющимся отрицательным концом диполя, и атомом водорода другой молекулы, являющимся положительным концом диполя. Эта связь слабая – 4–5 ккал/моль. Ее обозначают тремя точками. За счет Н-связи молекулы, способные к ее образованию, находятся в ассоциированном состоянии. Это объясняет повышенную температуру кипения и хорошую растворимость низкомолекулярных спиртов. С увеличением гидрофобного радикала R растворимость падает.
Химические свойства. Одноатомные спирты. Их химические свойства обуславливаются, главным образом, присутствием в них реакционноспособной гидроксильной группы. Реакции идут с разрывом связи либо R-OH (реакция SN), либо О-Н (кислотность).
1. При взаимодействии спиртов со щелочными металлами атомы водорода гидрокси-группы замещаются металлом с образованием алкоголята спирта:
2 С2Н5 ОН + 2Na 2 C2H5ONa + H2
алкоголят
(этилат натрия)
Алкоголяты спиртов легко разлагаются водой:
2 C2H5
ONa
+НОН С2Н5ОН + NaOH
C2H5
ONa
+НОН С2Н5ОН + NaOH
Эти реакции доказывают слабые кислотные свойства.
2. Спирты взаимодействуют с минеральными и органическими кислотами с образованием соответствующих сложных эфиров и воды:
С
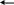 Н3-СН2-ОН
+ HOSO3H
H2O
+ CH3-CH2-O-SO3H
Н3-СН2-ОН
+ HOSO3H
H2O
+ CH3-CH2-O-SO3H
этилсульфат, этил-
серная кислота, сер-
ноэтиловый эфир
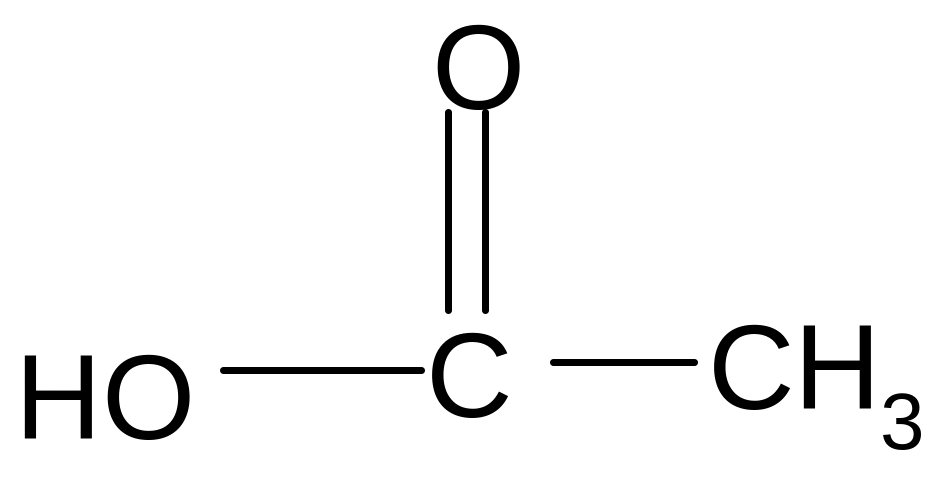
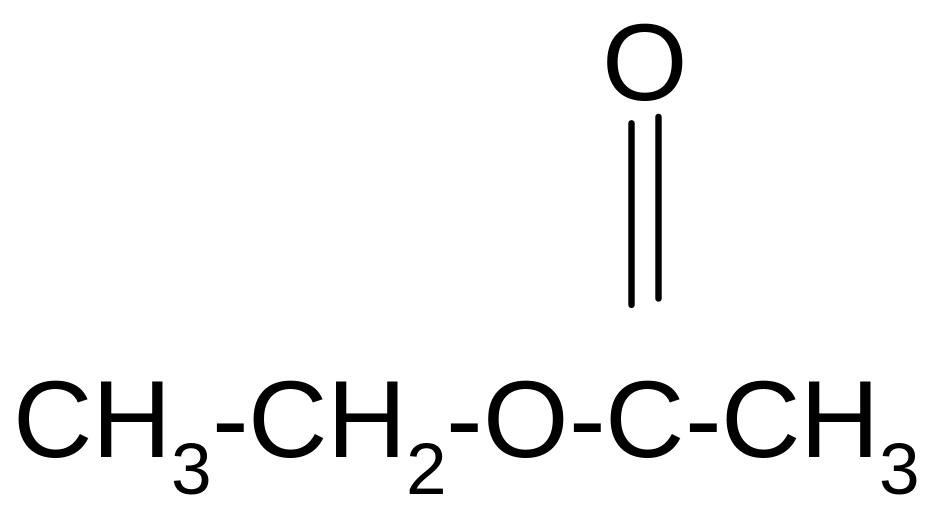
Н+
С Н3-СН2-ОН + Н2О +
уксусноэтиловый
эфир, этилацетат
3. При действии на спирты водоотнимающих веществ происходит межмолекулярное или внутримолекулярное отщепление воды. Водоотнимающими веществами являются кислоты (конц. H2SO4, H3PO4, щавелевая и др.), оксиды (оксиды алюминия, тория и др.), некоторые соли (сульфат меди, хлористый цинк и др.).
При межмолекулярной дегидратации спиртов получаются простые эфиры (R-O-R):
H2SO4, t°
С Н3-СН2-О
Н
+ НО – СН3
СН3-СН2-О-СН3
Н3-СН2-О
Н
+ НО – СН3
СН3-СН2-О-СН3
- Н2О метил-этиловый
эфир
В случае внутримолекулярной дегидратации спиртов, проходящей на тех же катализаторах, но при более высокой температуре, образуются непредельные углеводороды. При этом водород отщепляется от наименее гидрогенизированного атома углерода, находящегося по соседству с углеродом, несущим гидроксильную группу (правило Зайцева):
t°
СН3-СН2-СН-СН3 СН3-СН = СН – СН3 + Н2О
2- бутен
ОН
вторичный бутиловый
спирт
Скорость выделения воды возрастает при переходе от первичных к третичным спиртам; последние дегидратируются даже при простой перегонке.
4. Спирты при действии галогенопроизводных фосфора или галогеноводородов превращаются в галогеноалканы:
CH3-CH2-OH + PCl5 CH3-CH2-Cl + POCl3 + HCl
хлористый
этил
3 СН3 – СН2-ОН + PCl3 3CH3-CH2-Cl + P(OH)3
Реакция спиртов с галогеноводородами обратима:
СН3 – СН2-ОН + HCl CH3-CH2-Cl + H2O
Алкилхлориды можно получить и при действии тионилхлорида на спирты:
С2Н5ОН + SOCl2 C2H5Cl + SO2 + HCl
5. Спирты окисляются кислородом воздуха в присутствии медных и других катализаторов при 300–500°С, такими окислителями, как хромовая смесь, перманганат калия и др., а также дегидрируются при 100–180°С над Cu, Ag, Ni и т.д.
Во всех этих случаях первичные спирты дают альдегиды (при дальнейшем окислении – кислоты с тем же числом углеродных атомов), вторичные спирты – кетоны, которые могут быть окислены дальше до двух кислот с разрывом углеродной цепи:
 каталитическое
каталитическое
Н2 +
