
- •Визначення вмісту сірчистої кислоти
- •Теоретична частина
- •1.1. Визначення вмісту вільної сірчистої кислоти
- •1.2. Визначення вмісту загальної сірчистої кислоти
- •Теоретична частина
- •Визначення прозорості виноробної продукції
- •Теоретична частина
- •1. Приготування суспензії
- •2. Техніка визначення
- •2.1. Інструментальний метод
- •2.2. Візуальний метод
- •Лабораторна робота n 10 визначення стійкості вин до фізико-хімічних помутнінь
- •Теоретична частина
- •1.1 Підготовка проби
- •1.2.Білкові помутніння
- •1.3.Полісахаридні помутніння
- •1.4. Поліфенольні помутніння
- •1.7. Мідний кас
- •2.1. Підготовка проби
- •2.2. Мікроскопічне дослідження осадів
- •2.3. Дослідження осадів з допомогою специфічних реакцій
- •Лабораторна робота №11 дослідження вин на схильність до біологічних помутнінь
- •Теоретична частина
- •1. Мікроскопіювання
- •1.1. Приготування препаратів.
- •1.2. Техніка мікроскопіювання
- •2. Посів на стерильне вино
Міністерство освіти і науки України
Херсонський державний технічний університет
Лабораторний практикум по курсу
"Хімія та біотехнологія вина"
Херсон ХДТУ 2000
ЗАГАЛЬНІ ПОЛОЖЕННЯ
Наукові основи технології переробки винограду, а разом з ними і технохімічний і мікробіологічний контроль постійно розвиваються і вдосконалюються.
З допомогою сучасних методів дослідження стало можливим вивчення процесів, які відбуваються при переробці винограду, обробці і витримці вина.
Головне завдання курсу "Хімія та біотехнологія вина" - розгляд основних хімічних і біохімічних процесів, які відбуваються при переробці винограду, шляхів направленого управління ними на різних етапах виготовлення вин; впливу продуктів цих процесів на формування специфічних особливостей різних типів вин. Вирішення цих завдань дозволяє вдосконалювати технологічні режими, впроваджувати нові прийоми, що в кінцевому результаті сприяє інтенсифікації процесів переробки винограду, підвищення якості і стабільності вин.
Таким чином, дисципліна "Хімія та біотехнологія вина" є складовою, необхідною для правильного вирішення практичних задач, які стоять перед технологією виноробства.
В результаті вивчення дисципліни студенти повинні знати:
- характеристики виноградних вин, їх властивості;
- наукові основи технології переробки винограду;
- процеси при переробці, шляхи управління ними. Студенти повинні вміти:
- творчо мислити, робити висновки з фактів, за якими спостерігають;
- використовувати свої знання для вирішення практичних задач;
- обґрунтовувати вибір оптимальних режимів технологічних процесів виробництва;
- виконувати необхідні аналізи сировини, вин, давати оцінку результатам, що одержані.
Лабораторний практикум по курсу "Хімія та біотехнологія вина" складено для студентів спеціальності 7.091704 - технологія бродильних виробництв і виноробства.
В лабораторних роботах приведені методи аналізу, якими необхідно користуватися при технохімічному і мікробіологічному контролі на окремих етапах технологічного процесу.
Опис кожної лабораторної роботи містить мету роботи, короткі теоретичні відомості, опис лабораторної установки, методику експерименту, контрольні питання для самопідготовки.
Проте, слід мати на увазі, що приведені в даному практикумі короткі теоретичні відомості не можуть і не повинні замінювати собою систематичне вивчення лекційного матеріалу і відповідних підручників і навчальних посібників.
В процесі підготовки, проведення лабораторних робіт, студент зобов'язаний керуватись наступними положеннями:
1. До приходу в лабораторію для виконання чергової роботи студент повинен ознайомитись з теоретичними основами і змістом цієї роботи, засвоїти ті вимоги, які необхідно виконувати по ходу роботи.
2. Перед початком роботи детально ознайомитись з схемою установки. Після задовільної відповіді на контрольні питання, з дозволу викладача студент приступає до виконання роботи.
3. Всі заміри записуються в лабораторний журнал. В цьому журналі приводяться всі обчислення. Крім того, в звіт повинні входити: мета роботи, короткі теоретичні відомості, короткий опис ходу виконання роботи.
4. При складені звіту по роботі студент повинен критично оцінити одержані результати і зробити необхідні висновки.
5. Після закінчення роботи і оформлення звіту студент захищає роботу викладачеві.
Студенти допускаються до екзамену після виконання га захисту всіх лабораторних робіт.
Лабораторний практикум відповідає робочій програмі курс\ "Хімія та біотехнологія вина", яка складена на базі освітньо-професійноі програми вищої освіти за професійним спрямуванням харчова технологія та інженерія.
Контроль самостійної роботи здійснюється шляхом бесіди викладача зі студентом при захисті лабораторних робіт згідно з виданим завданням.
ЛАБОРАТОРНА РОБОТА № 1
ВИЗНАЧЕННЯ ГУСТИНИ
Мета роботи: ознайомитись з пікнометричним методом визначення густини вина (сусла).
Теоретична частина
Густиною ( р ) називають відношення маси тіла (m) до його об'єму (V):
ρ=m/V
В системі СІ густину виражають в кг/м3, але па практиці в більшості користуються розмірністю г/см3.
Відносна густина показує відношення густини даної речовини до густини іншої речовини (дистильованої води) при певних умовах і є безрозмірною величиною.
Відносну густину можна також виражати відношенням маси речовини до маси такого ж об'єму дистильованої води при постійних умовах.
Величина відносної густини вина або соку залежить від вмісту в них складових речовин (сахару, кислот, спирту і ін.). Чим більша концентрація цих речовин (за виключенням спирту), тим більша і густина, і навпаки, чим менший їх вміст, тим менша буде густина. Так як відносна густина спирту менша одиниці, то навпаки, з підвищенням концентрації його в вині густина вина буде знижуватись, але в основному велОичина відносної густини вина або соку залежить від вмісту в них сахару.
Відносна густина залежить від температури: при зниженні температури вона збільшується, при підвищенні - зменшується. Тому відносну густину позначають з індексами t1t2 , де t1 показує температуру, при якій визначалась густина речовини, а t2 - температуру води, густина якої взята за одиницю порівтіяння ( за звичай 4°С).
Температура 20°С є стандартною, тому відносну густину речовини визначають при цій температурі і позначають d204.
Існує декілька методів визначення відносної густини. Найбільш поширеними з них є ареометричний і більш точний пікнометричний, який дає точність до четвертого десяткового знаку.
Ареометричний метод оснований на застосуванні закону Архімеда: "тіло занурюється в рідину до тих пір, доки маса витисненої ним рідини не буде рівна масі цього тіла". Тому, чим більша густина вина або сусла, тим менший об'єм його знадобиться витиснути, щоб досягнути рівноваги між масою ареометра і силою, яка виштовхує його з вина, і навпаки, чим менша густина вина, тим більший об'єм його знадобиться витиснути для досягнення вказаної рівноваги. Звідси випливає, що в вині з більшою густиною ареометр буде занурюватися на меншу глибину, чим в вині з меншою густиною.
Пікнометричний метод полягає в установленні маси певного об'єму дистильованої води при 20°С і рівного об'єму вина або соку при цій же температурі в спеціальній колбі - пікнометрі. Частка від ділення найденої маси вина (сусла) на масу води показує відносну густину d2020 досліджуваної рідини.
Так як густина води при 20°С рівна 0,99823, а не одиниці, як при 4°С, то для перерахунку маси вина на його об'єм відносною густиною вина d2020 користуватись не можна. Для цього її слід перерахувати на d204 , помноживши d2020 на густину води при 20°С, тобто на 0,99823.
Хід виконання роботи
Установити постійну масу пустого пікнометра. Для цього пікнометр ретельно промивають хромовою сумішшю, потім водопровідною водою, зполоскують декілька разів дистильованою водою, дають зтекти воді і висушують до постійної ваги. Висушування продовжують до тих пір, доки результат останнього зважування не співпаде з попереднім (розходження допускаються не більше ніж на 0,2-0,3 мг).
1. Установити постійну масу пікнометра, наповненого дистильованою водою.
Пікнометр наповнюють дещо вище мітки дистильованою водою і , закривши пробкою, ставлять на водяну баню при температурі води 20 С. Необхідно строго слідкувати за тим, щоб температура води в бані не змінювалась і рівень її був вище рівня води в пікнометрі. Через 20 хв об'їм води в пікнометрі доводять з допомогою полоски фільтрувального паперу до мітки (держачи при цьому пікнометр тільки за верхній кінець шийки) і витримують в бані ще 10 хв. Якщо за цей час рівень води не змінився, пікнометр виймають з бані, насухо витирають, а краплини води, що залишились на внутрішній синці шийки видаляють з допомогою звернутого в трубочку фільтрувального паперу. Потім пікнометр витримують біля аналітичних терезів 25-30 хв. і зважують. (Якщо рівень води в пікнометрі при находженні його в водяній бані через 10 хв. змінився, то об'єм води знову доводять до мітки і залишають пікнометр в бані ще 10 хв.).
Визначення маси води в пікнометрі повторюють до тих пір, поки різниця між 3-4 паралельними визначеннями не буде перевищувати 1-1,5 мг.
Встановлена постійна маса пікнометра з водою слугує для послідуючих визначень густини вина (сусла).
2. Установити постійну масу пікнометра, наповненого вином (суслом і Пікнометр ополіснути досліджуваним вином (суслом), наповнити це.....
вище мітки і потім довести об'єм вина в пікнометрі точно так , як не шин ию при доведені об'єму води. Зважують пікнометр з вином.
3. Розрахувати відносну густину з точністю до четвертого знаку по формулі:
d=(P1-P)/(P2-P)
Де Р - маса пустого пікнометра, г;
Рі — маса пікнометра з водою, г;
Р2 - маса пікнометра з вином, г.
Контрольні питання
1. Що розуміють під відносною густиною?
2. Які існують способи вираження відносної густини?
3. Як впливає склад вина або соку на величину відносної густини?
4. Які існують методи визначення відносної густини?
5. В чому полягає пікнометричний метод визначення відносної густини вина?
ЛАБОРАТОРНА РОБОТА № 2
ВИЗНАЧЕННЯ ВМІСТУ СПИРТУ (МІЦНОСТІ)
Мета роботи: ознайомитись з пікнометричним методом визначення міцності вина
Теоретична частина
Міцністю вина називається вміст в ньому етилового спирту, виражений в об'ємних відсотках (кількість см3 спирту в 100 см3 вина). Вміст спирту виражають з точністю до першого десяткового знаку, а іноді й до другого.
Етиловий спирт представляє собою прозору рідину з характерним слабким запахом і пекучим смаком. Добре розчиняється в воді. При змішуванні з водою об'єм одержаного розчину зменшується і виділяється тепло. Так, при одержанні розчину спирту з масовою долею 30% виділяється 37,6 кДж. Явище зменшення об'єму при змішуванні спирту і води одержало назву контракції. При змішуванні 100 дм3 безводного спирту і 100 дм" води контракція складає 7,2 дм3 . Об'ємна доля спирту в суміші при цьому одержується рівною 51,88%. Явище контракції має важливе виробниче значення, і його необхідно враховувати при спиртуванні вин, складенні купажів вин і коньяків.
Коефіцієнт об'ємного розширення безводного етилового спирту при температурі від 0 до 50°С складає 0,001101. Цей показник дуже важливий при обліку спирту. Відносна густина спирту р420=0,78927; рефракція np20 =1,73614; температура плавлення безводного спирту при тиску 0,1 МПа (760 мм рт. ст.) рівна 78,35°С. При масовій долі спирту 95,57% суміш кипить при температурі 78,15°С, при подальшому розбавленні температура знову підвищується таким чином:
Масова доля спирту, % 95,57 60,00 40,00 30,00
Температура кипіння, °С 78,15 81,04 83,13 84,58
На залежності температури кипіння водно-спиртових розчинів від вмісту спирту в них оснований ебуліометричний метод визначення міцності (спиртуозності) сухих столових вин. Етиловий спирт легко окислюється перманганатом, дихроматом калію і іншими окисниками, що використовується іноді при його кількісному визначенні. Розчинність кисню в спирті в декілька разів вища, ніж в воді, що зумовлено утворенням емульсії.
Спирт і його міцні водні розчини легко спалахують. Температура спалахування безводного спирту 12 °С, спирт міцністю 80 об.% спалахує при температурі 19 °С; 55 об.% - при 23 і 40 об.% - при 26,3°С. Теплота згорання безводного спирту 29726 кДж/кг. Пари спирту з повітрям утворюють пальні вибухові суміші. При концентрації спирту в повітрі 3,28% суміш вибухає. Запах етилового спирту відчутно в повітрі при його концентрації 0,25 мг/дм .
При зброджуванні сахару дріжджами теоретично і 1 г сахару новіший утворитися 0,6479 см3 безводного спирту. Фактично ж вихід складас близько 0,60 см3. Він залежить від вихідної сахаристості сусла, тривалості бродіння і раси дріжджів. При витримці вина вміст етилового спирту в ньому дещо знижується внаслідок окислення і етерифікації. Воно зменшується (до 0,2 об.%) також в процесі технологічної обробки вин (теплом, при окпеюваниі іа ін.). Втрати спирту при отриманні ряду спеціальних вин хересу, мадери можуть складати до 1 об.%.
Найбільш поширені в виноробній промисловості методи визначення міцності: ареометричний, більш точний пікнометричний і швидкий, але недостатньо точний ебуліометричний , який застосовують тільки дим сухих вин і при внутрішньозаводських аналізах кріплених вин.
Ареометричний метод оснований на перегонці певного об'єму вина і визначенні відносної густини відгону спеціальним ареометром - скляним спиртоміром. На шкалі спиртоміру нанесене градуювання, яке показує об'єм спирту в об'ємних відсотках при 20 °С. Ціна кожного ділення 0,1% об. Такий спиртомір має умовне позначення "спиртомір класу 01".
Для зручності вимірювання міцності в межах 0-100% користуються набором спиртомірів, кожен з яких має градуювання в межах 10% (від 0 до 10, від 10 до 20 і т.д.).
Пікнометричний метод оснований на визначенні густини відгону і допомогою пікнометра.
Хід виконання роботи
1. Пікнометр наповнюють досліджуваним вином і об'єм його доводять до мітки при 20 С, як це вказано при визначенні густини (лабораторна робота № 1).
2. Вино переливають в перегону колбу місткістю 200-250 см3. Зполоскують пікнометр декілька разів невеликими порціями дистильованої води, зливають ополоски в перегону колбу.
3. Вино нейтралізують 1 н. розчином лугу по лакмусу.
4. Колбу закривають каучуковою пробкою, в отвір якої вставлена зігнута скляна трубка, сполучена зверхнім кінцем холодильника (рис.2.1). Нижній кінець холодильника опускають в пікнометр і починають нагрівання. Щоб не було втрат спирту приймальну колбу рекомендується занурювати в холодну воду або воду з льодом. Перегонку ведуть до тих пір, доки приймач не буде заповнений відгоном на 9/10 об'єму.
5. Доводять об'єм відгону до мітки дистильованою водою при 20 С в водяній бані.
6. Визначають масу пікнометра з відгоном.
7. Розраховують густину відгону.
8. Находять вміст спирту в вині, який відповідає одержаній густині відгону (по таблиці "Визначення вмісту спирту по питомим вагам дистиляту, приведених до води при 20'С).
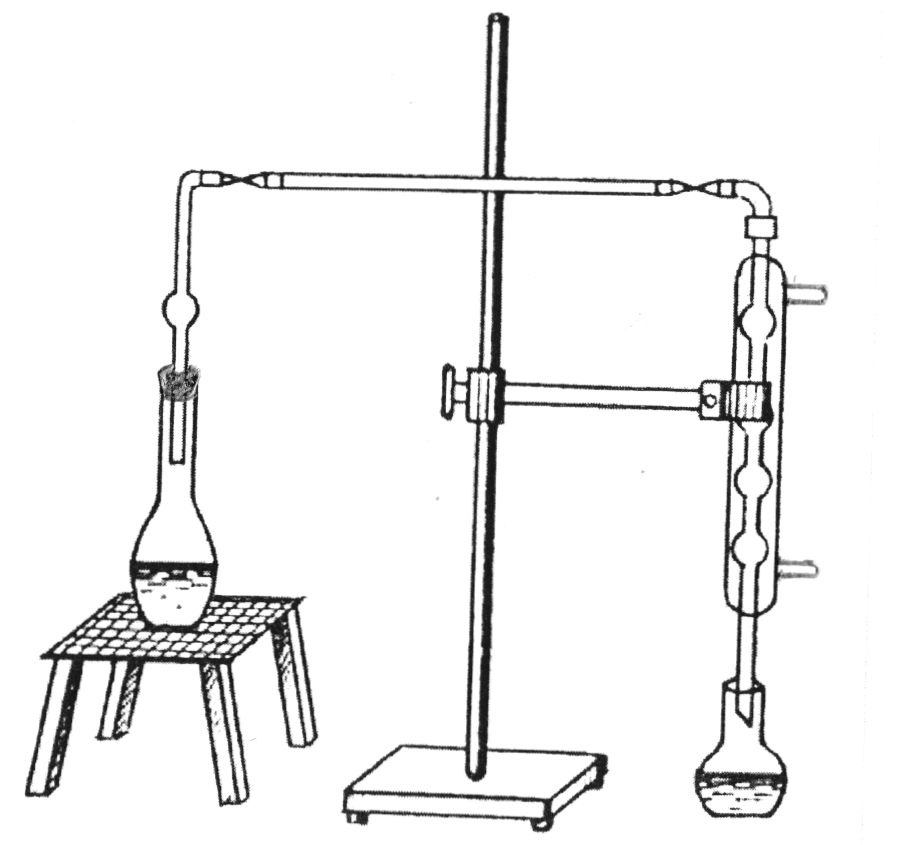
Рис.2.1. Пристрій для відгонки спирту
Таблиця 2.1
Визначення вмісту спирту по питомим вагам дистиляту, приведених до води при 20 °С
Питома вага дистиляту |
Вміст спирту, % об. |
Питома вага дистиляту |
Вміст спирту, % об. |
Питома вага дистиляту |
Вміст спирту, % об, |
|
|
|
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
1,0000 |
0,00 |
0,9971 |
1,97 |
0,9912 |
4,00 |
0,9999 |
07 |
0 |
2,03 |
1 |
07 |
8 |
13 |
0,9969 |
10 |
0 |
14 |
7 |
20 |
8 |
17 |
0,9939 |
21 |
6 |
27 |
7 |
24 |
8 |
29 |
5 |
34 |
6 |
31 |
7 |
16 |
4 |
40 |
5 |
38 |
6 |
4 і |
3 |
47 |
4 |
44 |
5 |
її |
2 |
54 |
3 |
51 |
4 |
>Х |
1 |
61 |
2 |
58 |
3 |
65 |
0 |
67 |
1 |
65 |
2 |
72 |
0.9989 |
74 |
0 |
72 |
1 |
80 |
8 |
81 |
0,9959 |
79 |
0 |
87 |
7 |
88 |
8 |
86 |
0,9929 |
9 1 |
6 |
94 |
7 |
93 |
8 |
5,01 |
5 |
1.01 |
6 |
3,00 |
7 |
09 |
4 |
08 |
5 |
08 |
6 |
16 |
3 |
15 |
4 |
15 |
5 |
24 |
2 |
21 |
3 |
22 |
4 |
32 |
1 |
28 |
2 |
29 |
3 |
39 |
0 |
35 |
1 |
36 |
2 |
47 |
0.9979 |
42 |
0 |
43 |
1 |
54 |
8 |
49 |
0,9949 |
5" |
0 |
62 |
7 |
56 |
8 |
57 |
0,9919 |
69 |
6 |
62 |
7 |
64 |
8 |
77 |
5 |
69 |
6 |
71 |
7 |
81 |
4 |
76 |
5 |
78 |
6 |
90 |
3 |
83 |
4 |
85 |
5 |
6,00 |
2 |
90 |
3 |
92 |
4 |
07 |

1 |
2 |
3 |
4 |
5 |
6 |
5 |
10.01 |
2 |
56 |
0.9759 |
46 |
4 |
09 |
І |
65 |
8 |
55 |
3 |
17 |
0 |
74 |
7 |
66 |
2 |
26 |
0.9809 |
83 |
6 |
74 |
1 |
34 |
8 |
92 |
5 |
84 |
|
|
|
|
|
|
0.9754 |
19,93 |
0,9715 |
23,52 |
0,9676 |
26,95 |
3 |
20,02 |
4 |
61 |
5 |
27,03 |
2 |
12 |
3 |
70 |
4 |
12 |
1 |
21 |
2 |
79 |
3 |
20 |
0 |
31 |
1 |
88 |
2 |
29 |
0,9749 |
40 |
0 |
97 |
1 |
38 |
8 |
50 |
0,9709 |
24,06 |
0 |
46 |
7 |
59 |
8 |
15 |
0,9669 |
54 |
6 |
68 |
7 |
24 |
8 |
63 |
5 |
78 |
6 |
33 |
7 |
72 |
4 |
87 |
5 |
42 |
6 |
80 |
3 |
97 |
4 |
51 |
5 |
88 |
2 |
21,06 |
3 |
60 |
4 |
97 |
1 |
15 |
2 |
69 |
3 |
28,06 |
0 |
24 |
1 |
77 |
2 |
14 |
0,9739 |
33 |
0 |
86 |
1 |
22 |
8 |
42 |
0,9699 |
95 |
0 |
31 |
7 |
52 |
8 |
25,04 |
0,9659 |
39 |
6 |
61 |
7 |
13 |
8 |
47 |
5 |
70 |
6 |
22 |
7 |
56 |
4 |
79 |
5 |
ЗО |
6 |
64 |
3 |
88 |
4 |
39 |
5 |
72 |
2 |
98 |
3 |
48 |
4 |
81 |
1 |
22,07 |
2 |
57 |
3 |
89 |
0 |
16 |
1 |
66 |
2 |
98 |
0,9729 |
25 |
0 |
74 |
1 |
29,06 |
8 |
34 |
0,9689 |
83 |
0 |
14 |
7 |
43 |
8 |
92 |
0,9649 |
23 |
6 |
52 |
7 |
26,00 |
8 |
31 |
5 |
61 |
6 |
09 |
7 |
39 |
4 |
70 |
5 |
18 |
6 |
47 |
3 |
80 |
4 |
26 |
5 |
56 |
2 |
89 |
3 |
35 |
4 |
64 |
1 |
98 |
2 |
43 |
3 |
72 |
0 |
23,07 |
1 |
52 |
2 |
80 |
0,9719 |
16 |
0 |
60 |
1 |
88 |
8 |
25 |
0,96799 |
69 |
0 |
96 |
7 |
34 |
9 |
78 |
0,9639 |
30,04 |
8 |
43 |
7 |
86 |
|
|
Контрольні питання
1. Етиловий спирт. Властивості. Явище контракції.
2. Написати схему утворення етилового спирту на останньому етапі бродіння.
3 Реакції етерифікації, окислення спиртів.
4 Реакція утворення ацеталів.
5 Метиловий спирт. Шляхи його утворення в вині.
6 Які аліфатичні спирти називають вищими спиртами?
7 Яким чином , можна відрізнити вина від містелей (спиртованих сусел)?
8 Які існують методи визначення вмісту спирту в винах? їх достоїнства і недоліки.
ЛАБОРАТОРНА РОБОТА № 3
ВИЗНАЧЕННЯ ЕКСТРАКТУ
Мета роботи: ознайомитися з пікнометричним методом визначення екстракту вина
Теоретична частина
Екстрактом вина називають суму нелетючих речовин, що містяться в вині. Існує два поняття: загальний і приведений екстракт.
В склад приведеного екстракту (без відновлювальних сахарів) входять сполуки - вуглеводи, багатоатомні спирти, органічні кислоти, азотисті, фенольні, мінеральні речовини. Співвідношення складових компонентів в приведеному екстракті показано нижче.
В г/дм3 В % до загальної кількості
Вуглеводи |
5 |
22 |
Багатоатомні спирти |
4,5 |
20 |
Органічні кислоти |
8,0 |
32,0 |
Азотисті речовини |
1,5 |
6,0 |
Фенольні сполуки |
2.5 |
10,0 |
Мінеральні речовини |
2,5 |
10,0 |
Всього екстрактивних речовин.
|
24,0 |
100,0 |
Приведені дані характеризують середній склад екстрактивних речовин вина. Він може помітно коливатися в залежності від типу вин. Масова концентрація приведеного екстракту у марочних винах повинна бути не менша ніж, г/дм3:
16 - для білих столових вин;
15 - для хересу з масовою концентрацією сахарів, що не перевищує 1 г/см3;
17 - для решти вин типу херес;
18 - для решти марочних вин.
Вміст екстракту в вині визначається в грамах на 100 см3.
Найбільш точний метод визначення загального екстракту пікнометричний, який оснований на видаленні з вина всіх летючих речовин, послідуючому доведенні залишку вина дистильованою водою до початкового об'єму і визначенні відносної густини одержаної суміші.
Хід виконання роботи
1. Довести об'єм досліджуваного вина в пікнометрі до мітки при 20"С (на водяній бані).
2. Перенести вино в фарфорову чашку, ополоснувши при цьому пікнометр декілька разів дистильованою водою.
3. Поставити чашку на водяну баню і випарювати вміст до половини об'єму.
4. Після охолодження залишок вина з ополосками перенести в той же пікнометр, знову довести його дистильованою водою до мітки при 20°С.
5. Зваживши пікнометр, порахувати густину {сі;°) водного розчину екстракту і по таблиці 3.1 "Визначення загального екстракту по густині водного розчину" знайти відповідний йому вміст загального екстракту в г/см3 вина.
Вміст загального екстракту можна також визначити без спеціального аналізу, по формулі, якщо відомі густина вина і густина його відгону:
Х = 1+(d1-d2),
де: X - відносна густина водного розчину екстракту;
d1- відносна густина вина;
d2 - відносна густина відгону вина. По знайденій величині X знаходять в таблиці 3.1 відповідний їй вміст загального екстракту.
Таблиця 3.1. Визначення загального екстракту по густині водного розчину
d2020 |
Загальний екстракт, г/100см1 розчину при 20 °С |
d2020 |
Загальний екстракт, г/100см' розчину при 20 °С |
d2020 |
Загальний екстракт, г/100см' розчину при 20 °С |
1 |
2 |
3 |
4 |
5 |
6 |
1,0000 |
0,000 |
1,0193 |
4,985 |
1,0392 |
10,165 |
0004 |
099 |
0197 |
5,089 |
0396 |
271 |
0008 |
199 |
0201 |
193 |
0400 |
381 |
0012 |
299 |
0205 |
296 |
0404 |
489 |
0016 |
399 |
0209 |
400 |
0409 |
597 |
0019 |
500 |
0213 |
505 |
0413 |
705 |
0023 |
600 |
0217 |
609 |
0417 |
812 |
0027 |
700 |
0221 |
713 |
0421 |
922 |
0031 |
800 |
0225 |
817 |
0425 |
11.030 |
0035 |
900 |
0228 |
922 |
0429 |
139 |
0039 |
1,000 |
0233 |
6,026 |
0437 |
247 |
0043 |
102 |
0237 |
131 |
0438 |
356 |
0047 |
203 |
0241 |
235 |
0442 |
465 |
0051 |
304 |
0245 |
34С |
0446 |
574 |
0055 |
405 |
0249 |
445 |
045С |
683 |
0058 |
506 |
0253 |
550 |
0454 |
792 |
0062 |
607 |
0257 |
655 |
0459 |
901 |
0066 |
708 |
0261 |
760 |
0463 |
12.010 |
0070 |
809 |
0265 |
865 |
0467 |
120 |
0074 |
910 |
0269 |
970 |
0471 |
229 |
0078 |
2.012 |
0273 |
7,075 |
0475 |
338 |
0082 |
113 |
0277 |
180 |
0480 |
448 |
0086 |
214 |
0281 |
286 |
0484 |
558 |
0090 |
316 |
0285 |
392 |
0488 |
667 |
0094 |
418 |
0289 |
497 |
0492 |
777 |
0098 |
519 |
0294 |
603 |
0496 |
887 |
0102 |
621 |
0298 |
709 |
0501 |
996 |
0106 |
723 |
0302 |
815 |
0505 |
13.106 |
0109 |
825 |
0306 |
921 |
0509 |
217 |
0113 |
927 |
0310 |
8.027 |
0513 |
327 |
0117 |
3,028 |
0314 |
133 |
0517 |
437 |
0121 |
132 |
0318 |
239 |
0522 |
548 |
0125 |
234 |
0322 |
345 |
0526 |
658 |
0129 |
336 |
0326 |
452 |
0530 |
769 |
0133 |
489 |
0330 |
558 |
0534 |
879 |
0137 |
541 |
0334 |
665 |
0539 |
991 |
0141 |
644 |
0336 |
771 |
0543 |
14.102 |
0145 |
769 |
0343 |
878 |
0547 |
213 |
0149 |
849 |
0347 |
985 |
0551 |
324 |
0153 |
952 |
0351 |
9,092 |
0556 |
435 |
0157 |
4,055 |
0355 |
199 |
0560 |
546 |
0161 |
158 |
0359 |
306 |
0564 |
657 |
0165 |
261 |
0363 |
413 |
0568 |
769 |
0169 |
364 |
0367 |
520 |
0573 |
880 |
0173 |
468 |
0371 |
627 |
0577 |
992 |
0177 |
571 |
0375 |
735 |
0581 |
15,103 |
0181 |
674 |
0380 |
832 |
0585 |
207 |
0185 |
778 |
0384 |
950 |
0589 |
327 |
0189 |
881 |
0388 |
10,057 |
0594 |
439 |
1,0598 |
15,551 |
1,0781 |
20,338 |
1,0965 |
25,172 |
0603 |
663 |
0785 |
455 |
0969 |
292 |
0607 |
775 |
0790 |
570 |
0974 |
412 |
0611 |
887 |
0794 |
686 |
0978 |
532 |
0615 |
999 |
0799 |
802 |
0983 |
652 |
0620 |
16.112 |
0803 |
919 |
0987 |
772 |
0624 |
225 |
0807 |
21,035 |
0992 |
893 |
0628 |
338 |
0812 |
152 |
0997 |
26,013 |
0633 |
449 |
0816 |
268 |
1001 |
134 |
0637 |
563 |
0821 |
385 |
1006 |
254 |
0641 |
676 |
0825 |
502 |
1010 |
375 |
0646 |
789 |
0830 |
619 |
1015 |
496 |
0650 |
902 |
0834 |
736 |
1020 |
617 |
0654 |
17,016 |
0839 |
853 |
1024 |
738 |
0659 |
129 |
0843 |
970 |
1029 |
859 |
0663 |
242 |
0848 |
22,108 |
1033 |
981 |
0667 |
356 |
0852 |
205 |
1038 |
27,102 |
0672 |
469 |
0856 |
323 |
1043 |
224 |
0676 |
583 |
0861 |
430 |
1047 |
345 |
0680 |
696 |
0865 |
558 |
1052 |
467 |
0684 |
810 |
0870 |
676 |
1056 |
589 |
0689 |
924 |
0874 |
794 |
1061 |
71 1 |
0693 |
18,038 |
0879 |
912 |
1066 |
833 |
0698 |
152 |
0883 |
23,029 |
1070 |
955 |
0702 |
267 |
0888 |
148 |
1075 |
28,077 |
0706 |
381 |
0892 |
266 |
1079 |
199 |
071 1 |
495 |
0897 |
385 |
1084 |
322 |
0715 |
610 |
0901 |
503 . |
1089 |
444 |
0719 |
724 |
0905 |
622 |
1093 |
567 |
0724 |
839 |
0910 |
740 |
1098 |
689 |
0728 |
954 |
0915 |
859 |
1 103 |
8і ; |
0733 |
19,069 |
0919 |
978 |
1 107 |
935 |
0737 |
184 |
0924 |
24,087 |
1112 |
29,058 |
0741 |
299 |
0928 |
216 |
1117 |
182 |
0746 |
413 |
0933 |
335 |
1121 |
305 |
0750 |
529 |
0937 |
454 |
1 126 |
428 |
0755 |
6 14 |
0942 |
574 |
1131 |
552 |
0759 |
759 |
0946 |
693 |
1135 |
675 |
0763 |
875 |
0951 |
812 |
1140 |
798 |
0768 |
990 |
0956 |
951 |
1145 |
923 |
0772 |
20,106 |
0960 |
25,052 |
1 149 |
30,046 |
Контрольні питання
1. Що називають екстрактом вина?
2. Що розуміють під загальним і приведеним екстрактом?
3. Які речовини входять до складу екстракту?
4. В чому полягає пікнометричний метод визначення екстракту в вині?
5. В яких одиницях виражається вміст екстракту в вині.
ЛАБОРАТОРНА РОБОТА №4
ВИЗНАЧЕННЯ САХАРІВ
Мета роботи: оволодіти методикою визначення сахарів в виноградних винах
Теоретична частина
На початку формування ягоди винограду загальна кількість моносахаридів складає приблизно 1% і представлена в основному глюкозою. Фруктоза з'являється декілька пізніше. У період наливу ягоди відношення глюкози до фруктози наближається до 1. У момент технологічної зрілості винограду в залежності від сорту й екологічних умов це відношення може складати 0,7-1,5. Сахара накопичуються в ягоді в міру дозрівання винограду досить рівномірно. Середньодобовий приріст сахарів перед дозріванням ягід коливається від 0,2 до 0,5%. У сприятливі роки при гарній агротехніці в окремих сортів винограду середньодобовий приріст сахарів може досягати 1%. Загальний вміст сахарів у період фізіологічної зрілості ягід у середньому складає в технічних сортів винограду 17-25%.
Сахаристість ув'яленого винограду, який застосовується для виготовлення деяких типів вин (мускати, токай), досягає 35-50%. Проте абсолютна кількість сахарів в ув'яленому винограді знижується за рахунок їхнього руйнування. Найбільшим змінам при цьому піддається фруктоза, внаслідок чого помітно зростає відношення глюкози до фруктози.
У сухих столових винах загальна кількість сахарів коливається від 0,07 до 0,4%. При цьому вміст фруктози складає 0,1-2,0 г/дм3; глюкози - 0,2-0,8; ксилози - до 0,4; арабінози - 0,2-1,4 г/дм3 . Рамнози в сухих столових винах виявлені біля 1 мг/дм3. Відношення глюкози до фруктози складає 0,3-1,6.
Більшість штамів дріжджів зброджують глюкозу: Тим часом виявлені окремі види (наприклад, сотернські дріжджі), що краще зброджують фруктозу. Існує, проте, думка, що причина полягає не в расі дріжджів, а у вихідній сахаристості сусла. Так, при вмісті сахару в суслі до 20% дріжджі швидше зброджують глюкозу, а при вмісті сахару від 20 до 25% вони зброджують глюкозу і фруктозу однаково. Якщо ж сахаристість сусла вище 25%, то швидше зброджується фруктоза.
При одержанні сухих вин кількісне співвідношення глюкози і фруктози в суслі і вині не має значення, оскільки сахар зброджується цілком. Для міцних і десертних вин це співвідношення, навпроти, дуже важливо, тому що фруктоза майже в 2 рази солодша глюкози. Тому при виготовленні вин цих типів бажано використовувати сорти винограду, у яких у стадії технічної зрілості відношення глюкози до фруктози було б менше одиниці.
У винограді і виноградних винах міститься головним чином інвертний сахар (суміш глюкози і фруктози). У деяких сортах винограду виявлена і сахароза.
У плодово-ягідній сировині, соках і винах поряд із інвертним сахаром знаходиться значна кількість сахарози.
У виноробній промисловості прийнято виражати цукристість сировини, напівфабрикатів і готової продукції в інвертному сахарі в грамах на 100 см3 або в грамах на 100 г.
Різноманітні методи визначення сахарів в основному можна розділити на дві категорії: фізичні, засновані на залежності величини густини або показника заломлення вина або соку від вмісту в них сахарів, і хімічні. Фізичні методи недостатньо точні і застосовуються тільки для визначення сахаристості винограду, сусла і культурних сортів яблук. Хімічні методи, найбільше поширені і точні, засновані на властивості глюкози і фруктози внаслідок наявності в їх молекулі вільної альдегідної або кетонної групи легко окислятися в лужному середовищі деякими сполуками (оксидом міді (II), ртуті, йодом і ін.).
У сахарозі ці групи зв'язані і не можуть безпосередньо окислятися. Тому перед визначенням сахарозу необхідно перевести в інвертний сахар, піддавши її розщепленню (інверсії), що досягається нагріванням в присутності кислоти (частіше всього соляної).
При інверсії 1 г сахарози дає 1,0526 г інвертного сахару. З хімічних методів у виноробній промисловості застосовуються метод Лейнс-Эйнона (прямого об'ємного титрування) і метод Бертрана (перманганатометрическпй).
Принцип цих методів полягає у визначенні сахарів лужним розчином оксиду міді (II) (фелінгова рідина). По кількості оксиду міді (II), що виділилася при цьому, розраховують вміст сахару, користуючись спеціальними таблицями або коефіцієнтами, складеними на підставі дослідних даних, тому що прямої пропорційності між кількістю відновленого оксиду міді (1) і окисленого сахару не існує.
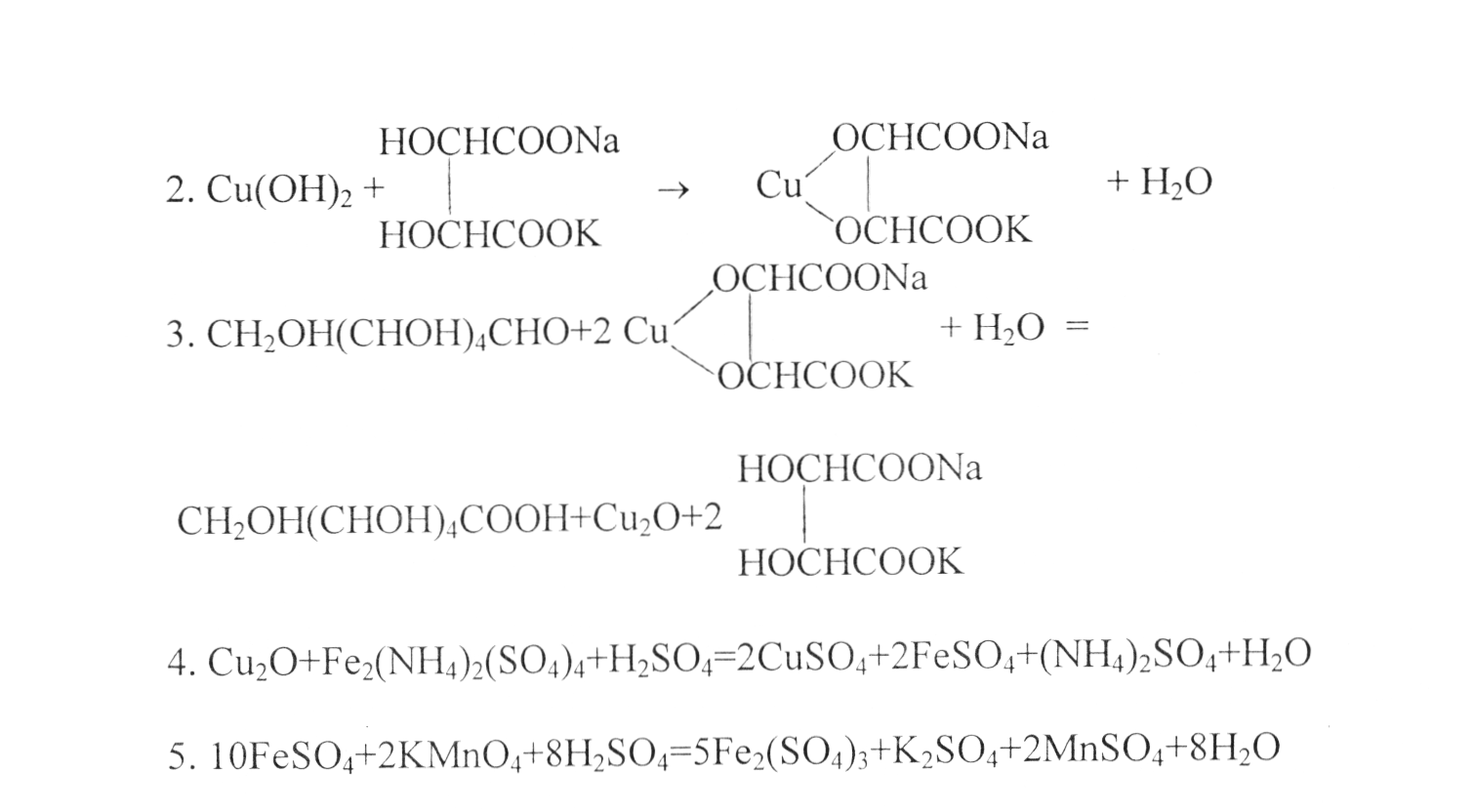
Сутність методу Бертрана полягає в тому, що моносахариди при кип'ятінні в суміші розчинів мідного купоросу і лужного розчину сегнетової солі відновлюють цю рідину з утворенням осаду оксиду міді (Си20). Відфільтрувавши червоний осадок оксиду міді (І), його розчиняють у залізоамонійних квасцях. При цьому оксид міді (І) відновлює еквівалентну кількість окисленого заліза в сульфат заліза (II). Кількість сульфату заліза визначають титруванням марганцевокислим калієм. По перевідним таблицям знаходять кількість відновленої міді і інвертного сахару.
При цьому методі протікають такі реакції:
1.СuSO5+2NаОН->Сu(ОН)2+Nа2SO4
Хід виконання роботи
1. 20 см3 підготованого до аналізу розчину, відміреного піпеткою, переносять у конічну колбу ємкістю 200-300 см3, туди ж добавляють послідовно піпетками по 20 см3 розчинів Фелінга 1 та Фелінга 2. Суміш нагрівають до кипіння і кип'ятять рівно 3 хв.
2. Після відстоювання осадку оксиду міді (І), що утворився, гарячий розчин обережно фільтрують, не зачіпаючи осаду, через скляний фільтр № 3 у колбу Бунзена за допомогою вакуумного насоса. Щоб уникнути перекидання рідини з насоса в колбу Бунзена її з'єднують із насосом через захисну склянку. До осаду в колбі доливають трохи гарячої дистильованої води, збовтують і після відстоювання фільтрують через той же фільтр.
3. Промивання повторюють 2-3 рази, при цьому стежать, щоб осадок оксиду міді (І) увесь час був покритий водою (щоб уникнути окислювання). Потім знімають пробу з фільтром, виливають фільтрат із колби Бунзена, старанно промивають її дистильованою водою і знову вставляють фільтр.
4. До осаду оксиду міді (І) в конічній колбі добавляють порціями розчин сульфату заліза (III) (загальна кількість його не повинна перевищувати 20 см3); при цьому необхідно стежити, щоб на стінках колби не залишалося слідів осаду.
5. Отриманий зеленуватий розчин фільтрують через цей же фільтр (для розчинення осілого в порах фільтра осаду оксиду міді (І)), промивають конічну колбу і фільтр декілька разів дистильованою водою. Зібраний в колбі Бунзена фільтрат титрують розчином перманганату до появи рожевого забарвлення, що не зникає ЗО сек. 6. При розрахунку кількість розчину перманганату , яка витрачена на титрування (у см), множать на 6,36 (кількість міді в мг, що відповідає 1 см" 0,1 н. розчину перманганату) і по отриманому результату, користуючись таблицею 4.1 «Визначення вмісту інвертного сахару по міді», знаходять кількість інвертного сахару в міліграмах. Для обчислення вмісту сахарів в 100 см3 вина або соку необхідно враховувати розведення.
Таблиця 4.1.
Визначення вмісту інвертного сахару (в мг) по міді ( в мг)
Сахар |
Мідь |
Сахар |
Мідь |
Сахар |
Мідь |
||
1 |
2 |
3 |
4 |
5 |
6 |
||
10,0 |
20,6 |
20,0 |
40,4 |
30,0 |
59,3 |
||
10 2 |
21 0 |
20 2 |
40 8 |
30.2 |
59.7 |
||
10,4 |
21,4 |
20,4 |
41,2 |
30,4 |
60,0 |
||
10,6 |
21,8 |
20,6 |
41,5 |
30,6 |
60,4 |
||
10 8 |
22.2 |
20,8 |
41,9 |
30,8 |
60,7 |
||
11,0 |
22,6 |
21,0 |
42,3 |
31,0 |
61,1 |
||
11,2 |
23,0 |
21,2 |
42,7 |
31,2 |
61,5 |
||
11,4 |
23,4 |
21,4 |
43,1 |
31,4 |
61,9 |
||
11,6 |
23,8 |
21,6 |
43,4 |
31,6 |
62,2 |
||
11.8 |
24,2 |
21,8 |
43,8 |
31,8 |
62.6 |
||
12,0 |
24,6 |
22,0 |
44,2 |
32,0 |
63,0 |
||
12 2 |
25.0 |
22,2 |
44,6 |
32,2 |
63,4 |
||
12,4 |
25,4 |
22,4 |
45,0 |
32,4 |
63,7 |
||
12,6 |
25,8 |
22,6 |
45,3 |
32,6 |
64,1 |
||
12,8 |
26.2 |
22,8 |
45,7 |
32,8 |
64.5 |
||
13,0 |
26,5 |
23.0 |
46,1 |
33,0 |
64,8 |
||
13,2 |
26,9 |
23,2 |
46,5 |
33.2 |
65,2 |
||
13,4 |
27.3 |
23,4 |
46,9 |
33,4 |
65,6 |
||
13,6 |
27,7 |
23,6 |
47,2 |
33,6 |
65,9 |
||
13,8 |
28.1 |
23,8 |
47,6 |
33,8 |
66.3 |
||
14,0 |
28,5 |
24,0 |
48,0 |
34,0 |
66,7 |
||
14,2 |
28,9 |
24,2 |
48,4 |
34,2 |
67,1 |
||
14,4 |
29,3 |
24,4 |
48,7 |
34,4 |
67,4 |
||
14,6 |
29,7 |
24,6 |
49,1 |
34,6 |
67,8 |
||
14,8 |
30,1 |
24,8 |
49,4 |
34.8 |
68,1 |
||
15,0 |
30,5 |
25,0 |
49,8 |
35.0 |
68,5 |
||
15,2 |
30,9 |
25,2 |
50,2 |
35,2 |
68,9 |
||
15,4 |
31,3 |
25,4 |
50,6 |
35,4 |
69,2 |
||
15,6 |
31,7 |
25,6 |
50,9 |
35,6 |
69,6 |
||
15,8 |
32,1 |
25,8 |
51,3 |
35,8 |
69,9 |
||
16,0 |
32,5 |
26,0 |
51,7 |
36,0 |
70,3 |
||
16,2 |
32,9 |
26,2 |
52,1 |
36.2 |
70,7 |
||
16,4 |
33,3 |
26,4 |
52,5 |
36,4 |
71,1 |
||
16.6 |
33,7 |
26,6 |
52.8 |
36.6 |
71,4 |
||
16,8 |
34,1 |
26,8 |
53,2 |
36,8 |
71,8 |
||
17,0 |
34,5 |
27,0 |
53,6 |
37,0 |
72,2 |
||
17,2 |
34,9 |
27,2 |
54.0 |
37,2 |
72,6 |
||
17,4 |
35,3 |
27,4 |
54,4 |
37,4 |
73,0 |
||
17.6 |
35,6 |
27,6 |
54,7 |
37,6 |
73,3 |
||
17.8 |
36.0 |
27,8 |
55,1 |
37,8 |
73,7 |
||
18,0 |
36,4 |
28,0 |
55,5 |
38,0 |
74,0 |
||
18,2 |
36,8 |
28,2 |
55,9 |
38,2 |
74,4 |
||
18,4 |
37,2 |
28,4 |
56.3 |
38,4 |
74,8 |
||
18,6 |
37,6 |
28,6 |
56,6 |
38,6 |
75,1 |
||
18,8 |
38,0 |
28,8 |
57,0 |
38,8 |
75,5 |
||
19,0 |
38,4 |
29,0 |
57,4 |
39,0 |
75,9 |
||
19.2 |
38,8 |
29,2 |
57,8 |
39.2 |
76,3 |
||
19,4 |
39,2 |
29,4 |
58.2 |
39,4 |
76,6 |
||
19,6 |
39,6 |
29.6 |
58.5 |
39,6 |
77,0 |
||
19,8 |
40.0 |
29,8 |
58,9 |
39,8 |
77,3 |
||
|
|
|
|
|
|
||
40, 0 |
77,7 |
50,0 |
95, 4 |
60, 0 |
112,6 |
||
40. 2 |
78. 1 |
50,2 |
95. 7 |
60, 2 |
112, 9 |
||
40, 4 |
78,4 |
50. 4 |
96, І |
60,4 |
113, 3 |
||
40. 6 |
78, 8 |
50, 6 |
96,4 |
60.6 |
113. 6 |
||
40. 8 |
79. 1 |
50, 8 |
96, 8 |
60. 8 |
1 14, 0 |
||
41. 0 |
79, 5 |
51.0 |
97, І |
61.0 |
114, 3 |
||
41,2 |
79, 8 |
51,2 |
97,4 |
61,2 |
114,6 |
||
41,4 |
80.2 |
51,4 |
97, 8 |
61,4 |
114. 9 |
||
41.6 |
80. 5 |
51.6 |
98, 1 |
61,6 |
115,3 |
||
41. 8 |
80,9 |
51,8 |
98, 5 |
61, 8 |
115, 6 |
||
42.0 |
81,2 |
52,0 |
98, 8 |
62.0 |
115,9 |
||
42, 2 |
81,6 |
52,2 |
99, 2 |
62, 2 |
116, 2 |
||
42.4 |
81.9 |
52,4 |
99. 5 |
62,4 |
116,6 |
||
42. 6 |
82, 3 |
52, 6 |
99, 9 |
62, 6 |
116, 9 |
||
42. 8 |
82, 6 |
52, 8 |
100,2 |
62, 8 |
117, 3 |
||
43, 0 |
83, 0 |
53, 0 |
100, 6 |
63, 0 |
117,6 |
||
43. 2 |
83,4 |
53,2 |
100,9 |
63,2 |
117,9 |
||
43,4 |
83, 7 |
53,4 |
101, 2 |
63,4 |
118,2 |
||
43, 6 |
84, 1 |
53,6 |
101, 6 |
63,6 |
118.6 |
||
43, 8 |
84,4 |
53, 8 |
102,0 |
63, 8 |
1 18. 9 |
||
44,0 |
84,8 |
54,0 |
102,3 |
64, 0 |
119,2 |
||
44. 2 |
85. 1 |
54,2 |
102, 6 |
64,2 |
119,5 |
||
44. 4 |
85, 5 |
54,4 |
103,0 |
64 4 |
119,9 |
||
44. 6 |
85. 8 |
54, 6 |
103. 3 |
64,6 |
120,2 |
||
44. 8 |
86, 2 |
54, 8 |
103, 7 |
64. 8 |
120, 6 |
||
45, 0 |
86. 5 |
55,0 |
104,0 |
65. 0 |
120. 9 |
||
45, 2 |
86,9 |
55,2 |
104, 3 |
65, 2 |
121, 2 |
||
45.4 |
87. 2 |
55,4 |
104. 7 |
65,4 |
121.6 |
||
45, 6 |
87,6 |
55.6 |
105, 0 |
65,6 |
121,9 |
||
45, 8 |
87, 9 |
55, 8 |
105. 4 |
65, 8 |
122 3 |
||
46, 0 |
88,3 |
56, 0 |
105, 7 |
66. 0 |
122. 6 |
||
46. 2 |
88, 7 |
56,2 |
106,0 |
66. 2 |
122.9 |
||
|
|
|
|
|
|
||
46,4 |
89, 0 |
56,4 |
106,4 |
66,4 |
123,2 |
||
46,6 |
89. 4 |
56. 6 |
106, 7 |
66, 6 |
123,6 |
||
46, 8 |
89, 7 |
56, 8 |
107, 1 |
66, 8 |
123. 9 |
||
47, 0 |
90, 1 |
57,0 |
107. 4 |
67. 0 |
124. 2 |
||
47,2 |
90, 5 |
57,2 |
107, 8 |
67, 2 |
124, 5 |
||
47,4 |
90, 8 |
57,4 |
108, 1 |
67, 4 |
124. 9 |
||
47,6 |
91, 2 |
57, 6 |
108, 5 |
67. 6 |
125, 2 |
||
47, 8 |
91, 5 |
57, 8 |
108, 8 |
67, 8 |
125, 6 |
||
48,0 |
91,9 |
58,0 |
109,2 |
68,0 |
125, 9 |
||
48,2 |
92, 2 |
58, 2 |
109, 5 |
68, 2 |
126,2 |
||
48,4 |
92,6 |
58,4 |
109,9 |
68. 4 |
126,6 |
||
48,6 |
92,9 |
58,6 |
110,2 |
68, 6 |
126,9 |
||
48,8 |
93, 3 |
58, 8 |
110, 6 |
68, 8 |
127,2 |
||
49,0 |
93,6 |
59,0 |
110,9 |
69, 0 |
127, 5 |
||
49,2 |
94, 0 |
59, 2 |
111,2 |
69,2 |
127, 8 |
||
49,4 |
94, 3 |
59,4 |
111,6 |
69,4 |
128,2 |
||
49, 6 |
94, 7 |
59. 6 |
111,9 |
69, 6 |
128, 5 |
||
49, 8 |
95,0 |
59, 8 |
112,3 |
69, 8 |
128, 9 |
||
|
|
|
|
|
|
||
70,0 |
129,2 |
80,0 |
145,3 |
90.0 |
161,1 |
||
70,2 |
129,5 |
80,2 |
145,6 |
90,2 |
161,4 |
||
70,4 |
129,8 |
80.4 |
145,9 |
90,4 |
161.7 |
||
70,6 |
130,2 |
80,6 |
146,3 |
90,6 |
162.0 |
||
70.8 |
130,5 |
80,8 |
146,6 |
90,8 |
162,3 |
||
71,0 |
130,8 |
81,0 |
146,9 |
91,0 |
162,6. |
||
71,2 |
131,1 |
81,-2. |
147.2 |
91,2 |
162.9 |
||
71.4 |
131,4 |
81.4 |
147,5 |
91,4 |
163,2 |
||
71.6 |
131,8 |
81.6 |
147.9 |
91,6 |
163.6 |
||
71,8 |
132,1 |
81.8 |
148,2 |
91,8 |
163,9 |
||
72.0 |
132,4 |
82,0 |
148,5 |
92,0 |
164.2 |
||
72,2 |
132.7 |
82.2 |
148,8 |
92,2 |
164,5 |
||
72.4 |
133,0 |
82,4 |
149,1 |
92,4 |
164,8 |
||
72,6 |
133,4 |
82.6 |
149,4 |
92,6 |
165.1 |
||
72.8 |
133,7 |
82.8 |
149,7 |
92.8 |
165,4 |
||
73,0 |
134.0 |
83.0 |
150,0 |
93.0 |
165.7 |
||
73.2 |
134,3 |
83,2 |
150,3 |
93,2 |
166.0 |
||
73,4 |
134,6 |
83,4 |
150.6 |
93,4 |
166.3 |
||
73.6 |
135,0 |
83.6 |
151,0 |
93,6 |
166,7 |
||
73,8 |
135.3 |
83.8 |
151.3 |
93.8 |
167,0 |
||
74,0 |
135,6 |
84,0 |
151,6 |
94,0 |
167,3 |
||
74,2 |
135,9 |
84,2 |
151,9 |
94,2 |
167,6 |
||
74,4 |
136,2 |
84.4 і |
152,2 |
94,4 |
167,9 |
||
74.6 |
136,6 |
84,6 |
152.6 |
94,6 |
168,2 |
||
74.8 |
136,9 |
84.8 |
152,9 |
94.8 |
168,5 |
||
75.0 |
137.2 |
85.0 |
153.2 |
95,0 |
168,8 |
||
75,2 |
137.5 |
85,2 |
153.5 |
95,2 |
169,1 |
||
75.4 |
137.9 |
85.4 |
153,8 |
95,4 |
169,4 |
||
75,6 |
138.2 |
85.6 |
154,2 |
95,6 |
169.7 |
||
75.8 |
138,6 |
85,8 |
154,5 |
95,8 |
170,0 |
||
76,0 |
138,9 |
86.0 |
154,8 |
96,0 |
170,3 |
||
76.2 |
139,2 |
86.2 |
155,1 |
96.2 |
170,6 |
||
76,4 |
139,5 |
86.4 |
155,4 |
96,4 |
170,9 |
||
76,6 |
139,9 |
86.6 |
155,8 |
96,6 |
171,3 |
||
76,8 |
140,2 |
86.8 |
156,1 |
96,8 |
171,6 |
||
77.0 |
140.5 |
87.0 |
1 56.4 |
97,0 |
171,9 |
||
77.2 |
140.8 |
87.2 |
156,7 |
97,2 |
172,2 |
||
77,4 |
141.1 |
87.4 |
157.0 |
97,4 |
172,5 |
||
77,6 |
141.5 |
87,6 |
157,3 |
97,6 |
172,8 |
||
77,8 |
141.8 |
87.8 |
157,6 |
97,8 |
173,1 |
||
78.0 |
142.1 |
88.0 |
157,9 |
98,0 |
173,4 |
||
78.2 |
142.4 |
88.2 |
158,2 |
98,2 |
173,7 |
||
78.4 |
142.7 |
88.4 |
158,5 |
98,4 |
174,0 |
||
78.6 |
143.1 |
88,6 |
158,9 |
98.6 |
174.4 |
||
78.8 |
143,4 |
88,8 |
159,2 |
98,8 |
174,7 |
||
79,0 |
143,7 |
89.0 |
159,5 |
99,0 |
175,0 |
||
79,2 |
144,0 |
89,2 |
159,8 |
99,2 |
175,3 |
||
79,4 |
144.3 |
89,4 |
160,1 . |
99.4 |
175.6 |
||
79,6 |
144.7 |
89,6 |
160.5 |
99,6 |
175.9 |
||
79,8 |
145.0 |
89.8 |
160,8 |
99,8 |
176,2 |
||
Контрольні питання
І.Які речовини називають сахарами?
2. Моносахариди, їх властивості.
3. Реакції утворення фурфуролу, оксиметилфурфуролу.
4. Полісахариди. Іх класифікація. Номенклатура.
5. Сахароза. Будова. Властивості. Кислотний і ферментативний .
6. Які існують методи визначення сахарів в винах?
7. В чому полягає метод визначення сахарів в даній роботі? Написати рівняння реакцій.
8. Що представляють собою розчини Фелінга І і Фелінга II?
ЛАБОРАТОРНА РОБОТА № 5
ВИЗНАЧЕННЯ ТИТРУЄМОЇ КИСЛОТНОСТІ
Мета роботи: набути навиків в визначенні титруємої кислотності вин, соків, плодів та ягід
Теоретична частина
Під титруемою кислотністю вина, соку, плодів і ягід розуміють вміст в них вільних кислот і їх кислих солей.
Органічні кислоти відіграють важливу роль в обміні речовин виноградної рослини і беруть активну участь в процесах, які відбуваються при виготовлені вина. В виноградному суслі і вині вони можуть знаходитися як у вільному, так і в зв'язаному і напівзв'язаному стані.
В винограді аліфатичні одноосновні насичені кислоти містяться в невеликих кількостях, в винах їх значно більше. В винограді і вині аліфатичні одноосновні насичені кислоти знаходяться в вільному стані, а також входять в склад складних ефірів. Двоосновні карбонові кислоти містять дві карбоксильні групи. В винограді і вині з багатоосновних найдені головним чином дікарбонові кислоти - щавлева, янтарна, фумарова.
В винограді і вині містяться оксикислоти, тобто кислоти, в яких один або декілька атомів водню в радикалі кислоти заміщені однією або кількома гідроксильними (спиртовими) групами. Аліфатичні одноосновні оксикислоти представлені в винограді і вині гліколевою, молочною, гліцериновою і глюконовою кислотами. Серед аліфатичних багатоосновних оксикислот винограду і вина важливе місце займають винна і яблучна кислоти.
Яблучна кислота НООССН(ОН)СН2СООН містить асиметричний атом водню. Зустрічається в виді L- і D-оптичних стереоізомерів і рацемату. В природі найбільш поширена L-яблучна кислота. Вона міститься в яблуках, багато її в плодах обліпихи, барбарису. Харчова яблучна кислота в вигляді рацемату може бути отримана шляхом хімічного синтезу.
Яблучна кислота - кристалічна речовина. Утворює кислі і середні солі, з яких важкорозчинна середня кальцієва сіль СаH4С4O5.
В виді L-форми яблучна кислота міститься в виноградній гроні і листі. Особливо багато її (до 13-15 г/кг винограду) в недозрілих ягодах. В процесі визрівання ягід кількість яблучної кислоти зменшується і в момент фізіологічної зрілості складає 2-5 г/кг винограду. Це зумовлено тим, що яблучна кислота є найбільш лабільною органічною кислотою і бере активну участь в процесах дихання, обміну речовин винограду.
При визріванні винограду вона дегідрується в присутності малікодегідрогенази і NAD в щавлевооцтову кислоту. Остання декарбоксилюється в піровиноградну, яка бере участь в синтезі інших органічних кислот.
В винах, в яких пройшло яблучно-молочне бродіння, кислота виявляється тільки в слідах.
Винна кислота (виннокам'яна, діоксиянтарна) вперше була виділена з винного каменю, має два асиметричних атома водню. В зв'язку з цим вона повинна була б мати чотири оптичних ізомери, в дійсності ж стереоізомерів в ній лише два. Це зумовлено наявністю у двох асиметричних атомів вуглецю одних і тих же груп - Н, ОН, СООН:

З чотирьох ізомерів винної кислоти формули III і IV повторюють одна іншу.
В природі зустрічається сполука, яка є сумішшю рівних кількостей D- і L-винних кислот. Ця сполука оптично неактивна і називається виноградною кислотою(рацемічною винною).
По хімічним властивостям всі чотири форми кислоти однакові, але відрізняються по температурі плавлення, розчинності і ін. Так D- і L-винні кислоти плавляться при температурі 170"С, виноградна (безводна) - при 204-206, мезовинна (безводна) - при140"С. Розчинність D-винної кислоти в воді значно вища розчинності виноградної.
В винограді винна кислота міститься в вигляді D-винної і в невеликій кількості - в вигляді виноградної кислоти.
З солей О-винної кислоти (тартратів) найбільш відомі бітартрат калію, тартрат калію, тартрат кальцію, тартрат калію-натрію.
Слизова кислота (муцинова, або галактарова) НООС(СНОН)4СООН. Це кристалічна речовина. Важко розчинна в воді, легко одержується окисленням галактонової кислоти. В здоровому винограді і вині міститься в невеликій кількості. В винограді, зараженому Ботрітіс цінереа, її вміст може досягати 0,5 г/дм3. В вині утворює з кальцієм важкорозчинну сіль, яка випадає в осадок.
Сахарна кислота НООС(СНОН)4СООН. Представляє собою кристалічну речовину. Добре розчинна в воді. Утворюється окисленням глюконової кислоти. В помітних кількостях знайдена в суслі і вині з винограду, зараженого Ботрітіс цінереа.
Лимонна кислота НОС(СН2СООН)2СООН. Має вид прозорих кристалів або білого порошку. Добре розчинна в воді (133 г в 100 г води на холоді і 200 г при 100°С), гірше в спирті і ефірі. Кристалізаційну воду втрачає при температурі 70-75"С. Лимонна кислота утворюється як вторинний продукт при спиртовому бродінні. До періоду технічної зрілості вміст її в винограді збільшується, в момент фізіологічної зрілості зменшується.
Альдегідо- і кетокислоти, маючи в молекулі карбоксильну і альдегідну або кетонну групи проявляють властивості кислот і альдегідів або кетонів. Так, вони утворюють солі, ефіри, вступають в реакції приєднання, альдегідокислоти легко окисляються, перетворюючись в дикарбонові кислоти.
Глюкуронова кислота СОН(СНОН)4СООН. β -Форма глюкуронової кислоти представляє собою голкоподібні кристали. При нагріванні з НСІ розпадається на фурфурол, С02 і Н20. Відновлює фелінгову рідину. Дріжджами не зброджується. В суслі і вині, одержаному з винограду, який заражений Ботрітіс цінереа, виявляється до 1,3 г/дм3 глюкуронової кислоти. Вважають, що таке збільшення обумовлено окисленням глюкози ферментами гриба.
Галактуронова кислота СОН(СНОН)4СООН. Представляє собою кристалічну речовину, входить до складу пектинових речовин винограду і вина. По хімічним властивостям близька до глюкуронової кислоти. В вині в зв'язку з гідролізом пектинових речовин вміст її збільшується.
Піровиноградна ( а -кетопропіонова) кислота СН3С(0)СООН. Представляє безкольорову рідину, яка змішується з водою, спиртом і ефіром в усіх відношеннях. Нормальний продукт обміну речовин.
Титруєму кислотність виражають в г/дм3 в перерахунку для виноградного виноробства на винну кислоту, а для плодово-ягідного - на яблучну.
Хід виконання роботи
1. Підготовка проби
А. Для аналізу плодів або ягід зважують в стакані подрібнену мезгу в кількості 20-50 г з врахуванням кислотності сировини. Додавши 120-150 см3 дистильованої води, нагрівають суміш на водяній бані при температурі 70-80°С протягом 30 хвилин. Після охолодження вміст стакана разом з ополосками переносять в мірну колбу місткістю 250 см3 і об'єм доводять до мітки при 20°С. Після ретельного перемішування розчин фільтрують через сухий фільтр. Фільтрат йде на визначення титрусмої кислотності.
Б. Темнозабарвленні соки і вина попередньо розбавляють. Для цього 20 см відміреного піпеткою соку або вина переносять в мірну колбу місткістю 200 см і об'єм доводять дистильованою водою до мітки.
2.Визначення титрусмої кислотності
10 см"' відміреного піпеткою світлозабарвленого вина (соку), 20 см"' водної витяжки плодів (ягід) або розбавленого, як описано вище, темнозабарвленого вина (соку) переносять в конічну колбу місткістю 200-300 см3, додають 100 см3 дистильованої води, 1 см3 розчину фенолфталеїну і нагрівають до кипіння. Гарячий розчин титрують 0,1 н. розчином лугу до появи рожевого забарвлення, яке не зникає протягом 30 хв.
Титруєма кислотність виражається в г на 1 дм3 вина (соку) або на 100 г плодово-ягідної сировини.
Розрахунок проводиться по формулам
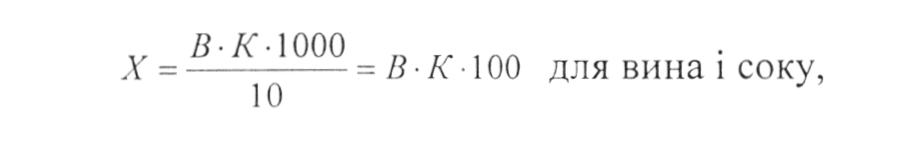
де: В - кількість лугу, яка пішла на титрування, см ;
К - кількість кислоти, г, яка відповідає 1 см3 0,1 н. розчину лугу (для винної 0,0075, для яблучної 0,0067, для лимонної 0,0064);
 де:
У -
ємкість
мірної колби, см ;
Д
-
наважка
плодів (ягід), г.
де:
У -
ємкість
мірної колби, см ;
Д
-
наважка
плодів (ягід), г.
ЛАБОРАТОРНА РОБОТА № 6
ВИЗНАЧЕННЯ ЛЕТКИХ КИСЛОТ
Мета роботи: ознайомитися з визначенням летких кислот по методу Матьє
Теоретична частина
Нижчі насичені аліфатичні одноосновні кислоти при звичайних умовах є рідинами. Вони легко переганяються з водяною парою. На цій властивості оснований метод визначення кислот в винах. Кислоти, які переходять в відгон, називають леткими (оцтова, мурав'їна, пропіонова, масляна). Вони змішуються з водою в будь-яких пропорціях. Починаючи з валеріанової кислоти всі послідуючі кислоти з числом атомів водню в молекулі до С9 представляють собою маслянисті рідини і розчиняються в воді в певному відношенні.
В винограді аліфатичні одноосновні насичені кислоти містяться в невеликих кількостях , в винах їх значно більше. В винограді і вині аліфатичні одноосновні насичені кислоти знаходяться в вільному стані, а також входять до складу складних ефірів. Деякі є складовою частиною воскового покриву ягід, виноградного масла.
З одноосновних насичених жирних кислот в найбільших кількостях в винах знайдена оцтова кислота, яка є основним компонентом летких кислот. Вміст летких кислот в білих ординарних столових винах (здорових) досягас 1,2 г/дм3, в ординарних червоних і кахетинських - 1,5, в марочних білих - 1,2 і в марочних червоних - 1,3 г/дм3.
Вміст летких кислот в вині виражають в г/дм3 в перерахунку на оцтову кислоту.
Методи визначення летких кислот основані на відгонці їх з вина з водяним паром, який пропускають через кипляче вино, і послідуючому титруванні відгону лугом. Водяну пару застосовують для більш повного відгону, так як температура кипіння летких кислот перевищує 100°С і повністю відігнати їх звичайним кип'ятінням неможливо.
При пропусканні через вино водяної пари оцтова кислота буде звітрюватись разом з ним пропорційно пружності парів при температурі перегонки.
В виноробній промисловості застосовуються такі методи визначення летких кислот: напівмікрометод і метод Матьє.
Напівмікрометод оснований на відгонці летких кислот з водяною парою. Метод Матьє оснований на відгонці з вина летких кислот без водяної пари.
Будова приладу
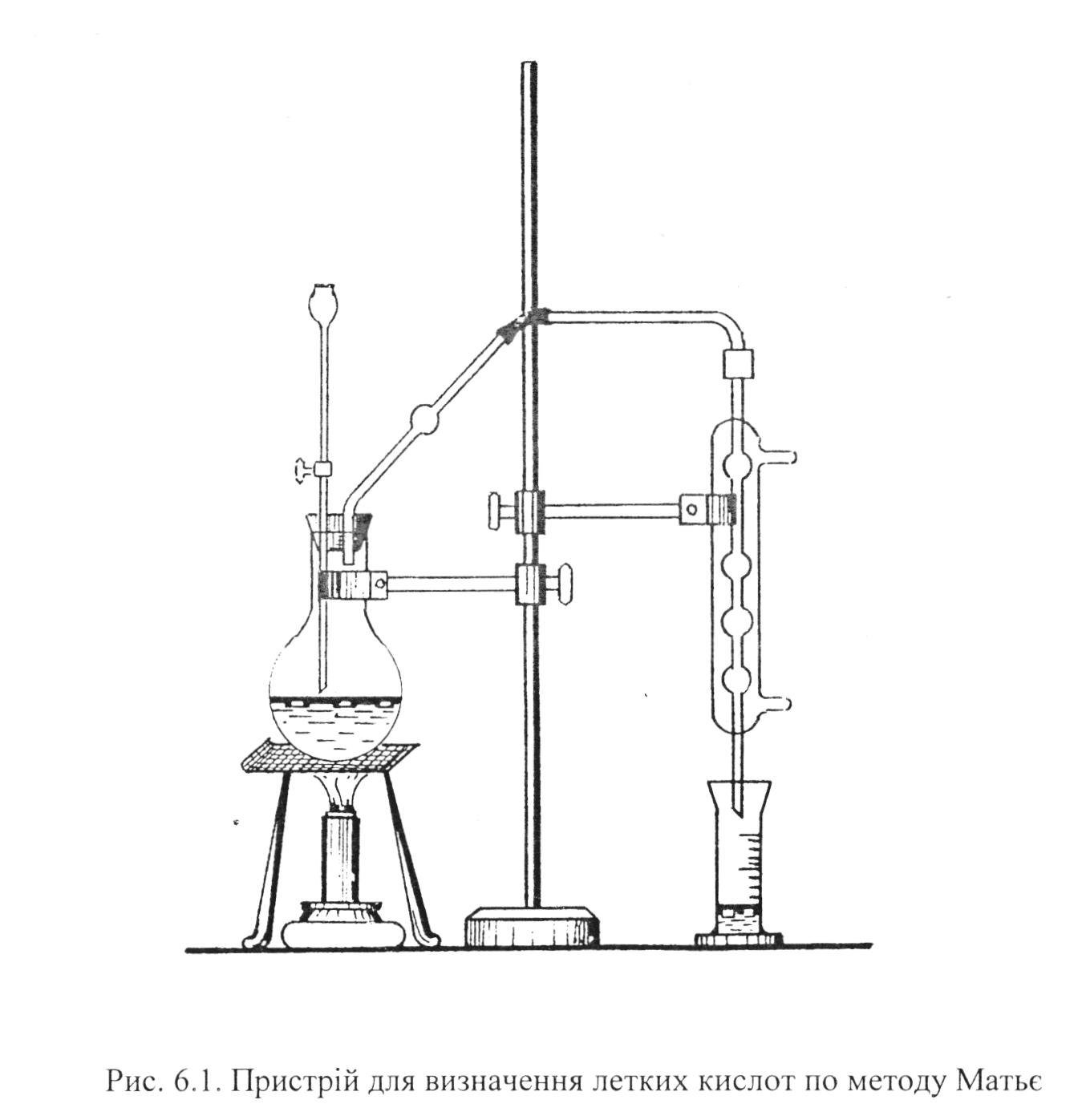
Прилад (рис.6.1) складається з перегонної круглодонної колби місткістю 100 см3, яка закривається резинового пробкою з двома отворами. В один з них вставлена воронка з пришліфованим краном, в інший - скляна трубка, сполучена з холодильником. Відгон збирають в мірний циліндр ємкістю 25 см , який має мітки на діленнях 6,12,18 і 24 см .
Хід виконання роботи
Відміряють піпеткою 10 см вина, наливають в перегонну колбу і розпочинають нагрівання. Після того як в приймачу збереться 6 см відгону, з воронки в перегонну колбу додають 6 см3 дистильованої води. При послідуючому зменшенні об'єму рідини в перегонній колбі на 6 см3 (що видно по відмітці на циліндрі) знову добавляють з воронки таку ж кількість води і так до тих пір, доки в приймачу не набереться 24 см3 дистиляту.
Потім дистилят переливають в конічну колбу ємкістю 100-200 см , ретельно зполоскують циліндр декілька разів дистильованою водою, зливаючи ополоски в ту ж колбу, нагрівають до температури 60-70°С, додають 1-2 краплі фенолфталеїну і титрують 0,1 н. розчином лугу до блідо-рожевого забарвлення, яке не зникає протягом 30 сек.
Вміст летких кислот X в г/см3 в перерахунку на оцтову кислоту обчислюють по формулі:
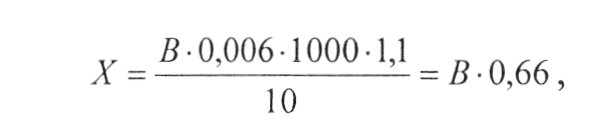
де: В - кількість 0,1 н. розчину лугу, яка пішла на титрування відгону,см3 ;
0,006 - кількість оцтової кислоти, яка відповідає 1 см3 0,1 н. розчину лугу, г;
1000 - множник для перерахунку на 1 см3 вина; 10 - кількість вина, яка взята для визначення, см3; 1,1 - поправка на неповноту переходу летких кислот в дистилят.
Контрольні питання
1. Які кислоти називаються леткими?
2. В якому вигляді леткі кислоти знаходяться в вині. Написати реакцію етерифікації.
3. В яких одиницях виражають вміст летких кислот?
4. Які існують методи визначення летких кислот?
5. В чому полягає визначення летких, кислот по методу Матьє.
ЛАБОРАТОРНА РОБОТА № 7
Визначення вмісту сірчистої кислоти
Мета роботи: визначити вміст сірчистої кислоти в вині йодометричним методом прямого титрування
Теоретична частина
Раніше вважалося, що SO2 не є природною складовою частиною винограду і вина. Останнім часом було, показано, що деякі винні дріжджі з сполук сірки, що містяться у винограді, при бродінні можуть утворювати помітні кількості SO2— до 50 мг/дм3 і більше.
Діоксид сірки широко використовується на різних етапах переробки винограду і виготовлення вин, що обумовлено його антисептичними й антиоксидантними властивостями.
При введенні SO2 у буферні розчини утворюються різноманітні його форми: неіонізований розчинений SO2, іони НSO3- і при рН вище 4 - іони сульфіту: SO2 -> НSO3- -> SO32-.
Між цими формами встановлюється динамічна рівновага, що залежить від рН і температури. Наприклад, при кімнатній температурі і рН 3-4 час установлення цієї рівноваги складає 3 дня. Паралельно частина введеного SO2 зв'язується зі складовими компонентами вина, частина дифундує в клітини мікроорганізмів, частина губиться за рахунок окислювання киснем повітря, який присутній у вині.
Сума газоподібного розчиненого в вині SO2 (1-10%) і його іонних форм у вигляді НSO3- (приблизно 94-96%) і SO32- (звичайно до 1 %) умовно позначається як вільна сірчиста кислота.
У суслах і винах, крім вільних форм, сірчиста кислота знаходиться в вигляді сполук з деякими компонентами. Цю частину умовно називають зв'язаною. Сума вільної і зв'язаної сірчистої кислоти називається загальною. Звичайно вільні форми SO2 складають 10-30% загальної кількості SO2 лише рідко до 40%.
Діоксид сірки зв'язується головним чином карбонільними сполуками (альдегіди, кетони). Міцність утворених речовин залежить від типу такої сполуки, рН, температури. Так, у лужному середовищі вони нестабільні вже при звичайній температурі, у кислому - для їх руйнування потрібні підвищені температури (десульфітація соків).
Інші карбонільні сполуки , що містяться в винах, менш активно реагують з SO2 і дають неміцні лабільні сполуки, що легко розпадаються і відновлюють вільний діоксид сірки при його витрачанні. Моносахариди (глюкоза, фруктоза, арабіноза й ін.) слабо зв'язують SO2. В розчинах сахарів альдегідні і кетонні функції проявляються формами, які займають транзитне положення в рівновазі ациклічних і циклічних їх форм.
Це пояснює високе значення констант рівноваги їх сполук з SO2:
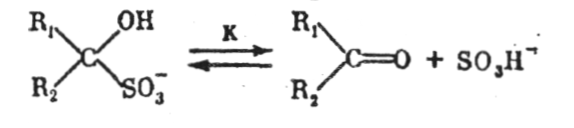
Константа рівноваги
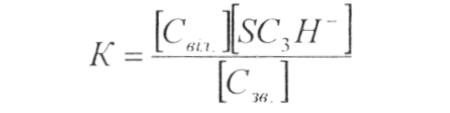
де Свіл, Сзв—молярна концентрація вільних і зв'язаних форм SO2.
Розглянемо найважливіші сполуки, що утворюються при зв'язуванні сірчистої кислоти у винах.
Альдегідсірчиста кислота утворюється в результаті реакції Н2SO4 з альдегідом:
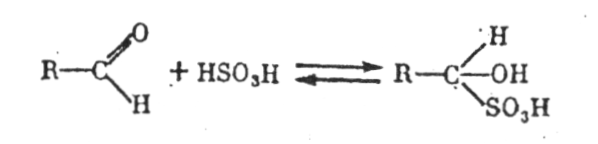
Альдегідсірчиста кислота характерна для сухих вин і зброджених сусел. У сухих винах (особливо білих) представлено до 50-70% зв'язаних форм SO2. Константа дисоціації альдегідсірчистої кислоти дуже низька, тому вільного діоксиду сірки в присутності цієї кислоти в розчині може міститися біля 1-3%. Зміна рН у кислій зоні (у межах рН вина) не впливає на константу дисоціації кислоти. Підвищення температури, наприклад, з 20 до 37 °С також помітно не змінює константу дисоціації, що дуже важливо, тому що концентрація SO2 в результаті розпаду сполук з альдегідами не може помітно підвищуватися в шлунку людини при споживанні вина.
Швидкість зв'язування ацетальдегіду з діоксидом сірки досить висока і залежить від рії. Так, при рН 1,0 реакція проходить на 98% за 6 год і повністю закінчується за 24 год, при рН 3,3 вона проходить на 98% за 90 хв і закінчується за 5 год і при рН 7,0 зв'язування відбувається за декілька хвилин. І Іри витримці вина внаслідок поступового зниження вмісту вільного діоксиду сірки (випарювання, окислювання, реакція з іншими речовинами) відбувається розпад альдегідсірчистої кислоти і звільнення вільного ацетальдегіду, що, у свою чергу, вступає в реакцію з іншими компонентами вина, наприклад з речовинами, що забарвлюють вино.
Сполуки SO2 з сахарами характерні для сусел, десертних і напівсолодких вин. З сахарів найбільш тривкі сполуки з діоксидом сірки утворює арабіноза. Глюкоза зв'язується з ним майже в 10 разів слабше арабінози, а фруктоза і сахароза не зв'язуються зовсім.
Сполуки SO2 з іншими компонентами вина утворюються досить легко. Наприклад, реакція взаємодії цистеїну з SO2 протікає швидко, цистеїнсульфонова кислота, що утворюється, є досить стійкою сполукою. Сірчиста кислота, як і її солі, також може приєднуватися до антоціанів. Сполука, що утворилася, проте, неміцна, легко руйнується при нагріванні з вивільненням вихідних речовий у незмінному вигляді. Реакція сірчистої кислоти з антоціанами легко виявляється по їхньому знебарвленню. У старих винах, де вільних антоціанів мало, ефект знебарвлення сірчистої кислоти незначний.
Глюкуронова і галактуронова кислоти, знайдені в суслі і винах в кількості 200-1000 мг/дм , досить активно реагують із сірчистою кислотою. Так, при наявності 100 мг/дм вільної 802 і рН 3,3 1 г глюкуронової кислоти зв'язує 10 мг, а 1 г галактуронової — 25 мг сірчистої кислоти. Всього у винах за рахунок уронових кислот зв'язується приблизно 2-25 мг/дм3 SO2. Кетокислоти сусла і вина взаємодіють із сірчистою кислотою ще енергійніше.
Антимікробна дія SO2. Кількість SO2, яка вводиться в сусло або вино, не є тієї концентрацією, дії якої піддаються мікроорганізми. Встановлено, що тільки вільний SO2 є основною формою, що володіє антимікробною дією. Довгий час вважалося, що з вільних форм лише недисоційована сірчиста кислота має таку властивість, проте потім було встановлено, що при низьких рН недисоційована сірчиста кислота в розчинах не виявляється, оскільки її дисоціація проходить практично миттєво. Розчинений SO2 складає тільки невелику частину вільної сірчистої кислоти (від 1 до 10%). Основна частина її знаходиться у вигляді бісульфіту, що не володіє антисептичною дією. Виходячи з залежності концентрації вільного SO2 від рН були розраховані кількості розчиненого неіонізованого SO2 у розчинах для різних рН. Пі кількості Б02 (у %.), що є найбільш активно діючою антимікробною частиною введеного діоксиду сірки, одержали назву Б02 молекулярний (табл. 7.1).
Таблиця 7.1
рН |
Молекулярний SO2 |
Бісульфіт |
Сульфіт |
3,0 |
6,06 |
93,92 |
0.01 |
3,2 |
3,91 |
96,07 |
0,01 |
3,4 |
2,50 |
97,46 |
0,03 |
3,6 |
1,59 |
98,36 |
0,04 |
3,8 |
1,01 |
98,91 |
0,07 |
4,0 |
0,64 |
99,24 |
0,11 |
4,2 |
0,40 |
99,40 |
0,19 |
4,4 |
0,25 |
99,44 |
0.30 |
Розрахунок молекулярного SO2 прийнятий за критерій визначення оптимальних кількостей 802, які вводяться у вино на різних етапах з урахуванням рН вина і його спроможності зв'язувати SO2. Для попередження бродіння необхідно забезпечити в суслі концентрацію молекулярного SO2 1,50 мг/дм3. Для забезпечення біологічної стійкості вин, що містять залишковий сахар, достатньо молекулярного SO2 1,20 мг/дм3. Більш низькі його концентрації можуть бути використані у випадку зберігання вин при знижених температурах. Характерний запах діоксиду сірки з'являється при концентраціях його молекулярної форми 2 мг/дм3 і більше.
Детальне вивчення різних форм SO2 дозволило встановити, що всупереч думці, що існувала, зв'язані форми також проявляють інгібіруючу дію на мікроорганізми. Виявилося, що вона приблизно в 5-6 разів нижча, чим у вільного (молекулярного) SO2. Зв'язаний SO2 діє бактеріостатично, а вільний -бактерицидно. Інгібіруюча дія зв'язаного SO2 пояснюється подвійно. З одного боку, дріжджі асимілюють зв'язані форми, що утворюються, і в результаті метаболізму визволяється вільний SO2, за рахунок чого його вміст в середовищі збільшується. Проте такий шлях малоймовірний, оскільки усяке внутрішньоклітинне виділення вільного SO2 могло б спричинити загибель мікроорганізмів. З іншого боку, вільний SO2, що виділяється, зв'язується з речовинами, які містяться в середовищі або утворюються під дією мікроорганізмів, (діацетилом, ацетоїном і ін.).
Більш правильним поясненням інгібіруючої дії зв'язаного 802 варто вважати дію вільного SO2 (молекулярного), що завжди супроводжує зв'язані форми у певних співвідношеннях. Оскільки в середовищі в залежності від рН постійно існує рівновага між зв'язаними і вільними формами SO2, то при збільшенні концентрації, наприклад, зв'язаної форми ацетальдегід — бісульфіт у 4 рази в середовищі концентрації вільного Б02 і ацетальдегіду підвищуються в 2 рази. Цим пояснюють більш сильну дію одних зв'язаних форм у порівнянні з іншими. Так, у SO2, зв'язаного з піруватом, який має більш високу константу дисоціації, інгібіруюча дія сильніша, ніж у SO2, зв'язаного з ацетальдегідом.
Докладне вивчення механізму дії SO2 на мікроорганізми показало, що молекулярний SO2 діє на клітинні мембрани дріжджів і руйнує їхню структуру. Він також інгібірує ферментні системи і може мати мутагенну дію. Стійкість різних родів і штамів дріжджів до SO2 неоднакова і може бути їм властива або придбана. В останньому випадку вона пов'язана з мутагенною дією SO2 і є наслідком скоріше генетичних змін, чим фізіологічної дії SO2. Придбана до Б02 стійкість здатна передаватися у дріжджів у спадщину і зберігатися.
Останнім часом за рубежем рекомендується використовувати в якості часткового замінника SO2 сірководень. Н2S присутній у вині в молекулярній недисоційованій формі і практично не володіє антимікробною дією. Він є антиоксидантом, інгібірує окисні ферменти, блокуючи в них активований іон міді. Вважається доцільним вводити його в сусло (доза 5-20 мг/дм ) для пригнічення окислювальних ферментів.
Для визначення сірчистої кислоти в виноробній промисловості користуються за звичай йодометричним методом прямого титрування. Цей метод оснований на окисленні сірчистої кислоти в сірчану з допомогою йоду
Н2SO3+І2+Н20-->Н2 SO4+2НІ
( Індикатором в цій реакції слугує крохмаль, який дає з йодом синє забарвлення.
Так як зв'язана сірчиста кислота безпосередньо з йодом вступати в реакцію не може, її необхідно перевести в вільний стан. Для цього спочатку додаванням лугу переводять всю сірчисту кислоту в сірчистокислу сіль
R-С-SO3Н+2NaОН->R-СНО+Na2SO3+2Н20
а потім вже при послідуючому підкисленні сірчаною кислотою одержують вільну сірчисту кислоту
Na2SO3+Н2SO4= Н2SO3+ Na2SO4.
Вміст сірчистої кислоти виражають в мг/дм3.
Хід виконання роботи
