
- •Исследование электропроводности металлов и полупроводников
- •Введение
- •Энергетические зоны в кристаллах
- •Электропроводность металлов
- •Электропроводность полупроводников
- •Часть I. Экспериментальное исследование температурных зависимостей электропроводности металлов Методика эксперимента
- •Порядок выполнения работы
- •Часть II. Экспериментальное исследование температурных зависимостей электропроводности полупроводников Методика эксперимента
- •Порядок выполнения работы
- •Контрольные вопросы
Лабораторная работа №4
Исследование электропроводности металлов и полупроводников
Цель работы: экспериментальное исследование температурных зависимостей электропроводности металлов и полупроводников. Определение температурного коэффициента сопротивления и коэффициента температурной чувствительности.
Приборы и принадлежности: блок генератора напряжений ГН1, блок амперметра-вольтметра АВ1, стенд с объектами исследования С3-ТТ01.
Введение
Как известно, по своим электрическим свойствам одни химические элементы в кристаллическом состоянии являются проводниками, а другие наоборот – диэлектриками или полупроводниками; некоторые металлы (серебро, медь) обладают высокой электропроводностью, а другие (висмут, ртуть) – низкой, углерод в виде графита – хороший проводник электричества, а в виде алмаза – почти идеальный диэлектрик, у металлов с повышением температуры проводимость падает, а у полупроводников – увеличивается.
С точки зрения классической физики это было совершенно непонятным. Действительно, например, удельное сопротивление меди ρ = 1,7·10-8 Ом·м, а у янтаря ρ = 1·1023 Ом·м, т.е. в 1031 раз больше. Удельное же сопротивление полупроводников занимает довольно широкий интервал от 10-5 до 108 Ом·м. В то же время и те и другие состоят из атомов с положительно заряженным ядром и движущихся электронов.
Объяснить столь сильное различие кристаллов по электрических свойствам удалось только в процессе развития квантовой физики.
Энергетические зоны в кристаллах
Рассмотрим мысленно процесс образования твердого тела из изолированных атомов. Пока атомы изолированы, т.е. находятся на макроскопических расстояниях друг от друга, они имеют совпадающие схемы энергетических уровней. Когда же расстояния между ними станут равными межатомным расстояниям в твердых телах, взаимодействие между атомами приводит к расщеплению атомных энергетических уровней в зоны. Образуется так называемый энергетический спектр (рис. 4.1).
Заметно расщепляются лишь уровни внешних валентных электронов, наиболее слабо связанных с ядром и имеющих наибольшую энергию. Уровни же внутренних электронов либо совсем не расщепляются, либо расщепляются слабо. Следовательно, в твердых телах внутренние электроны ведут себя так же, как и в изолированных атомах, валентные же электроны принадлежат всему твердому телу - коллективизированы.

а б
Рис. 4.1. Образование зон в кристаллах: а – расщепление уровней при сближении атомов, б – уровни свободного атома.
Образование
зон в кристаллах является квантово-механическим
эффектом и вытекает из соотношения
неопределенностей. В кристалле валентные
электроны атомов могут переходить от
атома к атому через потенциальные
барьеры при помощи туннельного эффекта.
Это приводит к тому, что среднее время
жизни
![]() валентного
электрона в данном атоме по сравнению
с изолированным атомом существенно
уменьшается (~10-15
сек.). Время жизни электрона в каком-либо
состоянии связано с неопределенностью
его энергии (шириной уровня) соотношением
неопределенностей –
валентного
электрона в данном атоме по сравнению
с изолированным атомом существенно
уменьшается (~10-15
сек.). Время жизни электрона в каком-либо
состоянии связано с неопределенностью
его энергии (шириной уровня) соотношением
неопределенностей –
![]() .
Следовательно, если естественная ширина
линий ~ 10-7эВ,
то в кристалле E
10-21
эВ, т.е. энергетические уровни расширяются
в зону дозволенных
значений энергии.
.
Следовательно, если естественная ширина
линий ~ 10-7эВ,
то в кристалле E
10-21
эВ, т.е. энергетические уровни расширяются
в зону дозволенных
значений энергии.
Таким образом, при образовании зоны происходит расщепление энергетических уровней, т.е. смещение уровней относительно их исходного положения в изолированном атоме (рис. 4.2). Энергия внешних электронов может принимать значения в пределах областей, называемых разрешенными энергетическими зонами. Расстояние между соседними энергетическими уровнями в зоне составляет около 10-23 эВ, т.е. зоны можно считать практически непрерывными.
Разрешенные энергетические зоны разделены зонами запрещенных значений энергии – запрещенными энергетическими зонами.
Зонная теория твердых тел объясняет различия между металлами, полупроводниками и диэлектриками различным заполнением электронами разрешенных энергетических зон и различной шириной запрещенной зоны.
 а б
а б
Рис. 4.2. Образование зон: а –энергетические уровни изолированных атомов, б – энергетическая зона кристалла, образованная из этих уровней
Степень заполнения электронами энергетических уровней в зоне определяется заполнением соответствующего атомного уровня. Если какой-то уровень атома полностью заполнен электронами в соответствии с принципом Паули, то образующаяся из него зона также полностью заполнена. Из незаполненных уровней образуются свободные зоны, из частично заполненных – частично заполненные зоны.
Р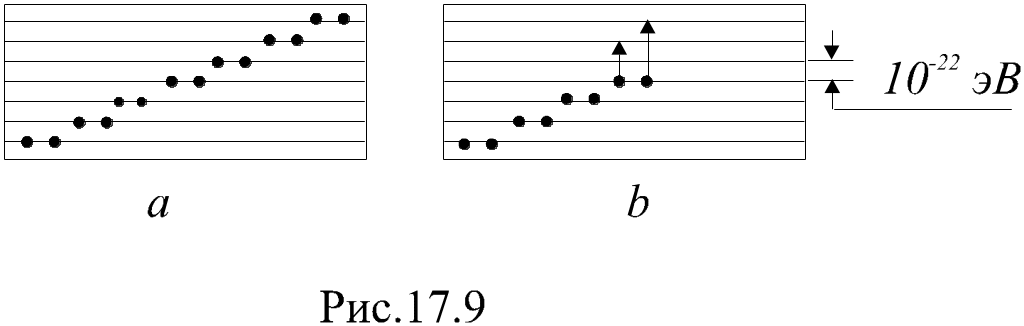 ассмотрим
более подробно, как будут вести себя в
присутствии электрического поля
электроны из зон с разной степенью
заполнения. Электроны из заполненной
зоны (рис.4.3a)
не могут изменить состояния своего
движения: внутризонные переходы запрещены
принципом Паули, так как свободных
уровней в зоне нет. Даже очень сильное
электрическое поле не может сообщить
электронам энергию, достаточную для
того, чтобы перевести их в следующую
зону со свободными уровнями.
ассмотрим
более подробно, как будут вести себя в
присутствии электрического поля
электроны из зон с разной степенью
заполнения. Электроны из заполненной
зоны (рис.4.3a)
не могут изменить состояния своего
движения: внутризонные переходы запрещены
принципом Паули, так как свободных
уровней в зоне нет. Даже очень сильное
электрическое поле не может сообщить
электронам энергию, достаточную для
того, чтобы перевести их в следующую
зону со свободными уровнями.
а б
Рис. 4.3. Энергетические зоны: а – полностью заполненная, б – частично заполненная
Средняя длина свободного пробега электрона имеет порядок ~ 10-8 м, и при напряженности поля Е~ 104 В/м на этом расстоянии электрон может приобрести энергию лишь в 10-4 эВ. Это существенно меньше, чем расстояние между зонами. Следовательно, электроны, находящиеся в заполненной зоне, не могут участвовать в проводимости. Иначе обстоит дело с электронами из частично заполненной зоны (рис. 4.3б): они легко могут изменять состояние своего движения, переходя на свободные уровни, т.к. расстояние между уровнями в зоне ~ 10-22 эВ, а энергия теплового движения даже при температуре Т = 1 К имеет порядок 10-4 эВ. Поэтому электроны из частично заполненной зоны могут участвовать в проводимости. Следовательно, кристаллы с частично заполненной электронами зоной являются проводниками, а кристаллы с полностью заполненной валентной зоной – полупроводниками или диэлектриками. Последние отличаются друг от друга только шириной запрещенной зоны: у диэлектриков она больше, чем у полупроводников.
Рассмотрим несколько примеров.
1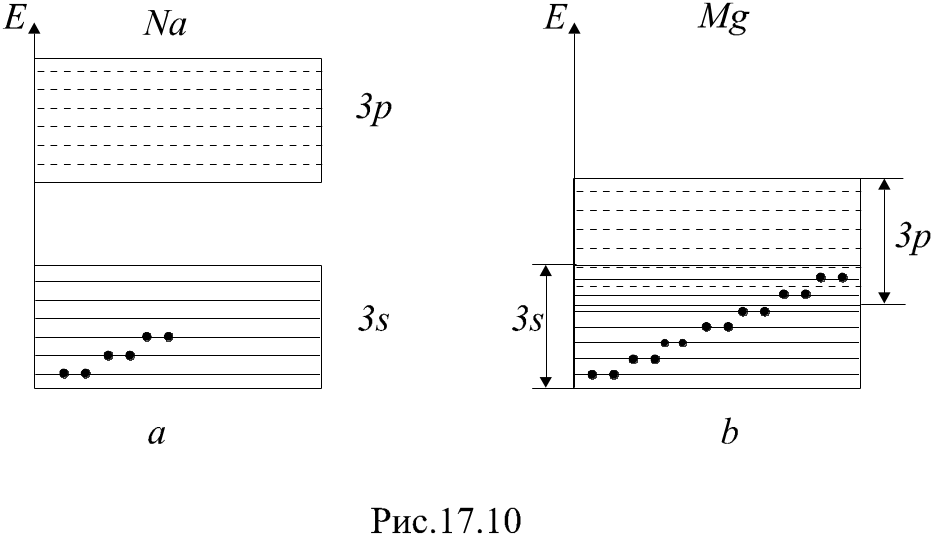 )
Металлы.
Зонные схемы металлов рассмотрим на
примерах натрия и магния. Атом натрия
имеет электронную конфигурацию
)
Металлы.
Зонные схемы металлов рассмотрим на
примерах натрия и магния. Атом натрия
имеет электронную конфигурацию
![]() .
Поскольку на
.
Поскольку на
![]() -уровнях
могут находиться два электрона, а у
атома натрия на 3s
-уровне находится только один электрон,
то зона
проводимости,
образующаяся из этих уровней, заполнена
электронами наполовину (рис. 4.4a).
Следующая зона 3p
свободна от электронов. Электронная
конфигурация магния –
-уровнях
могут находиться два электрона, а у
атома натрия на 3s
-уровне находится только один электрон,
то зона
проводимости,
образующаяся из этих уровней, заполнена
электронами наполовину (рис. 4.4a).
Следующая зона 3p
свободна от электронов. Электронная
конфигурация магния –
![]() .
Зона 3s
у магния целиком заполнена электронами,
но она перекрывается со свободной зоной,
образованной из 3p-уровней
(рис. 4.4б). В результате этого перекрывания
образуется объединенная 3s-3p
зона, которая заполнена электронами
частично и, следовательно, является
зоной
проводимости.
.
Зона 3s
у магния целиком заполнена электронами,
но она перекрывается со свободной зоной,
образованной из 3p-уровней
(рис. 4.4б). В результате этого перекрывания
образуется объединенная 3s-3p
зона, которая заполнена электронами
частично и, следовательно, является
зоной
проводимости.
а б
Рис. 4.4. Зонные схемы металлов: а – натрия, б – магния
2) Полупроводники.
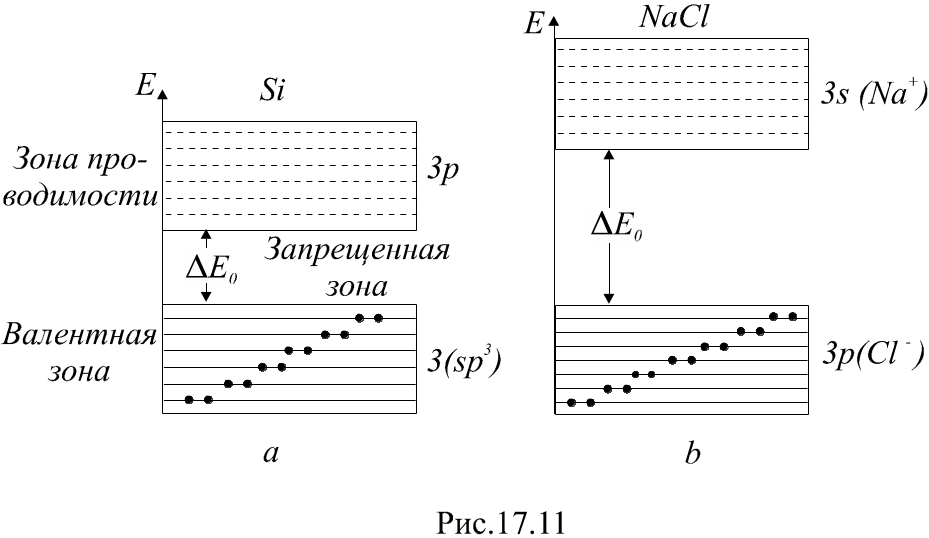
Как пример полупроводника рассмотрим
кристалл кремния. Электронная конфигурация
изолированного атома кремния –![]() .
Но мы знаем, что в кристалле кремний
образует четыре равноценных ковалентных
связи с соседними атомами, следовательно,
его электронная конфигурация изменяется
при образовании кристалла. Один из 3s
- электронов возбуждается на 3p-уровень,
а затем происходит гибридизация
электронных орбиталей типа
.
Но мы знаем, что в кристалле кремний
образует четыре равноценных ковалентных
связи с соседними атомами, следовательно,
его электронная конфигурация изменяется
при образовании кристалла. Один из 3s
- электронов возбуждается на 3p-уровень,
а затем происходит гибридизация
электронных орбиталей типа
![]() .
Эти
.
Эти
![]() -гибридизованные
электроны и заполняют целиком валентную
зону, а зона проводимости образуется
из свободных 3p
-уровней (рис. 4.5a).
-гибридизованные
электроны и заполняют целиком валентную
зону, а зона проводимости образуется
из свободных 3p
-уровней (рис. 4.5a).
 а б
а б
Рис. 4.5. Зонные схемы: а – полупроводника, б – диэлектрика
3) Диэлектрики.
Примером кристаллического диэлектрика
может служить хлорид натрия NaCl.
Это кристалл с ионной связью
![]() .
Так как ион хлора несет отрицательный
заряд, энергия его электронов выше, чем
у электронов натрия. Электронная
конфигурация иона хлора имеет вид
.
Так как ион хлора несет отрицательный
заряд, энергия его электронов выше, чем
у электронов натрия. Электронная
конфигурация иона хлора имеет вид
![]() .
Валентная зона образуется из 3p-уровней.
Ближайшая к валентной свободная зона
образуется из свободных 3s-уровней
иона
.
Валентная зона образуется из 3p-уровней.
Ближайшая к валентной свободная зона
образуется из свободных 3s-уровней
иона
![]() (рис.2.5б).
(рис.2.5б).
Мы видим, что
зонные схемы полупроводников и
диэлектриков одинаковы. Они отличаются
лишь шириной запрещенной зоны
![]() .
У кремния ΔЕ0=
1,1 эВ, у NaCl
ΔЕ0=
6 эВ. При температуре абсолютного нуля
как кремний, так и хлористый натрий не
проводят электрический ток. Но при
комнатных температурах энергии теплового
движения атомов кремния достаточно для
того, чтобы перебросить электроны из
валентной зоны в зону проводимости. Так
происходит тепловое возбуждение
электропроводности кремния, и поэтому
кремний является полупроводником. У
хлорида натрия такого процесса не
наблюдается, поскольку ширина запрещенной
зоны велика, и энергии теплового движения
недостаточно для возбуждения
электропроводности. Поэтому NaCl
является диэлектриком.
.
У кремния ΔЕ0=
1,1 эВ, у NaCl
ΔЕ0=
6 эВ. При температуре абсолютного нуля
как кремний, так и хлористый натрий не
проводят электрический ток. Но при
комнатных температурах энергии теплового
движения атомов кремния достаточно для
того, чтобы перебросить электроны из
валентной зоны в зону проводимости. Так
происходит тепловое возбуждение
электропроводности кремния, и поэтому
кремний является полупроводником. У
хлорида натрия такого процесса не
наблюдается, поскольку ширина запрещенной
зоны велика, и энергии теплового движения
недостаточно для возбуждения
электропроводности. Поэтому NaCl
является диэлектриком.
Рассмотрим более подробно зависимость электропроводности металлов и полупроводников от температуры.
