
- •Список сокращений
- •Введение
- •Ферментативные пути образования активных форм кислорода
- •2) Развитие цепи:
- •4) Разрушение структуры окисленных липидов
- •Перекисная гипотеза гибели клеток. Системы антиоксидантной защиты. Роль пол в норме и при патологии
- •Антиоксиданты неферментативной природы
- •Ферментные системы антиоксидантной защиты
- •Структурный антиоксидантный фактор.
- •Лейкотриены
- •Свободнорадикальный механизм антимикробной защиты грудного молока
- •Содержание
- •344006, Г. Ростов-на-Дону, ул. Суворова, 19, тел. 247-34-88
Г осударственное
бюджетное образовательное учреждение
Высшего профессионального образования
«Ростовский государственный медицинский
осударственное
бюджетное образовательное учреждение
Высшего профессионального образования
«Ростовский государственный медицинский
университет Министерства здравоохранения и социального развития Российской Федерации»
кафедра общей и клинической биохимии №2
Шепелев А.П., Шестопалов А.В., Ставиский И.М.
Перекисное окисление липидов в норме и патологии
Учебно-методическое пособие
Ростов-на-Дону
2013
У ДК:
616.24-008.9
ДК:
616.24-008.9
ББК: 54.12
Утверждено на заседании Центральной методической комиссии
Государственного бюджетного образовательного учреждения Высшего профессионального образования «Ростовский государственный медицинский университет Министерства здравоохранения и социального развития Российской Федерации»
Протокол №8от 2012 г.
Шепелев А.П., Шестопалов А.В., Ставиский И.М.Перекисное окисление липидов /учебно-методическое пособие / Шепелев А.П., Шестопалов А.В., Ставиский И.М.2007. – Ростов-на-Дону: Государственное бюджетное образовательное учреждение Высшего профессионального образования «Ростовский государственный медицинский
университет Министерства здравоохранения и социального развития Российской Федерации– 2012. – 46 с.
Составлено на кафедре общей и клинической биохимии №2Государственного бюджетного образовательного учреждения Высшего профессионального образования «Ростовский государственный медицинский университет Министерства здравоохранения и социального развития Российской Федерации»
д.м.н., профессором Шепелевым А.П., д.м.н. Шестопаловым А.В. – заведующим
кафедрой общей и клинической биохимии №2 и к.м.н., доцентом Стависким И.М.
Представлены особенности метаболических процессов образования, функциональных эффектов и роли свободных радикалов в норме и в развитии патологических процессов в организме человека.
Рецензенты:
Доктор биологических наук, профессор, директор НИИ биологии Южного Федерального университета Шкурат Т.П.
Кандидат медицинских наукнаук, ассистент кафедры гематологии и трансфузиологии с курсом клинической лабораторной диагностики ФПК и ППСГосударственного бюджетного образовательного учреждения Высшего профессионального образования «Ростовский государственный медицинский университет Министерства здравоохранения и социального развития Российской Федерации» Волкова М.С.
© Государственное бюджетное образовательное учреждение Высшего профессионального образования «Ростовский государственный медицинский
университет Министерства здравоохранения и социального развития Российской Федерации»
© А.П.Шепелев, А.В.Шестопалов, И.М.Ставиский.
Список сокращений
АО – система антиоксидантной защиты
АОС –антиоксидантная система.
АФК –активные формы кислорода
ЛТ - лейкотриен
5-ЛОГ – 5-липоксигеназа
МПО – миелопероксидаза
МДА – малоновый диальдегид
МРСА -
МТ – металлотионеины.
5-НРЕТЕ - 5-гидроксипероксиэйкозатетраеновая кислота
ONOO- - пероксинитрил
ПГ - простагландин
ПОЛ – перекисное окисление липидов
Протеинкиназа G – фермент катализирует фосфорилирование киназы легких цепей
миозина
СОД – супероксиддисмутаза.
СРО – свободно радикальное окисление
СРОЛ – свободно-радикальное окисление липидов
ТХ - тромбоксан
ФЭА – фосфатидилэтаноламин
ЦОГ – циклоксигеназа
ЦП – церулоплазмин.
ЦПЭ – цепь переноса электронов
цГМФ – циклическая форма гуанозимонофосфата
ЭПО – пероксидаза эозинофилов.
GSNO - нитрозоглютатион
GSH–восстановленный глютатион
Введение
Перекисное окисление липидов (ПОЛ) относится к типичным свободнорадикальным реакциям.
Свободнорадикальное окисление (СРО) с одной стороны, участвует в регуляции жизненных процессов и обеспечивает защитные и компенсаторные реакции организма на действие повреждающих факторов различной этиологии, с другой стороны, СРО лежит в основе старения организма и является одним из главных механизмов гибели клеток.
СРО в организме противостоит мощная система антиоксидантов (АО). Благодаря сбалансированности систем СРО и АО, все свободнорадикальные реакции находятся под контролем АО и легко регулируются, что позволяет организму в зависимости от конкретных условий использовать СРО для обеспечения многих жизненно важных процессов. Однако нарушение баланса, обусловленное стимуляцией СРО и снижением активности АО, может привести к накоплению продуктов СРО и в силу их высокой реакционной способности вызвать изменение структуры нуклеопротеидов, белков, липидов и других важнейших соединений, что чревато развитием в организме патологических процессов. Нарушение баланса СРО и АО называется окислительным стрессом и лежит в основе развития многих заболеваний как инфекционной, так и неинфекционной природы. СРО протекает, как правило, с обязательным участием кислорода.
Активные формы кислорода образуются во многих клетках в результате последовательного одноэлектронного присоединения 4 электронов к 1 молекуле кислорода.
O ₂
₂ O₂
O₂
 [
O2
+
[
O2
+ ]+
ē 2
]+
ē 2
+H⁺+2H⁺ 3H+ 4H⁺
← ←
HO₂H₂O₂HO 2H₂O
2H₂O
Конечный продукт этих реакций - вода, но по ходу реакций образуются химически активные формы кислорода. Наиболее активен гидроксильный радикал, взаимодействующий с большинством органических молекул. Он отнимает от них электрон и инициирует, таким образом, цепные реакции окисления.
Различают неферментативное и ферментативное образованиеАФК.
При неферментативном механизме образования АФК в основе процесса лежат следующие реакции:
1
.O₂ O2
2. O₂
+ H⁺HO₂
O2
2. O₂
+ H⁺HO₂
3.
HO₂
 HO₂⁻
4.HO₂⁻
+ H⁺H₂O₂
HO₂⁻
4.HO₂⁻
+ H⁺H₂O₂
5.
H₂O₂ HO
+ HO⁻
6.H₂O₂
+ O₂
HO
+ HO⁻
+ O₂
HO
+ HO⁻
6.H₂O₂
+ O₂
HO
+ HO⁻
+ O₂
К активным формам кислорода (АФК) относят следующие кислородсодержащие радикалы : ОН• - гидроксильный радикал; О2•- супероксидный анион-радикал, NO•- оксинитрил,а также Н2О2 - пероксид водородаи НОСl -гипохлорная кислота. Строго говоря, последние два соединения к свободным радикалам не относятся, однако из перекиси водорода в присутствии атомов восстановленного железа F2+ и (или) О2•очень быстро образуется одна из наиболее активных форм кислорода – гидроксильный радикал:
Н2О2 + Fe2+→HO• + ОН- + Fe3+ –реакция Фентона
Н2О2 + О2• Fe++ HO• + ОН-+ О2 -реакция Хабера-Вейса
HOCl + О2• → HO• +Cl• + О2
Одним из основных источников образования АФК является митохондриальная цепь переноса электронов (ЦПЭ).
Утечка электронов из ЦПЭ митохондрий и микросом и непосредственное их взаимодействие с кислородом - основной путь образования активных форм кислорода в большинстве клеток.
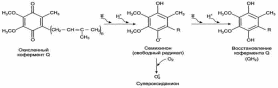
Рис. 1. Реакции образования АФК в дыхательной цепи.
Кофермент Q в ЦПЭ митохондрий принимает от доноров последовательно по одному электрону, превращаясь в форму семихинона - KoQH•. При изменении условий функционирования дыхательной цепи (например, при гипоксии) в ней также возможно одноэлектронное восстановлениекислорода, объясняющееся тем, что его сродство к убихинону выше, чем к цитохромоксидазе. Эти процессы приводят к образованию супероксидного анион-радикала кислорода.
Супероксид-анион радикал является высокореакционным соединением, которое вследствие высокой гидрофильности и наличия заряда не может покидать клетку и накапливается в цитоплазме. Его превращения приводят к образованию ряда активных окислителей.Этот радикал может образовываться и под влиянием ультрафиолетовых лучей, а также путем взаимодействия кислорода с ионамиметаллов переменной валентности (чаще всего с железом) или в ходе спонтанного окисления некоторых соединений, например дофамина. Наконец, он может продуцироваться в клетках и такими ферментами, как ксантиноксидаза или НАДФН-оксидаза.
Он способен активировать NO-синтазу, которая образует в тканяхNO-радикал, обладающий свойствами вторичного посредника (активирует растворимую гуанилатциклазу, продукт которой – цГМФ – проявляет вазодилататорные свойства). С другой стороны, супероксид-анион способен снижать содержание NO-радикала, превращая его в пероксинитрит - ONOOH.
Этот
радикал может непосредственно
взаимодействовать с кислородом, образуя
супероксидный анион
 ,
который, в свою очередь, может превращаться
в другие активные формы кислорода:
,
который, в свою очередь, может превращаться
в другие активные формы кислорода:

Пероксид водорода химически не очень активен, но способствует образованию наиболее токсичной формы кислорода - гидроксильного радикала (ОН•) по следующей реакции:
Fe2+ + Н2О2 → Fe3+ + ОН- + ОН•.
Наличие в клетках Fe2+ или ионов других переходных металлов увеличивает скорость образования гидроксильных радикалов и других активных форм кислорода. Например, в эритроцитах окисление иона железа гемоглобина способствует образованию супероксидного аниона.
