
- •Консультация по теме «Электрохимические процессы. Гальванический элемент. Электролиз» Электрохимические процессы
- •Источники тока (хит):
- •Возникновение потенциала на границе раздела фаз
- •Гальванический элемент
- •Потенциалы металлических электродов
- •Основы электрохимической кинетики электродных процессов
- •Электролиз
- •Применение электролиза
- •2. Электролиз в металлургии
- •3. Эхом – электрохимическая обработка металлов.
Консультация по теме «Электрохимические процессы. Гальванический элемент. Электролиз» Электрохимические процессы
процессы прямого превращения химической энергии в электрическую и, наоборот, электрической энергии в химическую в результате протекания электрохимических реакций.
Х и м и ч е с к и е р е а к ц и и
Окислительно-восстановительные – протекают с изменением степени окисления участников (ОВР)
Ионно-обменные – протекают без изменения степени окисления участников
Но2 + Оо2 = Н+2О-2 - окислительно-восстановительная (ОВР)
H+NO3 + K+O-2H+ = H+2O-2 + K+NO3 – ионно-обменная
Zno + Cu+2SO4=Zn+2SO4 + Cuo (3) окислительно-восстановительная
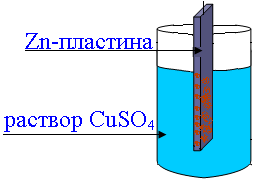
Контактное осаждение меди на цинке: при опускании Zn-пластины в раствор CuSO4 наблюдается выделение металлической меди, пластина покрывается рыжим
налетом (реакция Zno + Cu2+SO4=Zn2+SO4 + Cuo).
Степень окисления (СО) – воображаемый заряд атома с соединении, вычисленный, исходя из предположения, что соединение состоит из ионов.
Правила:
в простом веществе СО элемента = 0; СО иона = заряду иона;
алгебраическая сумма СОэлементов в молекуле = 0;
в ковалентных соединениях отрицательная СО относится к атому с большей ЭО.
СОF = -1, COO = -2 (в пероксидах СОО = -1, в OF2 СОО = +2), COH = +1 (в гидридах COH = -1).
В любой ОВР - 2 полуреакции: окисления и восстановления.
Окисление – отдача электронов веществом (СО повышается). Вещество, отдающее электроны – восстановитель.
Восстановление – смещение электронов к веществу (СО понижается) Вещество, принимающее электроны – окислитель.
Zno = Zn2+ + 2e – окисление (отдача е)
Cu+2 +SO42- + 2e = Cuo + SO42- - восстановление (принятие е)
Zno + CuSO4(р) = ZnSO4(р) + Cuo – суммарно.
При составлении ОВР - метод электронного баланса (количество отдаваемых электронов равно количеству принимаемых, число одноименных ионов в правой и левой частях уравнения одинаково).
Возможность протекания ОВР в определенных условиях устанавливают, рассчитывая изменение энергии Гиббса.
Если пространственно разделить эти две полуреакции, а переход электронов осуществить по проводнику 1-го рода, получим электрохимическую реакцию.
7
Схема
гальванического элемента Даниэля-Якоби: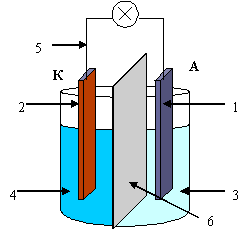
Zn –пластина (1) в растворе ZnSO4(3);
Cu-пластина (2) в растворе CuSO4 (4);
металлический проводник (5)
разделительная диафрагма (6) или электролитический мостик;
гальванометр (7)
Гальванометр фиксирует ток в цепи – движение электронов от Zn к Cu, вольтметр – напряжение (разность потенциалов) между электродами.
Имеем простейший источник тока – гальванический элемент.
е
Схема
ГЭ:
Ионы SO42-![]() ZnZnSO4
CuSO4
Cu
ZnZnSO4
CuSO4
Cu
![]()




(-) АНОД: Zno = Zn2+ + 2e – окисление
(+) КАТОД: Cu+2 + 2e = Cuo - восстановление
суммарно: Zno + Cu2+ (р) = Zn2+ (р) + Cuo – ТОР – токообразующая реакция
Электрохимические реакции – это ОВР, в которых окислительная и восстановительная полуреакции разделены пространственно, а переход электронов происходит по проводникам 1-го рода. (Для проведения ЭХР - электрохимическая система или электрохимическая цепь).
Электрохимическая система:
Внешняя цепь: металлические проводники, измерительные приборы, потребители
Внутренняя цепь: два электрода и ионный проводник между ними.
Ионный проводник (пр. 2-го рода) - раствор электролита, расплав или твердый электролит.
Электроды - металлические или полупроводниковые материалы (пр.1рода) в контакте с пр.2рода.
Электроды:
Анод - Окисление – Отдача электронов А - О – О
Катод - Восстановление – Прием электрон К – В - П
Две группы электрохимических систем:
