
- •250100.62 «Лесное дело», 250700.62 «Ландшафтная архитектура», 022000.62 «Экология и природопользование» и 051000.62 «Профессиональное обучение»
- •Предисловие
- •Лабораторное оборудование и общие правила работы в химической лаборатории
- •1 Химическая посуда
- •Пробирки: а) цилиндрическая, б) коническая; 2) воронка; 3) стакан; 4) колбы: а) коническая, б) плоскодонная.
- •1) Капельницы: а) с колпачком; б) с клювиком; 2) бюксы.
- •1) Цилиндры; 2) мензурка; 3) пробирки; 4) мерные колбы; 5) пипетки;
- •6) Бюретки.
- •2 Правила работы в химической лаборатории
- •3 Требования техники безопасности
- •4 Оказание первой помощи
- •5 Требования к оформлению отчета по лабораторной работе
- •Лабораторная работа № 1 Определение эквивалентной массы металла Теоретическое введение
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №2 Окислительно-восстановительные реакции Теоретическое введение
- •Выполнение работы
- •Контрольные вопросы
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №4 Реакции ионного обмена в растворах электролитов Теоретическое введение
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №5 Гидролиз солей Теоретическое введение
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа № 6 Приготовление растворов заданной концентрации Теоретическое введение
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа № 7 коллоидные растворы. Адсорбция Теоретическое введение
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа № 8 качественный анализ химических веществ Теоретическое введение
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа № 9 ряд напряжений металлов. Коррозия металлов Теоретическое введение
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторные работы
- •Определение эквивалентной массы металла по объему выделившегося водорода
- •Окислительно-восстановительные реакции
- •Скорость химических реакций и химическое равновесие
- •Реакции ионного обмена в растворах электролитов
- •Гидролиз солей
- •Приготовление растворов заданной концентрации
- •Коллоидные растворы
- •Качественный анализ химических веществ
- •Ряд напряжений металлов. Коррозия металлов
- •Литература
- •250100.62 «Лесное дело», 250700.62 «Ландшафтная архитектура», 022000.62 «Экология и природопользование» и 051000.62 «Профессиональное обучение»
- •346428, Г. Новочеркасск, ул. Пушкинская, 111.
Контрольные вопросы
Какие реакции называются окислительно-восстановительными? Что такое окислитель и восстановитель? Какие важнейшие процессы, протекающие в природе и осуществляемые в технике, относятся к окислительно-восстановительным?
Что такое степень окисленности элемента?
Определите степень окисленности атомов элементов в соединениях и ионах: CrO
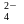 ,
HNO3,
KClO3,
SO
,
PO
,
HNO3,
KClO3,
SO
,
PO ,
K3PO3,
NaPO3,
SiH4,
NH
,
K3PO3,
NaPO3,
SiH4,
NH ,
NH4ClO4,
N2,
CaH2.
,
NH4ClO4,
N2,
CaH2.Укажите, какие из приведенных ниже веществ являются окислителями, какие - восстановителями: FeCl2, Cl2, Zn, NН3, PbO2, KClO4, F2, НСl, Nа2SO3, KI, K2Cr2O7, KMnO4, HNO3?
Уравняйте реакции:
KМnO4 + KI + H2SO4 → K2SO4 + MnSO4 + I2 + H2O
FeCl3 + SnCl2 → FeCl2 + SnCl4
KMnO4 + NН3 → KNОз + MnO2 + KОН + H2O
K2Сr2O7 + HClO4 + HI → Сr(СlO4)3 + KClO4 + I2 + H2O
I2 + Cl2 + H2O → НIO3 + HCl
Cl2 + KОН → KCl + KClO3 + H2O
Укажите окислитель и восстановитель. Определите тип окислительно-восстановительной реакции.
Лабораторная работа № 3
Скорость химических реакций и химическое
равновесие
Теоретическое введение
Скорость химических реакций – это изменение концентрации реагирующих веществ (продуктов реакции) в единицу времени. Концентрацию (С) реагирующих веществ обычно выражают количеством молей в 1 л, время (τ) – в секундах, минутах и т.д.:
υ
= ±![]() , (3.1)
, (3.1)
где ΔС – изменение концентраци любого из реагирующих веществ;
Δτ – время, за которое протекает реакция.
При определении скоростей учитывается, что реакции могут быть гомогенными – протекающими в системах, состоящих из одной фазы, или гетерогенными – протекающими в системах, состоящих более чем из одной фазы.
Скорость гомогенной реакции зависит от:
природы реагирующих веществ;
условий, при которых протекает реакция – концентраций реагирующих веществ, температуры, давления (для газов);
присутствия катализатора.
Скорость гетерогенной реакции кроме вышеперечисленных факторов зависит от поверхности раздела фаз.
Зависимость скорости реакции от концентрации выражается законом действия масс:
п ри постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Для уравнения реакции
mΑ+nB=ΑmBn (3.2)
математически этот закон можно выразить в следующем виде:
υ=k[Α]m·[B]n, (3.3)
где υ – скорость реакции;
[Α] и [B] – молярные равновесные концентрации реагирующих веществ;
m и n – коэффициенты в уравнении реакции;
k – константа скорости реакции, численно равная скорости реакции при концентрациях реагирующих веществ, равных единице.
Закон действия масс применим только к газообразным и растворенным веществам, так как твердые вещества реагируют только с поверхности.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
п ри повышении температуры на каждые 10 градусов скорость большинства реакций возрастает в 2-4 раза.
Число, показывающее во сколько раз возрастает скорость реакции при повышении температуры на 10 градусов, называется температурным коэффициентом данной реакции и обозначается буквой γ:
![]() (3.4)
(3.4)
где
![]() и
и
![]() - скорости реакции при начальной (t1)
и конечной (t2)
температуре;
- скорости реакции при начальной (t1)
и конечной (t2)
температуре;
t1 и t2 – начальная и конечная температуры, соответственно.
Существенное влияние на скорость реакций оказывают катализаторы – вещества, которые способны изменять скорость реакций, причем химический состав и количество самих катализаторов остается неизменным.
Если катализатор и реагирующие вещества находятся в одной фазе, то катализ называют гомогенным, если в разных фазах – гетерогенным.
Химические реакции, в результате которых исходные вещества полностью превращаются в продукты реакции, называются необратимыми.
Реакции, идущие одновременно в двух противоположных направлениях (прямом и обратном), называют обратимыми.
Состояние, когда скорости прямой и обратной реакций становятся одинаковыми и когда концентрации всех участников реакции перестают изменяться, называется химическим равновесием.
В общем случае, если имеет место обратимая реакция, протекающая по схеме:
mA + nB ↔pC + qD (3.5)
то в состоянии химического равновесия отношение произведений равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, возведенных в степени их стехиометрических коэффициентов, есть величина постоянная для данной реакции при данной температуре, называемая константой химического равновесия К:
![]() (3.6)
(3.6)
Каждое химическое равновесие устанавливается при определенном значении трех параметров, которые его характеризуют:
концентрация реагирующих веществ, С;
температура, Т;
давление (для газов), р.
Изменение одного из этих параметров определяет характер внешнего воздействия на систему и приводит к нарушению равновесия.Направление смещения равновесия определяется принципом Ле Шателье:
е сли
на систему, находящуюся в состоянии
химического равновесия, оказать
какое-либо внешнее воздействие, то
равновесие сместиться в таком направлении,
которое вызовет ослабление оказанного
воздействия.
сли
на систему, находящуюся в состоянии
химического равновесия, оказать
какое-либо внешнее воздействие, то
равновесие сместиться в таком направлении,
которое вызовет ослабление оказанного
воздействия.
Повышение температуры приводит к смещению равновесия в сторону эндотермической реакции (Q<0, ΔΗ>0)..
Понижение температуры приводит к смещению равновесия в сторону экзотермической реакции (Q>0, ΔΗ<0).
Повышение давления вызывает смещение равновесия в том направлении, которое приводит к уменьшению объема системы (общего числа молей газообразных веществ).
Понижение давления вызывает смещение равновесия в сторону увеличения объема системы (общего числа молей газообразных веществ).
Увеличение концентраций одного из исходных веществ, либо уменьшение концентрации одного из продуктов реакции приводит к смещению равновесия в сторону прямой реакции.
Уменьшение концентрации одного из исходных веществ, либо увеличение концентрации одного из продукта реакции, приводит к смещению равновесия в сторону обратной реакции.
