
- •250100.62 «Лесное дело», 250700.62 «Ландшафтная архитектура», 022000.62 «Экология и природопользование» и 051000.62 «Профессиональное обучение»
- •Предисловие
- •Лабораторное оборудование и общие правила работы в химической лаборатории
- •1 Химическая посуда
- •Пробирки: а) цилиндрическая, б) коническая; 2) воронка; 3) стакан; 4) колбы: а) коническая, б) плоскодонная.
- •1) Капельницы: а) с колпачком; б) с клювиком; 2) бюксы.
- •1) Цилиндры; 2) мензурка; 3) пробирки; 4) мерные колбы; 5) пипетки;
- •6) Бюретки.
- •2 Правила работы в химической лаборатории
- •3 Требования техники безопасности
- •4 Оказание первой помощи
- •5 Требования к оформлению отчета по лабораторной работе
- •Лабораторная работа № 1 Определение эквивалентной массы металла Теоретическое введение
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №2 Окислительно-восстановительные реакции Теоретическое введение
- •Выполнение работы
- •Контрольные вопросы
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №4 Реакции ионного обмена в растворах электролитов Теоретическое введение
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №5 Гидролиз солей Теоретическое введение
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа № 6 Приготовление растворов заданной концентрации Теоретическое введение
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа № 7 коллоидные растворы. Адсорбция Теоретическое введение
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа № 8 качественный анализ химических веществ Теоретическое введение
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа № 9 ряд напряжений металлов. Коррозия металлов Теоретическое введение
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторные работы
- •Определение эквивалентной массы металла по объему выделившегося водорода
- •Окислительно-восстановительные реакции
- •Скорость химических реакций и химическое равновесие
- •Реакции ионного обмена в растворах электролитов
- •Гидролиз солей
- •Приготовление растворов заданной концентрации
- •Коллоидные растворы
- •Качественный анализ химических веществ
- •Ряд напряжений металлов. Коррозия металлов
- •Литература
- •250100.62 «Лесное дело», 250700.62 «Ландшафтная архитектура», 022000.62 «Экология и природопользование» и 051000.62 «Профессиональное обучение»
- •346428, Г. Новочеркасск, ул. Пушкинская, 111.
Скорость химических реакций и химическое равновесие
Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ
Ход работы: взаимодействие тиосульфата натрия с серной кислотой описывается уравнением:
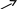 SO2↑
SO2↑
N
 a2S2O3
+ H2SO4
= Na2SO4
+ H2S2O3
H2O
a2S2O3
+ H2SO4
= Na2SO4
+ H2S2O3
H2O
S↓
Началом реакции является момент сливания растворов; конец реакции определили по появлению в смеси ____________________________________
__________________________________________________________________
В первый химический стакан емкостью 100 мл налили 30 мл 0,05М раствора тиосульфата натрия Na2S2O3 и прилили 10 мл 0,05М раствора серной кислоты.
Время протекания реакции засекали секундомером.
Во второй химический стакан емкостью 100 мл налили 20 мл 0,05М раствора тиосульфата натрия Na2S2O3, добавили 10 мл дистиллированной воды и прилили 10 мл 0,05М раствора серной кислоты. По секундомеру определили время протекания реакции.
В третий стакан налили 10 мл 0,05М раствора тиосульфата натрия Na2S2O3, добавили 20 мл дистиллированной воды и прилили 10 мл 0,05М раствора серной кислоты. Время протекания реакции установили при помощи секундомера.
Результаты наблюдений:
№ стакана |
Объем растворов, мл |
Время протекания реакции, τ |
Скорость реакции υ=1/τ |
||
Na2S2O3 |
H2O |
H2SO4 |
|||
1 |
30 |
- |
10 |
|
|
2 |
20 |
10 |
10 |
|
|
3 |
10 |
20 |
10 |
|
|
График зависимости изменения скорости реакции от концентрации Na2S2O3 имеет следующий вид:
ВЫВОД:___________________________________________________________
____________________________________________________________________________________________________________________________________
Опыт 2. Влияние катализатора на скорость химической реакции
Ход работы: в пробирку налили 1-2 мл 3 %-ного раствора пероксида водорода.__________________________________________________________
__________________________________________________________________
Внесли в пробирку небольшое количество кристаллического диоксида марганца MnO2. Наблюдали __________________________________________
В пробирку внесли тлеющую лучину. Наблюдали _________________________, что свидетельствует о _____________________
__________________________________________________________________
Уравнение реакции разложения пероксида водорода:
H2O2 H2O + O2
ВЫВОД:___________________________________________________________
__________________________________________________________________
__________________________________________________________________
Опыт 3. Сдвиг химического равновесия при изменении концентрации веществ
Ход работы: в пробирку налили 3-4 мл разбавленного раствора хлорида железа FeCl3 и прилили 1-2 капли разбавленного раствора роданида аммония NH4CNS. Наблюдали_______________________________________________
В пробирке установилось химическое равновесие обратимой реакции:
FeCl3
+ 3NH4CNS
![]() Fe(CNS)3
+ 3NH4Cl
Fe(CNS)3
+ 3NH4Cl
К полученному раствору добавили дистиллированную воду, перемешали и разлили в четыре пробирки. В первую пробирку с равновесным раствором добавили 1-2 капли насыщенного раствора хлорида железа FeCl3. Наблюдали __________________________________________________________________
Во вторую пробирку прилили 1-2 капли насыщенного раствора роданида аммония NH4CNS. Наблюдали ________________________________________
__________________________________________________________________
В третью пробирку добавили немного кристаллического хлорида аммония NH4Cl. Наблюдали__________________________________________________
Результаты наблюдений:
№№ опыта |
Добавленное вещество |
Изменение интенсивности окраски |
Направление сдвига равновесия |
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
ВЫВОД:___________________________________________________________
__________________________________________________________________
__________________________________________________________________
Лабораторная работа №4 Дата__________
