
- •© Львівський національний аграрний університет, 2014
- •Дефектування шліців
- •5. Послідовність виконання роботи
- •Режими шліфування шийок
- •5. Послідовність виконання роботи
- •Вихідні дані до розрахунку зусилля р запресування втулки у верхню головку шатуна двигуна смд-14
- •Налагодити верстат відповідно до розрахованих режимів.
- •Лабораторна робота № 10
- •Послідовність виконання роботи
- •Анодні процеси. В гальванічній ванні з розчинним анодом реакції окислення полягають у віддачі іонів металу в розчин і електронів у зовнішнє коло за рівнянням
- •Технологія залізнення.
- •Лабораторна робота № 15
Анодні процеси. В гальванічній ванні з розчинним анодом реакції окислення полягають у віддачі іонів металу в розчин і електронів у зовнішнє коло за рівнянням
Мe → Мen+ + ne
При низькій густині струму ця реакція (розчинення металу ) являється єдиною. При підвищенні густини струму починається виділення кисню, в результаті чого початково-розчинний анод переходить в нерозчинний.
Нерозчинні аноди / застосовувані, наприклад при хромуванні / не передають в електроліт іонів металу. Реакції, необхідні для проходження струму від металевого провідника до електроліту, відбуваються при окисленні складових частин електроліту на границі фаз анод-розчин. В залежності від складу електроліту ці реакції можуть бути дуже різноманітними. Зокрема, реакція окислення може супроводжуватися віддаленням кисню і в лужному електроліті відбуваються за рівнянням
4ОН- → 2Н2О + О2 + 4е,
а в кислотному електроліті за рівнянням
4Н2О → 4Н+ + 2О2 + 4е.
Катодні процеси. Реакція відновлення на катоді відбувається за рівнянням
Мen+
+ ne → 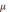 е
е
тобто іон металу розряджається за рахунок електронів джерела струму і перетворюється в нейтральний атом, який входить в кристалічну кратку нарощуваного гальванічного покриття. Ця реакція часто супроводжується виділенням водню / для металів, які за потенціалом стоять вище водню / , що погіршує якість покриття
2Н+ + 2е → Н2
На катоді можуть протікати також інші реакції відновлення.
Теоретична маса нарощуваного металу. Залежність кількості речовини, що відновлюються на катоді і окислюється на аноді від природи речовин й обумов електролізу була досліджена М. Фарадеєм, який встановив, що для виділення або розчинення під час електролізу 1 г-екв. Речовини витрачаються близько 96490 К електрики / константа Фарадея /. Звідси рівняння маси нарощеного металу
mm
= 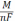
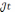 =c
=c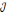 t
t
де mm – теоретична кількість речовини, що виділилася на катоді ;
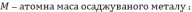
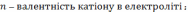
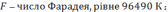
 –
сила
струму, А ;
–
сила
струму, А ;
t – тривалість нарощення, г;
c – електрохімічний еквівалент осаджуваної речовини, г/А*г.
Терміни : електроліт, електроліз, анод, катод, аніони, катіони також запропоновані Фарадеєм.
Вихідні металу по струмові. Оскільки при електролізі не вся кількість використаної електрики йде на електролітичне осадження металу, бо частина її витрачається на виділення водню, відновлення іонів вищої валентності та інші побічні процеси, то маса фактично нарощеного металу буде менша від теоретично розрахованої. Відношення фактично нарощеної маси покриття до розрахункової називається виходом по струмові є однією з основних характеристик процесу електролітичного нарощення :
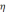 =
= 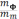 * 100 %,
* 100 %,
Особливості відновлення деталей хромуванням. Електролітичне хромування, незважаючи на простий склад електроліту / хромовий ангідрид і сірчана кислота /, є складним і не повністю вивченим процесом. Для відхилення металевого хрому в електролітичну ванну обов’язково вводять іони
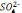 або
інші по сторонні аніони ( F-
, S1
,
або
інші по сторонні аніони ( F-
, S1
, 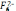 )
в заздалегідь визначеному співвідношенні
до хромового ангідриду.
)
в заздалегідь визначеному співвідношенні
до хромового ангідриду.
Разом
з тим при надмірному підвищенні
концентрації іонів 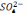 вихід
металевого хрому по струмові швидко
зменшується. Вихід металевого хрому по
струмові зменшується із зростанням
температури електроліта і концентрації
в ньому хромового ангідрида .
вихід
металевого хрому по струмові швидко
зменшується. Вихід металевого хрому по
струмові зменшується із зростанням
температури електроліта і концентрації
в ньому хромового ангідрида .
В процесі електролізу на катоді відбувається відновлення шестивалентного хрому до металевого з виходом по струмові 9… 40 % і трьохвалентного з виходом по струмові 10…12 %, а також розряд іонів водню з виходом по струмові до 70 % і його виділення. На аноді відбувається розряд іонів кисню з виходом по струмові до 90 % та окислення трьохвалентних іонів до шестивалентного стану.
Реакція відбувається за наступними рівняннями:
на катоді
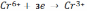 ;
;

2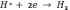
на аноді
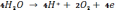
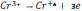
Електроліз ведуть з розчинними анодами, як правило свинцевими або ж сплаву свинцю із сурмою ( 5% ) і оловом ( 10% ). Розчинні хромові аноди не застосовують, щоб запобігти різкій зміні складу електроліту, тому що хром розчиняється на аноді в формі трьохвалентних іонів.
Кількість трьохвалентних іонів хрому в електроліті, що залежать від співвідношення площ анода і катода, повинна підтримуватись в межах 5…7 г/л. Для цього робоча площа анодів повинна бути в 1,5…2 рази більша площі катода, і яка підлягає нарощуванню.
Сумарна робоча катодна поверхня для однієї ванни розраховується із умови 30…50 л на 1 дм2 поверхні.
Концентрація хромової кислоти може змінюватися в широких межах ( 150…400 г/л ). При цьому твердість хромових покрить і вихід металевого хрому по струмі як правило, зменшується із зростанням концентрації С2О3 в розчині при підвищених температурах і високій густині струму. Найбільшого поширення в техніці набув так званий універсальний електроліт, який включає 250 г/л С2О3 і 2,5 г/л Н2СО4, температура електроліту 45…550С, к = 20…60 А/дм2 . Він використовується для отримання як захисно-декоративних, так і зносостійких покритій.
Швидкість нарощування хрому залежить від густини струму і міняється в межах 20…40 мкм за годину. Така мала швидкість обумовлена також і низьким виходом металу по струмові (η = 13… 15% ). До інших недоліків цього процесу відносяться: високий ступінь наводнювання нарощуваного і основного металу, що призводить до підвищеної хрупкості хромованих виробів і зниженню втомлюваної міцності; необхідність часто здійснювати аналіз і коректування електроліту в процесі його експлуатації для підтримання співвідношення між CrO3 і H2SO4 в оптимальних межах ( 100:1 ); обмеженість максимальної товщини нарощеного шару ( до 0,3 мм ).
Базуючись на сучасних дослідженнях теорії хромування, кафедрі ремонту машин Кишинівського СГІ розроблено новий спосіб швидкісного хромування, який дозволяє вести процес з високим виходом металу по струмові ( 35…40 % ), застосувати високу катодну густину струму ( 50 А/дм2 і вище ) і отримувати хромові покриття із швидкістю 0,15…0,35 мм/год.
При цьому застосовується електроліт наступного складу: хромовий ангідрид – 400 г/л; вуглекислий кальцій – 65 г/л; сірчанокислий кобальт – 20 г/л.
Температура електроліту – 18…230С.
