
- •Учебно-методическое пособие по дисциплине «Строение молекул и основы квантовой химии»
- •Учебно-методическое пособие для занятий по дисциплине «Строение молекул и основы квантовой химии» Изд. 1-е.- Тула: Изд-во Тул. Гос. Пед. Ун-та им. Л.Н. Толстого, 2013. – с.
- •План семинарских занятий.
- •Атомная (молекулярная) масса Аr (Mr) - масса атома или молекулы, выраженная в атомных единицах массы.
- •Принцип наименьшей энергии. В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром).
- •Правило Гунда. Электроны в пределах подуровня занимают максимальное число орбиталей так, чтобы суммарный спин был максимальным.
- •Глинка н.Л. Общая химия, 30-е изд., испр. - м.: 2003.
- •Зайцев о.С. Общая химия. Состояние веществ и химические реакции. Учеб. Пособие для вузов. - м.: Химия, 1990.
Принцип наименьшей энергии. В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром).
Принцип Паули. В атоме не может быть двух электронов, характеризующихся одинаковыми наборами четырех квантовых чисел.
Правило Гунда. Электроны в пределах подуровня занимают максимальное число орбиталей так, чтобы суммарный спин был максимальным.
Правила Клечковского. Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n + l). При одинаковой сумме раньше заполняется орбиталь с меньшим значением n.
Максимальное количество электронов на энергетическом уровне зависит от значения главного квантового числа и равно 2n2.
Электронное строение атомов определяет положение элементов в Периодической таблице.
Порядковый номер элемента в Периодической системе равен числу электронов в атоме этого элемента.
Номер периода, в котором расположен элемент, соответствует значению главного квантового числа внешнего заполняемого энергетического уровня в атоме этого элемента.
Номер группы, в которой расположен элемент, соответствует числу валентных электронов в атоме этого элемента. К валентным относятся: s - и p - электроны внешнего слоя для s - и p - элементов, а также d – электроны предыдущего уровня и s –электроны внешнего уровня для d – элементов.
В главных подгруппах Периодической системы располагаются s - и p – элементы. В побочных - d – элементы.
Задачи:
1. Сколько электронов может находиться на электронных уровнях K, L, М, N, О, Р, Q?
2. Сколько электронов может находиться на 2р- и 3р- подуровнях?
3. Сколько электронов может находиться на 3d, 4d и 5d- подуровнях?
4. Исходя из положения в Периодической системе, изобразите электронное строение атомов следующих элементов: а) лития; б) бериллия; в) бора; г) углерода; д) азота; е) кислорода; ж) хрома; з) марганца.
5. Напишите электронные формулы атомов элементов с порядковыми номерами 37, 43, 48, 52 и 54. В каких группах Периодической системы располагаются эти элементы и к какому семейству они относятся?
6. Назовите элементы, имеющие по одному электрону на подуровне: а) 3d; б) 4d; в) 5d. Напишите электронные формулы атомов этих элементов и укажите их положение в периодической системе — период, группа и подгруппа.
7. Назовите элементы 4, 5 и 6-го периодов, у которых заканчивается заполнение d-орбиталей. Напишите электронные формулы атомов этих элементов и укажите, к какому периоду, группе и подгруппе периодической системы они относятся.
8. Сколько свободных d-орбиталей имеется в атомах титана и ванадия? Напишите для них электронно-графическую формулу.
9. Назовите элементы 4-го периода, атомы которых содержат наибольшее число неспаренных d-электронов. Напишите их электронно-графическую структуру.
10. Сколько свободных f-орбиталей содержится в атомах лантаноидов от церия до самария включительно?
11. Назовите лантаноиды, атомы которых имеют наибольшее число неспаренных f -электронов.
12. Какие энергетические уровни не имеют: а) p, б) d, в) f-подуровней? Возможно ли отсутствие s-подуровня? Атомы каких элементов не имеют электронов на р- и d-подуровнях?
13. На каком энергетическом уровне и подуровне находится внешний электрон в атомах лития и калия? При каких условиях они могут переходить на более высокие энергетические уровни? Будут ли для них такие возбужденные состояния устойчивыми?
14. Какой элемент имеет в атоме три электрона, для каждого из которых п=3 и l = 1? Чему равно для них значение магнитного квантового числа? Должны ли они иметь антипараллельные спины?
15. Укажите значения квантовых чисел п и l для внешних электронов в атомах элементов с порядковыми номерами 11, 14, 20, 23, 33.
16. Какое значение имеет: а) орбитальное квантовое число для энергетических подуровней, емкость которых равна 10 и 14; б) главное квантовое число для энергетических уровней, емкость которых равна 32, 50 или 72?
17. Укажите порядковый номер элемента, у которого: а) заканчивается заполнение электронами орбиталей 4d; б) начинается заполнение подуровня 4р.
18. Запишите электронные формулы атомов элементов с зарядом ядра: а) 8; б) 3; в) 8; г) 23; д) 53; е) 63; ж) 83. Составьте графические схемы заполнения электронами валентных орбиталей этих атомов.
19. Среди приведенных ниже электронных конфигураций укажите невозможные и объясните причину невозможности их реализации: а) 1р3; б) 3р6; в) 3s2; г) 2s2; д) 2d5; е) 5d2; ж) 3f12; з) 2р4; и) 3р7.
20. Сколько вакантных 3d-орбиталей имеют возбужденные атомы: а) Сl; б) V; в) Мn?
21. Составьте электронно-графические схемы ионов Fе2+ и Fе3+. Чем можно объяснить особую устойчивость электронной конфигурации иона Fе3+?
22. Электронная емкость седьмого энергетического уровня (уровень Q; п = 7) не насыщена, слой содержит 21 электрон. Укажите, какие энергетические подуровни достроены, какой подуровень достраивается. Представьте электронные конфигурации подуровням и укажите, к какому электронному семейству принадлежит элемент.
23. Как выглядела бы гипотетическая структура шестого электронного слоя в атоме (п = 6), если предположить, что все 6 энергетических подуровней этого уровня полностью застраиваются электронами? Сколько всего получается электронов?
Задачи для самостоятельного решения:
1. Чему равна емкость энергетических уровней, для которых п = 1, 2, 3, 4 и 5, а также подуровней, для которых число значений тl равно 5 и 7?
2. Учитывая емкость энергетических уровней, покажите, сколько электронных слоев содержит электронная оболочка атома из 18, 36, 54, 86 электронов.
3. Сколько неспаренных электронов содержат невозбужденные атомы: а) В; б) S; в) As; г) Сr; д) Нg; с) Еu?
4. Укажите особенности электронных конфигураций атомов меди и хрома. Сколько 4s-электронов содержат невозбужденные атомы этих элементов?
5. Структура валентного электронного слоя атома элемента выражается формулой: а) 5s25р4; б) 4s13d5. Определите порядковый номер и название элемента.
6. Электронная структура атома описывается формулой 1s22s22р63s23р64s23d6. Какой это элемент?
7. Напишите электронные формулы ионов: а) Sn2+; б) Sn4+; в) Мn2+; г) Сu2+; д) Сr3+; е) S2-.
8. У элементов каких периодов электроны внешнего слоя характеризуются значением n + l = 5?
9. Среди приведенных ниже конфигураций укажите возможные и невозможные: а) 6f3; б) 1p3; в) 3p1;г) 4p4; д) 4d4; е) 3f6. Ответ обоснуйте.
10.По записям конфигураций укажите, какие подуровни достроены, а какие не заполнены электронами до полной их емкости: а) 5s1; б) 1s2; в) 2р6; г) 6р2; д) 4р4; е) 5d10; ж) 6d2; з) 5f14; и) 5f7; к) 3d3.
11. Чему равна электронная емкость: а) энергетического уровня М; б) энергетического подуровня р; в) энергетического подуровня с побочным квантовым числом l = 3?
12.Структура внешних электронных слоев атома: а) 4s24р3; б) 5d86s2; в) 3d34s2. К каким периодам и группам относятся элементы, атомы которых содержат указанные группировки?
13. Электронные формулы внешних подуровней некоторых элементов:
а) 3s1;
б) 3s23p6;
в) 4s23d7;
г) 7s25f13.
Для каждого элемента:
а) подсчитайте общее число электронов в атоме, укажите порядковый номер элемента и назвите его;
б) выявите достраиваемый энергетический подуровень и укажите электронное семейство, к которому относится элемент;
в) укажите общее число валентных электронов и обратите внимание на характер расположения их на энергетических уровнях (на одном или на двух внешних уровнях); отметьте, к какой группе и подгруппе по таблице Д. И. Менделеева относится каждый элемент;
г) ориентируясь на число электронов во внешнем слое, укажите, каким характером (металлическим или неметаллическим) обладают элементы;
д) по числу застраиваемых энергетических уровней определите, к какому периоду относится элемент.
Занятие №4.
Строение ядра. Ядерные превращения.
Ядро атома. Структурными единицами, образующими атомное ядро являются положительно заряженные протоны (р) и нейтральные нейтроны (n), представляющие собой два различных состояния одной и той же частицы — нуклона.
Возможный переход нуклона из одного состояния в другое сопровождается «рождением» электрона е- или позитрона е+ вместе с частицей, не имеющей заряда и массы покоя — нейтрино ν:
р → n + е+ + ν; n → р + е- + ν .
Количество протонов в ядре называется его зарядовым числом Z — это число равно порядковому номеру элемента, к которому относится атом в Периодической таблице Д.И. Менделеева. Количество протонов в ядре определяет структуру электронной оболочки нейтрального атома и, таким образом, химические свойства соответствующего элемента. Количество нейтронов в ядре называется его изотопическим числом N. Ядра с одинаковым числом протонов и разным числом нейтронов называются изотопами. Ядра с одинаковым числом нейтронов, но разным числом протонов — называются изотонами. Термины изотоп и изотон используются также применительно к атомам, содержащим указанные ядра, а также для характеристики нехимических разновидностей одного химического элемента. Полное количество нуклонов в ядре называется его массовым числом А и приблизительно равно средней массе атома, указанной в Периодической таблице. Нуклиды с одинаковым массовым числом, но разным протон-нейтронным составом принято называть изобарами.
Атомная масса химического элемента (также «средняя атомная масса», «стандартная атомная масса») является средневзвешенной атомной массой всех стабильных изотопов данного химического элемента с учётом их природной распространённости в земной коре и атмосфере.
В ядре между нуклонами действуют силы сцепления, называемые ядерными силами. Для них характерно: 1) действие между всеми частицами ядра; 2) необычайная мощность, благодаря которой плотность ядерного вещества достигает огромного значения порядка 1014 г/см2; 3) способность действовать только на очень малых расстояниях, не превышающих размера самого ядра (10-13 см).
Дефектом массы (Δm) называют разность между массой ядра и арифметической суммой масс протонов и нейтронов, входящих в его состав. Дефект массы связан с энергией, выделяющейся при образовании ядра, соотношением Эйнштейна E= Δm∙c 2. Чем больше Δm, тем больше энергия связи между частицами в ядре и тем выше его устойчивость. Благодаря большим значениям Δm для ядерных реакций применим не закон сохранения массы, а общий закон сохранения материи: Σm +ΣЕ = const.
Ядерная реакция — процесс превращения атомных ядер, происходящий при их взаимодействии с элементарными частицами, гамма-квантами и друг с другом. Ядерная реакция изображается уравнением реакции, в котором последовательно указывается: ядро-мишень, бомбардирующая частица («снаряд»), вылетающая частица и образовавшееся ядро. Большая часть ядерных реакций протекает в две стадии: 1) захват «снаряда» ядром-мишенью, 2) распад неустойчивого продукта захвата с образованием конечного ядра — продукта реакции.
В результате ядерной реакции ядро атома претерпевает более или менее глубокие превращения, в результате которых образуются ядра атомов других элементов (одно или несколько) или же изменяется энергетическое состояние исходного ядра.
При составлении уравнений ядерных реакций необходимо учитывать следующие их особенности.
1. Приводимые в этих уравнениях химические символы обозначают не атомы элементов, а лишь их ядра (зная заряд и массу ядра, легко можно представить себе и атом в целом).
2. Индексы у структурного символа той или иной частицы обозначают: верхний индекс — массовое число, т. е. массу данной частицы, округленную до ближайшего целого числа; нижний индекс — положительный заряд частицы (зарядовое число). У ядер атомов он численно равен порядковому номеру элемента в таблице Менделеева.
Уравнения ядерных реакций должны удовлетворять следующим требованиям (правило равенства сумм индексов):
а) сумма массовых чисел частиц левой и правой частей уравнения (по верхним индексам) должны быть равны между собой. При этом массы электронов, позитронов и фотонов не учитываются;
б) суммы зарядов частиц (по нижним индексам) в обеих частях уравнения также должны быть одинаковыми. Заряд электрона учитывается со знаком минус, протона и позитрона — со знаком плюс. Нейтрон и γ-фотон заряда не имеют.
Часто пользуются сокращенными записями ядерных реакций. При этом действующая частица («бомбардирующая» частица облучения) и выбрасываемая (вторичная) частица указываются в скобках.
Радиоактивность - это самопроизвольное превращение неустойчивого изотопа одного химического элемента в изотоп другого, которое сопровождается испусканием элементарных частиц или ядер. Существует несколько видов радиоактивного распада: α – распад, электронный или β- – распад, β+ – распад, электронный захват и спонтанной деление.
За единицу радиоактивного распада в СИ принят беккерель (Бк) — радиоактивность, при которой за 1 с происходит 1 акт распада (с-1). Внесистемная единица кюри (Ки) равна 3,7∙1010 Бк (число α-частиц, которые испускает радий массой 1 г в 1 с).
Задачи:
1.Символ одного из изотопов элемента 5224Э. Укажите: а) название элемента; б) число протонов и нейтронов в ядре; в) число электронов в электронной оболочке атома.
2. Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома — 15 электронов. Назовите элемент, изотопом которого является данный атом. Приведите запись его символа с указанием заряда ядра и массового числа.
3. При бомбардировке ядер бора 105B нейтронами был получен изотоп лития 73Li. Определите промежуточное ядро и выброшенную частицу.
4. В результате бомбардировки изотопа неона 2110Ne некоторыми частицами образуются изотоп фтора и α-частица. Определите бомбардирующую частицу.
5. Из ядра магния 2412Mg получено ядро изотопа натрия 2211Nа и α-частица, а из ядер 94Ве получены 105В + n и 126С + n. При помощи каких «снарядов» были осуществлены эти реакции?
6. γ-Кванты возбуждают ядра цинка 6630Zn и магния 2612Мg, благодаря чему первое ядро выбрасывает протон и нейтрон, а второе — только протон. Определите, ядра каких элементов при этом образуются.
7. Изотоп какого элемента образуется, если ядро лития 63Li, поглощая нейтрон, выбрасывает α-частицу?
8. При бомбардировке протонами ядер: а) изотопа 2110Ne вылетают α-частицы; б) меди 6329Сu - нейтроны. Какие изотопы и каких элементов при этом образовались?
9. Технеций Тс — первый элемент, полученный синтетическим путем при облучении 9642Мо дейтронами. Какое возбужденное ядро при этом образуется и в ядро какого элемента оно превращается после выброса нейтрона?
10. Сколько α-частиц теряет ядро радона, если в результате образуется изотоп свинца 21482Рb?
11. Сколько α- и β- -частиц теряют ядра 23290Th, 23892U и 23592U, превращаясь в конечном итоге в изотопы свинца?
12. Какой элемент периодической системы образуется, если в цепи радиоактивных превращений ядро атома радия 22688Ra в конечном счете потеряло 5α- и 4β- -частиц?
13. Чему равна Есв между протоном и нейтроном в ядре дейтерия в кДж/моль? Сравните ее с Есв между атомами водорода в молекуле Н2, равной 436 кДж/моль. Δm(D) = 0,00185 а. е. м.
14. Полные уравнения ядерных реакций запишите в сокращенном виде:
а) 3717С1 + 21D → 3516S + 42Не д) 189F → 188О + β+
б) 20983Вi + 42Не → 21185Аt + 2n е) 3416S + n → 3516S + γ
в) 19779Аu + 21D → 19477Ir + 42Не + p ж) 6228Ni + γ → 6127Со + p
г) 9942Mо → 9943Тс + β-
15. Сокращенные уравнения ядерных реакций запишите в полном виде (с указанием верхних и нижних индексов):
а) 27А1 (р, α)24Мg д) 56Мn (—, β-) 56Fе
б) 70Zn (р, n)70Gа е) 13N (—, β +) 13С
в) 54Fе (γ; р, n) 52Мn ж) 239Рu (—, α)235U
г) 31Р (n, γ) 32Р
16. Для приведенных ядерных реакций укажите структурный символ составного ядра (обозначен знаком вопроса в скобках):
а) 199F + α →(?) → 2211Ne + p
б) 94Ве + α → (?)→ 126С + n
в) 19779Аu + 21D → (?) → 19477Ir + α + p
17. Представьте структурный символ промежуточного ядра в реакции, записанной в общем виде (промежуточное ядро обозначить через Э):
AZХ + 42Не → ? →A+3Z+2Y + n
18. Допишите уравнения ядерных реакций:
а) 6128Ni + p → (?)→ ? + n
б) 8939Y + n → (?)→ 8938Sr + ?
в) ? + p → (8335Вr) → ? + n
г) 25399Es + ? → (?)→ 256101Md + ?
д) 5024Сr + p→ (?)→ ? + γ
19. В природных соединениях хлор находится в виде изотопов 35Сl (75,5% (масс.)) и 37Сl (24,5% (масс.)). Вычислите среднюю атомную массу природного хлора.
20. Природный магний состоит из изотопов 24Мg, 25Mg и 26Мg. Вычислите среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78,6, 10,1 и 11,3.
Задачи для самостоятельного решения:
1. Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Укажите число протонов и нейтронов в ядре атома и название элемента.
2. Напишите полные уравнения реакций, краткая запись которых имеет вид: а) 6329Сu(р, n)6330Zn; б) 9842Mo(n, е-)9943Tc; в) 55Мn(n, α)52V; г) 53Сr(d, n)54Мn.
3. Фотон γ-излучения выбивает из ядра изотопа 2612Мg протон. Какое ядро при этом образуется?
4. При действии γ- квантов алюминий превращается в изотоп магния. Какая частица испускается при этом возбужденным ядром алюминия?
5. Определите исходное ядро, если из него при бомбардировке дейтронами образуется изотоп марганца 5425Мn с выбросом нейтрона.
6. При облучении дейтронами ядер изотопа 4119К образуется возбужденное ядро, выбрасывающее протон. Какой конечный изотоп получен в результате этой реакции?
7. Самый тяжелый галоген астат был получен в 1940 г. при облучении 20983Вi α-частицами. Какой изотоп астата образуется, если возбужденное ядро выбрасывает два нейтрона?
8. Какие элементы образуются при α-распаде ядер 115B; 2814Si; 21484Ро?
9. Укажите природу и состав неустойчивого промежуточного ядра (т. е. приведите его структурный символ) для следующих ядерных реакций:
а) 53Сr (d, n) 54Мn
б) 55Мn (n, α)52V
в) 32S (α, d) 34Сl
10. Напишите уравнения ядерных реакций:
а) 51V(α, n)? г) ? (α, d) 34Cl
б) 56Fе (d, ?) 57Со д) 19 F(?, γ) 20Nе
в) 14N (?, р) 17О
11. Природный галлий состоит из изотопов 71Gа и 69Gа. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если средняя атомная масса галлия равна 69,72?
Занятие №5.
Количественные характеристики ядерных реакций.
Интенсивность радиоактивного процесса характеризуется числом атомных ядер, претерпевающих самопроизвольное превращение в единицу времени. Основная единица — кюри: активностью в 1 кюри обладает такое количество данного радиоактивного вещества, в котором в течение I сек распадается 37∙109 атомных ядер.
Период полураспада (τ 1/2) — время, в течение которого распадается половина первоначального количества радиоактивного изотопа.
Основной закон радиоактивного распада: число атомов радиоизотопа, распадающееся в единицу времени, пропорционально общему числу его атомов, имеющихся в наличии в этот момент.
Коэффициент пропорциональности, показывающий, какая часть наличного числа атомов распадается в единицу времени, называется константой радиоактивного распада изотопа. Обозначается через λ (сек-1). Обратная величина (1/λ) указывает, из какого числа атомных ядер в течение 1 сек распадается одно.
Средняя продолжительность жизни радиоизотопа (τж) — промежуток времени, в течение которого любое количество этого изотопа разложилось бы без остатка, если бы распад все время протекал с начальной скоростью. Очевидно, что τж — величина, обратная константе распада (τж = 1/λ).
Закону радиоактивного распада отвечают следующие соотношения:
m = m0е-λτ, ln(m/m0) = -λτ, λτ1/2 = ln2 = 0,693,
где т - масса радиоактивного изотопа в момент времени τ; т0 - первоначальная масса того же изотопа при τ = 0; е - основание натурального логарифма (е = 2,718); λ - константа радиоактивного распада.
Задачи:
1.В лаборатории в течение 34 ч хранился изотоп 81Sr (τ1/2 = 8,5 ч). Первоначальное количество изотопа — 10 мг. Сколько его осталось после окончании срока хранения?
2. Период полураспада некоторого радиоизотопа равен 20 ч. После его хранения выяснилось, что изотоп распался на 98,4 %. Сколько времени он хранился?
3. Период полураспада 238U равен 4,5∙109 лет. На сколько процентов данная масса этого изотопа распадается за 270 млн. лет?
4. От 400 мг радиоизотопа 13N за 55 мин его хранения осталось 12,5 мг. Чему равен период полураспада этого изотопа?
5. Период полураспада изотопа 55Fе равен 4 годам. Через сколько лет 1 г железа, взятого в виде указанного изотопа, вследствие радиоактивного распада уменьшится в массе до 72 мг.
6. Период полураспада β-радиоактивного изотопа 24Na равен 14,8 ч. Напишите уравнение ядерной реакции и вычислите, какая масса 24Мg получится из 12 г 24Na: а) за 10 ч; б) при полном радиоактивном разложении взятого количества изотопа натрия.
7. Имеется 10,5 г α-радиоактивного изотопа 210Ро (τ1/2 = 138,3 суток). Напишите уравнение реакции распада. Вычислите: а) сколько свинца 206Рb образуется за 1 год из указанного количества полония; б) какой объем (при н. у.) займет гелий при полном распаде 210Ро.
8. 100 мг образца металлического кобальта содержит 10% радиоактивного изотопа 60Со (τ1/2 = 5,3 года), остальное — стабильные изотопы. Сколько будет весить образец через 15 лет? Каково будет процентное содержание в нем изотопа 60Со?
9. Вычислите константу распада λ, (сек-1) и среднюю продолжительность жизни τж изотопа 45Са (τ1/2= 152 суток).
10. Константа распада радиоизотопа азота 16N равна 9,42∙10-2 сек-1. Вычислите среднюю продолжительность жизни и период полураспада этого изотопа.
11. Константа распада радиоизотопа 89Sr равна 1,513∙10-7 сек-1. Из какого числа атомов указанного изотопа каждую секунду распадается один? Сколько распадающихся ядер приходится на 1 г 89Sr в одну секунду? Выразите удельную радиоактивность указанного изотопа в кюри/г.
12. Активность некоторого препарата радиоизотопа в момент его получения составляла 800 мккюри. Чему будет равна активность того же препарата по истечении 3 периодов полураспада?
13. Период полураспада радиоактивного изотопа 256No приблизительно равен 8 сек. Сколько из 100 атомов изотопа распадается: а) за 1 сек; б) за 20 сек? Определите удельную радиоактивность изотопа в кюри/г.
14. Периоды полураспада изотопов 25Nа и 15О относятся между собой, как 1 : 2. Укажите для этих изотопов отношение: а) их констант радиоактивного распада; б) продолжительностей жизни; в) активностей в кюри/моль; г) удельных активностей в кюри/г.
15. Период полураспада радия 226Rа равен 1590 годам. Вычислите: а) константу распада λ, в сек-1; б) число ядер, распадающихся ежесекундно, на 1 моль радия; в) удельную активность радия в кюри/г.
16. Средняя продолжительность жизни радиоизотопа свинца 210Рb равна 109 сек. Вычислите: а) константу распада λ (сек-1); б) период полураспада τ1/2 (годы); в) удельную активность ауд (кюри/г).
17. Удельная активность изотопа 111Аg равна 1000 кюри/г. Чему равен период полураспада этого изотопа?
18. У изотопа 16N λ = 9,42∙10-2 сек-1. Вычислите τж и τ1/2 в сек и ауд в кюри/г.
19. На сколько процентов понизится активность изотопа 128I (τ1/2 = 25 мин) после его хранения в течение 2,5 ч?
20. Препарат Na2НРО4 «мечен» радиоактивным изотопом 32Р (τ1/2 = 14,3 суток), т. е. он содержит некоторое количество соли Nа2Н32РО4. Начальная активность препарата 700 мккюри. Определите его активность к концу 50 суток хранения. Сколько это составит процентов от начальной активности препарата?
Задачи для самостоятельного решения:
1. Если из 1012 атомов радия каждую секунду распадается 14 атомов, то чему равна для радия константа радиоактивного распада и из скольких атомов Rа распадается один атом за 1 с?
2. Если у одного радиоактивного элемента ежесекундно распадается 1 атом из 10, а у другого — 1 атом из 1000, то чему равна средняя продолжительность их жизни? Какой из них и во сколько раз долговечнее?
3. При помощи ядерных реакций был получен изотоп массой 2 г с периодом полураспада 12 ч. Какая масса этого изотопа останется через: а) сутки, б) двое суток?
4. Найти массу изотопа 81Sr (τ1/2 = 8,5 ч), оставшуюся через 25,5 ч хранения, если первоначальная масса его составляла 200 мг.
5. Вычислите процент атомов изотопа 28I (τ1/2 = 25 мин), оставшихся нераспавшимися после его хранения в течение 2,5 ч.
6. Период полураспада β- радиоактивного изотопа 24Na равен 14,8 ч. Напишите уравнение реакции распада и вычислите, сколько граммов дочернего продукта образуется из 24 г 24Nа за 29,0 ч.
7. Радиоактивный иод 131I имеет период полураспада, равный 8 дням. Если взять 100 мг этого изотопа то, сколько его останется через 16 дней.
8. Определите среднюю продолжительность жизни радия 226 и рубидия 87, если их периоды полураспада составляют 1617 лет и 6∙1010 лет соответственно.
9. Определите константу распада радона. Период полураспада радона 3,825 дня.
10.Определите, сколько грамм 210Po (τ1/2 = 138,3 суток) надо взять для того, чтобы это количество проявило активность в 1 кюри.
Занятие №6.
Контрольная работа 1.
Контрольная работа № 1 содержит задачи на следующие темы:
Атомно-молекулярное учение. Характеристики атомов.
Волновые и корпускулярные свойства микрообъектов. Теория Бора, Планка, Де Бройля, Гейзенберга.
Основы квантовой химии. Электронные оболочки атомов.
Строение ядра. Ядерные превращения.
Количественные характеристики ядерных реакций.
При подготовке к контрольной работе рекомендуется решить все задачи из разделов для самостоятельной работы, и оценить свои знания с помощью проверочного теста.
Тест для проверки знаний:
1. Химические свойства вещества определяются тремя субатомными частицами. Две из них имеют одинаковый по величине, но противоположный по знаку заряд, а третья не имеет заряда. Эти частицы называются …………, …………… и ………………….
2. Число протонов в ядре атома указывает …………….элемента и записывается слева в виде нижнего индекса у символа элемента. Например, для углерода число протонов у символа элемента можно записать следующим образом: …………. С.
3. Верхний слева индекс у символа элемента указывает суммарное число протонов и нейтронов в ядре атома и называется ……………….. Символ углерода, каждый атом которого содержит 6 протонов и 8 нейтронов в ядре, обозначается как ……………… С.
4. Укажите число протонов, нейтронов и электронов для атомов представленных ниже изотопов:
Изотоп |
Число протонов
|
Число нейтронов
|
Число электронов
|
(1) 13С
|
|
|
|
(2) 55Мn
|
|
|
|
(3) 97Мо |
|
|
|
5. Ядро атома 8036Кг, содержит
(1)
80р и 36n; (2)
36р и 44![]() ;
(3) 36р и 80n; (4)
36р и 44n.
;
(3) 36р и 80n; (4)
36р и 44n.
6. Какое число электронов у иона хрома 5224Сг3+:
(1) 21; (2) 24; (3) 27; (4) 52?
7. Какая частица имеет большее число протонов, чем электронов:
(1) Na0; (2) S0; (3) S2-; (4) Na+?
8. Массовое число изотопа равно
(1) числу протонов в ядре; (2) числу нейтронов в ядре;
(3) числу орбитальных электронов; (4) суммарному числу нейтронов и протонов.
9. Атом элемента имеет порядковый номер 13 и массовое число 27. Число валентных электронов у него равно
(1) 2; (2) 3; (3) 4; (4) 5.
10. Октет электронов на внешней электронной оболочке имеет
(1) S2+; (2) Si0; (3) О2-; (4) Na0.
11. Электронную конфигурацию благородного газа имеет
(1) Те2-; (2) Ga+; (3) Fe2+; (4) Cr3+.
12. Ион, имеющий в своем составе 18 электронов и 16 протонов, обладает зарядом, равным
(1) +18; (2) -18; (3) +2; (4) -2.
13. Атом какого элемента имеет электронную конфигурацию 1s22s22p63s23p64s1:
(1) К; (2) Са; (3) Ва; (4) Na?
14. Электронная конфигурация иона Zn2+ соответствует формуле
1s22s22p4 (2) 1s22s22p63s23p6
(3) 1s22s22p63s23p63d10 (4) 1s22s22p63s23p63d104s24p6
15. Три частицы: Ne0, Na+ и F- имеют одинаковое
(1) массовое число; (2) число нейтронов; (3) число электронов; (4) число протонов.
16. Сколько неспаренных электронов имеет ион Со3+:
(1) 3; (3) 5; (2) 4; (4) 6?
17. Распределение электронов по энергетическим уровням и подуровням у элемента с порядковым номером 79 изображается так …………………. .
18. Атом какого элемента в невозбужденном состоянии имеет следующую электронную конфигурацию 1s22s22p63s23p64s23d104p3
(1) Р; (2) Si; (3) As; (4) Ge?
19. Ниже записаны электронные конфигурации атома серы:
1 |
↑↓ |
|
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
|
↑↓ |
|
↑ |
↑ |
↑ |
|
|
|
|
|
|
|
↑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
↑↓ |
|
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
|
↑↓ |
|
↑↑ |
↑ |
↑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
↑↓ |
|
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
|
↑↓ |
|
↑↓ |
↑ |
↑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
↑↓ |
|
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
|
↑↓ |
|
↑ |
↑↑ |
↑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
↑↓ |
|
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
|
↑ |
|
↑ |
↑ |
↑ |
|
↑ |
↑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
↑↓ |
|
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
|
↑↑ |
|
↑ |
↑ |
↑↓ |
|
|
|
|
|
|
|
|
|
|
|
|
|
1s |
|
2s |
|
2р |
|
3s |
|
3p |
|
3d |
|
4s |
|
4p |
||||||||||
Какие из этих конфигураций соответствуют основному …………, возбужденному ……….. и запрещенному (недопустимому) ………….. состояниям?
20. Электроны атома меди (порядковый номер 29) в основном состоянии распределены по орбиталям следующим образом:
(1) |
↑↓ |
|
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
|
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
|
↑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1s |
|
2s |
|
2р |
|
3s |
|
3p |
|
3d |
|
4s |
|
4p |
||||||||||
(2) ls22s22p63s23p63d94s2,
(3) ls22s22p63s23p64s24d9,
(4) |
↑↓ |
|
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
|
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
|
↑ |
↑ |
↑ |
↑ |
↑ |
|
↑↓ |
|
↑↓ |
↑ |
↑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1s |
|
2s |
|
2р |
|
3s |
|
3p |
|
3d |
|
4s |
|
4p |
||||||||||
21. Ниже перечислены электронные конфигурации четырех различных атомов.
В каждом случае укажите, относится ли данная конфигурация (I) к нейтральному атому или иону; (II) к основному или возбужденному состоянию:
Электронная конфигурация |
|
|
(1) 16S ls22s22p63s23p6 |
|
|
(2) 6C ls22s12p3 |
|
|
(3) 21Sc ls22s22p63s23p64s23d1 |
|
|
(4) 8О ls22s22p6 |
|
|
22. Какая из частиц имеет электронную конфигурацию, одинаковую с атомом аргона:
(1) Са2+; (2) Сl°; (3) К°; (4) Na+?
23. Атомам каких элементов соответствуют представленные ниже электронные конфигурации?
Электронная конфигурация
|
Элемент
|
(1) ls22s22p1 |
|
(2) ls22s22p2 |
|
(3) ls22s22p5 |
|
(4) ls22s22p63s1 |
|
24. Запишите конфигурации внешних электронных слоев для следующих ионов:
(1) Мn4+; (2) S2-; (3) Cu+; (4) K+ ; (5) C1-; (6) Pb2+.
25. Валентные электроны атома гафния находятся на орбиталях
(1) 6s24f2; (2) 6s25d2; (3) 6s26p2; (4) 6s25f2.
26. При радиоактивном излучении наибольшим проникающим эффектом обладают
(1) α-частицы; (3) γ-лучи;
(2) β-частицы; (4) тепловые нейтроны.
27. При радиоактивном распаде радия по схеме 22688Ra → 22286Rn + • • помимо радона образуется
(1) β -частица; (3) протон;
(2) стабильный изотоп свинца; (4) α -частица.
28. Гамма-излучение представляет собой поток
(1) ядер гелия;
(2) электронов с одинаковой энергией;
(3) тепловых нейтронов;
(4) квантов электромагнитного излучения.
29. Закончите схему реакции 94Ве + 42Не → 126C+ . • • , выбрав один из предложенных вариантов:
(1) 11p; (3) 21Н;
(2) 10n; (4) 0-1e.
30. В результате ядерной реакции 2713Аl + 21Н → 42Не + ... образуется изотоп
(1) 2512Mg; (3) 2914Si;
(2) 3316S; (4) 2513Al.
31. В атоме изотопа золота 197Аu содержится • • • протонов, • •• нейтронов, • • • электронов.
Ответы:
1. Электрон, протон и нейтрон.
2. Порядковый номер, 6С.
3. Массовым числом, 614С.
4. |
Изотоп |
Число протонов
|
Число нейтронов
|
Число электронов
|
|
(1) 13С
|
6 |
7 |
5 |
|
(2) 55Мn
|
25 |
30 |
25 |
|
(3) 97Мо |
42 |
55 |
42 |
5. (4) 36р и 44n.
6. (1) 21.
7. (4) Na+.
8. (4) суммарному числу нейтронов и протонов.
9. (2) 3.
10. (3) О2-.
11. (1) Те2-.
12. (4) -2.
13.(1) К.
14. (3) 1s22s22p63s23p63d10.
15. (3) число электронов.
16. (4) 6.
17. 1s22s22p63s23p64s23d104p65s24d105p66s14f145d10
18. (3) As.
19. основному - (3), возбужденному – (5), запрещенному (недопустимому) – (1), (2), (4), (6).
20. (1)
21. |
Электронная конфигурация |
|
|
|
(1) 16S ls22s22p63s23p6 |
S2- |
Основное |
|
(2) 6C ls22s12p3 |
С0 |
Возбужденное |
|
(3) 21Sc ls22s22p63s23p63d14s2 |
Sc0 |
Основное |
|
(4) 8О ls22s22p6 |
O2- |
Основное |
22.(1) Са2+.
23. |
Электронная конфигурация
|
Элемент
|
|
(1) ls22s22p1 |
B |
|
(2) ls22s22p2 |
C |
|
(3) ls22s22p5 |
N |
|
(4) ls22s22p63s1 |
Na |
24. Запишите конфигурации внешних электронных слоев для следующих ионов:
(1) Мn4+; 1s22s22p63s23p64s23d1
(2) S2-; 1s22s22p63s23p6
(3) Cu+; 1s22s22p63s23p63d10
(4) K+ ; 1s22s22p63s23p6
(5) C1-; 1s22s22p63s23p6
(6) Pb2+. 1s22s22p63s23p64s23d104p65s24d105p66s24f145d10
25. (2) 6s25d2.
26. (3) γ-лучи.
27. (4) α -частица.
28. (4) квантов электромагнитного излучения.
29. (2) 10n.
30. (1) 2512Mg.
31. 79 протонов, 118 нейтронов, 79 электронов.
Занятие №7.
Периодическая система.
Учение о строении атома позволило понять и объяснить периодический закон и периодическую систему элементов.
Периодичность в изменении свойств химических элементов, расположенных в порядке возрастания заряда ядра их атомов, является результатом периодического повторения структуры внешнего электронного слоя, что связано с последовательным заполнением атомных орбиталей в соответствии с принципом наименьшей энергии.
Период в системе элементов - категория энергетическая. Номер периода и номер энергетического уровня в электронной оболочке атома (главное квантовое число п) — величины взаимосвязанные, но не тождественные.
Число застраиваемых (полностью или частично) энергетических уровней (т. с. число электронных слоев в оболочке атома) соответствует номеру периода, в котором находится данный элемент.
Число валентных электронов в атоме, как правило, соответствует номеру группы в таблице элементов.
Если все валентные электроны расположены на одном (внешнем) уровне — это элемент главной подгруппы (подгруппы А), к ним относятся s - и р-элементы. Если все валентные электроны расположены на двух уровнях (внешнем и предвнешнем) — это элемент побочной подгруппы (подгруппы В). К ним относятся d -элементы. Элементы семейств лантана и актиния рассматриваются как внегрупповые. Это f- элементы.
Число главных подгрупп определяется максимальным числом элементов на энергетическом уровне и равно 8. Число переходных элементов (элементов побочных подгрупп) определяется максимальным числом электронов на d-подуровне и равно 10 в каждом из больших периодов.
Задачи:
Электронные формулы некоторых элементов:
а) 1s22s22p63s1
б) 1s22s22p63s23p3
в) 1s22s22p63s23p64s2
г) 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f13
Для каждого элемента:
а) подсчитайте общее число электронов в атоме, укажите порядковый номер элемента и назовите его;
б) выявите достраиваемый энергетический подуровень и укажите электронное семейство, к которому относится элемент;
в) укажите общее число валентных электронов и обратите внимание на характер расположения их на энергетических уровнях (на одном или на двух внешних уровнях); отметьте, к какой группе и подгруппе периодической таблицы относится каждый элемент;
г) ориентируясь на число электронов во внешнем слое, укажите, каким характером (металлическим или неметаллическим) обладают элементы;
д) по числу застраиваемых энергетических уровней определите, к какому периоду относится элемент.
2. Структура внешних электронных слоев атома: а) 4s24р3; б) 5d56s2; в) 3d34s2. К каким периодам и группам относятся элементы, атомы которых содержат указанные группировки?
3. Не пользуясь периодической таблицей элементов, определите порядковый номер элемента, электронную конфигурацию его атома, возможные степени окисления, если он находится:
а) в 5-ом периоде, IIIА группе;
б) в 5-ом периоде, VIIIБ группе.
4. Представьте характерные электронные конфигурации для элементов:
а) шестого периода, VВ-подгруппы;
б) четвертого периода, IVА-подгруппы;
в) восьмого периода, IIIА-подгруппы.
5. Представьте электронную конфигурацию всего энергетического уровня, содержащего такие группировки: а) 5f9; б) 4р3; в) 4f3; г) 6d2. Подсчитайте общее число электронов на уровне.
6. Какую информацию о месте элемента в периодической системе и его свойствах можно получить, зная порядковый номер элемента? Покажите это на примере элементов с порядковыми номерами 20, 24 и 25.
7. Для элемента седьмого периода характерна конфигурация f3d1. Какой это элемент?
8. Укажите группы и подгруппы, для которых характерны конфигурации: а) s2р4; б) d3s2; в) s1. Какие группировки относятся к металлам, какие — к неметаллам?
9. Атом элемента имеет электронную формулу 1s22s22p63s23p5. Определите место элемента в периодической системе и напишите для него электронные формулы иона Э- и условного иона Э7+.
10. Объясните с помощью схемы электронной структуры способность серы проявлять валентные состояния 2, 4 и 6.
11. Чем объясняется способность марганца проявлять степень окисления, равную семи? Приведите схему электронной структуры атома Мn в нормальном и возбужденном состояниях.
12. Объясните с помощью схем электронной структуры, почему хлор может проявлять различные степени окисления, а фтор не может.
13. Атом элемента содержит 5 валентных электронов, которые все расположены на внешнем электронном слое. Напишите формулу высшего солеобразующего оксида этого элемента (обозначив его через Э). Способен ли рассматриваемый элемент образовывать газообразное соединение с водородом?
14. Атом элемента на втором, считая снаружи, электронном слое содержит 13 электронов, а на внешнем — один. К какой группе и подгруппе относится элемент? Чему равна его высшая положительная валентность? Что это — металл или неметалл? Способен ли рассматриваемый элемент образовывать отрицательно заряженные ионы?
15. Элемент образует гидрид состава ЭН2. Чему равна валентность элемента? К какой группе он принадлежит? Напишите формулу высшего окисла этого элемента.
Задачи для самостоятельного решения:
1. К каким периодам и группам относятся элементы, в оболочке атомов которых имеются электронные конфигурации: 6р3; 4f9; 7d4; 6f5; 5g10?
2. Высший солеобразующий окисел некоторого элемента имеет молекулярный вес 108 и содержит 74,08% кислорода. Элемент образует газообразное соединение с водородом. К какой группе и подгруппе принадлежит элемент?
3. Не пользуясь периодической таблицей элементов, определите порядковый номер элемента, электронную конфигурацию его атома, возможные степени окисления, если он находится:
а) в 4-ом периоде, VА группе;
б) в 4-ом периоде, VБ группе.
4. Не пользуясь периодической таблицей элементов, определите период и номер группы в которой он находится, электронную конфигурацию его атома, возможные степени окисления, если порядковый номер элемента:
а) 30; б) 50; в) 55.
5. По следующим данным установите порядковый номер элемента и назовите его:
Номер периода |
5 |
6 |
5 |
4 |
Характерная электронная конфигурация |
d5 |
f5 |
р1 |
р3 |
6. Дайте схему электронной конфигурации, характерной для элементов подгрупп: а) 1А; б) IIIВ; в) IVА; г) VВ; д) VIIА; д) VIIВ. Чем обусловливается значительное сходство d-элементов, образующих побочные подгруппы в периодической таблице элементов? С чем связано общее название их — «переходные металлы»?
7. Напишите электронные формулы ионов. О2-, S2-, Sс3+, Сr3+, Мn2+, Ag+, Rb+, Вr-.
8. Какое из перечисленных газообразных водородных соединений наиболее прочно и какое наименее прочно: NН3, РН3, AsН3, SbН3, BiН3?
Занятие №8.
Периодичность изменения свойств элементов и их соединений.
Периодичность - это повторяемость химических и некоторых физических свойств у простых веществ и их соединений при изменении порядкового номера элементов. Она связана, в первую очередь, с повторяемостью электронного строения атомов по мере увеличения порядкового номера (а, следовательно, заряда ядра и числа электронов в атоме).
Химическая периодичность проявляется в аналогии химического поведения, однотипности химических реакций. При этом число валентных электронов, характерные степени окисления, формулы соединений могут быть разными. Периодически повторяются не только сходные черты, но и существенные различия химических свойств элементов по мере роста их порядкового номера.
Некоторые физико-химические свойства атомов (потенциал ионизации, атомный радиус), простых и сложных веществ могут быть не только качественно, но и количественно представлены в виде зависимостей от порядкового номера элемента, причем для них периодически проявляются четко выраженные максимумы и минимумы.
Вертикальная периодичность заключается в повторяемости свойств простых веществ и соединений в вертикальных столбцах Периодической системы. Это основной вид периодичности, в соответствии с которым все элементы объединены в группы. Элементы одной группы имеет однотипные электронные конфигурации. Химия элементов и их соединений обычно рассматривается на основе этого вида периодичности. В пределах каждой подгруппы сверху вниз радиусы атомов увеличиваются и соответственно уменьшаются ионизационный потенциал, сродство к электрону и электроотрицательность, т. е. усиливаются металлические свойства простых веществ.
Горизонтальная периодичность заключается в появлении максимальных и минимальных значений свойств простых веществ и соединений в пределах каждого периода. Она особенно заметна для элементов VIIIБ-группы и лантаноидов (например, лантаноиды с четными порядковыми номерами более распространены, чем с нечетными). Для элементов главных подгрупп по периоду слева направо уменьшаются радиус атома и увеличиваются ионизационный потенциал, сродство к электрону и электроотрицательность, т. е, уменьшаются металлические и усиливаются неметаллические признаки. Соответственно свойства простых веществ изменяются от типичного металла — щелочного до типичного неметалла — галогена, после чего период завершается благородным газом.
Диагональная периодичность - повторяемость свойств простых веществ и соединений по диагоналям Периодической системы. Она связана с возрастание неметаллических свойств в периодах слева направо и в группах снизу вверх. Поэтому литий похож на магний, бериллий на алюминий, бор на кремний, углерод на фосфор.
В
результате объединения вертикальной,
горизонтальной и диагональной
периодичности появляется так называемая
звездная периодичность. Так, свойства
германия напоминаю т
свойства окружающих его галлия, кремния,
мышьяка и олова. На основании таких
"геохимических звезд" можно
предсказать присутствие элемента в
минералах и рудах.
т
свойства окружающих его галлия, кремния,
мышьяка и олова. На основании таких
"геохимических звезд" можно
предсказать присутствие элемента в
минералах и рудах.
Многие свойства элементов в группах изменяются не монотонно, а периодически, особенно для элементов IIIA-VIIA-групп. Такое явление носит название вторичной периодичности. Так, германий по своим свойствам больше похож на углерод, чем на кремний.
В ряду d-элементов происходит уменьшение радиуса атомов, которое называют «d - сжатием». Эта общая закономерность приводит к уменьшению радиуса атома вниз по подгруппе, начиная с III группы.
Изменение свойств элементов побочных подгрупп по периодам и группам имеет свои особенности. Десять d-элементов каждого большого периода располагаются в III—VIII и I—II группах. Число внешних электронов для них обычно равно двум (ns2), а иногда одному (пs1). Это различие объясняется эффектом так называемого «проскока» электрона. Энергетически более выгодны наполовину или полностью заполненные d-подуровни (d5 и d10), поэтому когда до завершения таких конфигураций не хватает одного электрона, он переходит в d -подуровень с внешней s -орбитали: d 4s2 → d 5s1 (Сr, Мо), d 9s2 → d 10s1 (Сu, Аg, Au).
Заполнение d- и особенно f-подуровня экранирует внешний электронный слой от ядра, что приводит к сравнительно небольшому уменьшению радиуса атомов этих элементов и соответственно их свойства меняются не так резко по периоду, как свойства элементов главных подгрупп. Все они являются металлами и отрицательных степеней окисления не проявляют.
Характерной особенностью d-элементов является их способность к образованию химической связи за счет электронов (n - 1) d -подуровня. Первый и последний члены ряда d -элементов имеют постоянную и устойчивую степень окисления, равную номеру группы. Промежуточные элементы проявляют переменную степень окисления, а устойчивость максимальной из них падает в ряду слева направо, и вместе с тем возрастают окислительные свойства соответствующих соединений.
Элементы III группы, начинающие ряд d -элементов в периоде (Sс, I, La, Ас), по своим свойствам являются переходными от предшествующих им s -элементов к d -элементам Их металлические свойства и основной характер соединений, также как и в главных подгруппах, усиливается сверху вниз. Начиная с IV группы свойства d -элементов внутри группы меняются иначе и в соответствии с общей для них закономерностью сверху вниз уменьшаются их металлические свойства и активность простых веществ. В том же направлении повышается устойчивость высоких степеней окисления, кислотный характер гидроксидов и склонность элементов к образованию анионных комплексов.
Благодаря эффекту «лантаноидного сжатия» радиусы атомов d -элементов, находящихся в одной группе, но в разных периодах (5-м и 6-м), практически остаются одинаковыми, что приводит к такому сходству между ними, за которое их иногда называют элементами-близнецами.
Задачи:
1. Как изменяются радиусы атомов, ионизационные потенциалы, сродство к электрону и электроотрицательность элементов внутри периода и при переходе от одного периода к другому в пределах данной группы? Атомы каких элементов имеют максимальные и минимальные значения этих величин?
2. Как изменяются металлические и окислительно-восстановительные свойства элементов главных подгрупп по периодам и в пределах одной группы? Что является причиной этих изменений? Назовите два резко отличающиеся по своим свойствам элемента: а) одного и того же периода, б) одной и той же группы.
3. Какие из s-элементов в виде простых веществ являются: а) газообразными неметаллами, б) металлами? Какой из них образует амфотерные оксид и гидроксид?
4. Приведите примеры p-элементов, которые в виде простых веществ являются металлами и неметаллами. Назовите гидроксиды элементов, относящиеся к классу кислот, оснований, проявляющие кислотно-основную двойственность,
5. Какое место в периодической системе занимают два элемента, один из которых характеризуется наибольшим значением ионизационного потенциала и электроотрицательности, а другой — наименьшим значением этих величин?
6. Почему свойства таких элементов, как углерод и свинец, азот и висмут, калий и бром, хлор и аргон, магний и неон резко отличаются друг от друга?
7. Как изменяется конфигурация валентных электронов и максимальная степень окисления s- и p-элементов в периоде и как это связано с порядковым номером и номером группы?
8. Как изменяется конфигурация валентных электронов, максимальная степень окисления и ее устойчивость в ряду d-элементов периода? Для каких d-элементов число валентных электронов и максимальная степень окисления совпадают с номером группы, меньше и больше номера группы?
9. На примере элементов 4-го периода покажите и объясните, почему максимальная степень окисления d-элементов сначала возрастает, а затем уменьшается. Какие d-элементы имеют постоянную степень окисления?
10. Сравните изменение свойств р- и d-элементов в периоде и в пределах группы. Чем объяснить сходство: а) d-элементов III группы с р-элементами той же группы, б) лантаноидов, в) актиноидов.
11. В каких степенях окисления d-элементы проявляют определенное сходство с р-элементами той же группы? Покажите это на примере элементов VI и VII групп.
12. В атомах каких элементов осуществляется так называемый «проскок» электронов? Объясните причину этого эффекта.
13. Чем определяется большое сходство d-элементов 5-го и 6-го периодов, находящихся в одной и той же группе?
14. Почему гидроксид лития по силе основных свойств, растворимости и способности отщеплять воду при нагревании проявляет сходство с гидроксидами магния и кальция?
15. Как изменяются свойства оксидов и гидроксидов s- и p-элементов в периоде? Объясните причину и покажите различие в свойствах гидроксидов первого и предпоследнего элемента 3-го периода.
16. Почему основные свойства гидроксида галлия выражены не сильнее, а слабее основных свойств гидроксида алюминия?
17. Покажите и объясните различие в окислительно-восстановительных свойствах однотипных соединений марганца и рения, например перманганата и перрената калия.
18. Зная закономерность в изменении свойств элементов в побочных подгруппах, объясните, почему природные соединения хрома и вольфрама не однотипны: основная руда первого элемента — хромистый железняк Fе(СrО2)2, а второго шеелит СаWО4.
19. Какой из оксидов должен быть более сильным окислителем: ТiO2 или Мn2О7, СrО3 или WО3?
20. Укажите, какая из двух сравниваемых щелочей более химически активна: а) NаОН или СsОН; б) Са(ОН)2 или Ва(ОН)2?
21. Какой из двух сравниваемых оксидов обладает более ясно выраженным кислотным характером: а) Сr2О3 или СrО3; б) МnО или Мn2О7?
22. Укажите характер оксидов железа: FеО, Fе2О3 и FеО3. Напишите химические формулы железной кислоты и ее солей: феррата калия и феррата бария.
Задачи для самостоятельного решения:
1. Пользуясь таблицей элементов, напишите формулы:
а) угольной, кремниевой, ванадиевой, вольфрамовой, ниобиевой, свинцовой, висмутовой, рениевой кислот (по типу метакислот);
б) гидроксида, сульфата и ортофосфата индия;
в) гидроксида франция, нитрата технеция, карбоната цезия, астатоводорода, ванадата калия, ниобата натрия, титаната кальция.
2. Учитывая, что элементы Ве, Zn, А1 образуют амфотерные гидроксиды, напишите химические формулы соединений:
а) нитрата бериллия, бериллиевой кислоты, бериллата калия;
б) гидроксида цинка, сульфата цинка, цинката натрия;
в) гидроксида алюминия, нитрата алюминия, мета- и ортоалюминиевых кислот, метаалюмината натрия, ортоалюмината калия.
3. Гидроксид хрома Сr(ОН)3 амфотерен. Напишите формулы: а) сульфата хрома; б) ортохромистой кислоты и ортохромита натрия; в) метахромистой кислоты и метахромита кальция.
4. С каким элементом более сходен молибден по свойствам — с селеном или с хромом? Чем это объясняется?
5. Исходя из положения элементов в периодической системе, определите: а) у какого из гидроксидов — Sn(ОН)2 или Pb(ОН)2 — более выражены основные свойства; б) какая из солей гидролизуется в большей степени; станнат натрия или плюмбат натрия; в) какой из оксидов является более сильным окислителем: SnO2 или РbО2?
6. Какими химическими свойствами обладает искусственно полученный элемент с порядковым номером 87? С каким из элементов периодической системы он наиболее сходен?
Занятие №9.
Химическая связь. Метод ВС.
Метод валентных связей (ВС) иначе называют теорией локализованных электронных пар, поскольку в основе метода лежит предположение, что химическая связь между двумя атомами осуществляется с помощью одной или нескольких электронных пар, которые локализованы преимущественно между ними. В методе ВС связь всегда двухэлектронная и обязательно двухцентровая. Число элементарных химических связей, которые способен образовывать атом или ион, равно его валентности. В образовании химической связи принимают участие валентные электроны. Волновая функция, описывающая состояние электронов, образующих связь, называется локализованной орбиталью (ЛО).
Свойства ковалентной связи: насыщаемость, направленность и поляризуемость.
Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т. е их способностью к образованию строго определенного числа связей, которое обычно лежит в пределах от 1 до 6. Общее число валентных орбиталей в атоме, т. е. тех, которые могут быть использованы для образования химических связей, определяет максимально возможную ковалентность элемента. Число уже использованных для этого орбиталей определяет ковалентность элемента в данном соединении.
Направленнность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами. Это достигается при такой пространственной направленности перекрывания электронных облаков, которая совпадает с их собственной. Исключение составляют s-электронные облака, поскольку их сферическая форма делает все направления равноценными. Для p- и d-электронных облаков перекрывание осуществляется вдоль оси, по которой они вытянуты, а образующаяся при этом связь называется σ-связью.
После образования между двумя атомами σ-связи для остальных электронных облаков той же формы и с тем же главным квантовым числом остается только возможность бокового перекрывания по обе стороны от линии связи, через которую в этом случае проходит одна узловая плоскость. В результате образуется π-связь.
Связи, образованные атомом за счет орбиталей с различным значением l, должны быть энергетически неравноценными, что, однако, не подтверждается экспериментом. Противоречие устраняется идеей гибридизации (Л. Полинг), согласно которой при образовании связей орбитали разной симметрии преобразуются в гибридные АО одинаковой формы и одинаковой усредненной энергии, что обеспечивает равноценность образуемых ими связей. Возможность гибридизации определяют три условия:
1) небольшая разница в энергии исходных АО, с увеличением этой разницы уменьшается устойчивость их гибридного состояния и прочность образуемых ими связей;
2) достаточная плотность электронных облаков, что определяется значением главного квантового числа;
4) большая степень перекрывания гибридных АО с орбиталями других атомов при образовании связей, что делает гибридное состояние более устойчивым.
Число гибридных орбиталей равно числу исходных. Образование гибридных АО происходит методом линейной комбинации (сложение и вычитание) исходных АО (ЛКАО).
Для определения геометрии молекул по типу гибридизации центрального атома используются следующие правила:
Определяется электронная формула центрального атома и связанных с ним атомов или ионов.
Устанавливается число σ связей и число неподеленных электронных пар центрального атома. Число неподеленных пар равно полуразности числа валентных электронов и степени окисления (по абсолютному значению).
Определяется число гибридных атомных орбиталей как сумму числа σ связей и неподеленных электронных пар.
По числу гибридных атомных орбиталей определяется тип гибридизации и направление гибридных орбиталей в пространстве.
Возвращаясь к строению валентного уровня центрального атома и связанных с ним частиц, определяется возможность образования дополнительных π связей.
Составляется валентная схема частицы и устанавливается, как согласуется геометрия частицы, длины связей, магнитные свойства с найденной структурой.
Поляризуемость рассматривают на основе представлений о том, что ковалентная связь может быть неполярной (чисто ковалентной) или полярной. В первом случае связь образуется между одинаковыми атомами, и симметричное распределение электронной плотности в межъядерном пространстве приводит к совпадению центров тяжести положительных и отрицательных зарядов. Полярная связь образуется в тех случаях, когда межъядерная электронная плотность смещается к атому с большей электроотрицательностью. Тогда центры тяжести ( + ) и (—) зарядов не совпадают и возникает система (электрический диполь) из двух равных по величине, по противоположных по знаку зарядов (δ+ и δ—), расстояние между которыми называют длиной диполя l. Степень полярности такой связи оценивается значением электрического момента диполя μ, равного произведению абсолютного заряда электрона (q=1,6∙10-19 Кл) на длину диполя: μ = q· l. Дипольный момент обычно измеряют в дебалях (D). 1D = 3,33∙10-30 Кл∙м.
Поляризуемостью ковалентной связи называют ее способность под действием внешнего электрического поля становиться полярной или более полярной. Постоянный момент диполя полярной связи μп в электрическом поле становится больше на величину μi, равную временному моменту наведенного или индуцированного диполя: μ = μп + μi. Роль внешнего электрического поля могут играть заряженные частицы, входящие в состав самого соединения (ионы или атомы с большим аффективным зарядом δ). Поляризующее действие иона приводит к деформации электронной оболочки его соседей, которая тем больше, чем больше их поляризуемость, т. е. способность к такой деформации. Чем больше заряд иона и меньше радиус, тем больше его поляризующее действие и меньше собственная поляризуемость.
Задачи:
1. Определите тип гибридизации центрального атома, значения валентных углов, форму и полярность следующих частиц: CO2, SO2, COCl2, PF3, CO, SO42-, CO32-, PF5, SOCl2, ICl5, SO32-, PO43-, P2O5, IF7, BF3, ClO4-, OF2, H2O, H2S, PH3.
2. Дипольный момент молекулы НСN равен 2,9D. Вычислите длину диполя.
3. Длина диполя молекулы фтороводорода равна 4∙10-11 м. Вычислите ее дипольный момент в дебая и в кулон-метрах.
4. Дипольные моменты молекул Н2О и Н2S равны соответственно 1,84 и 0,94D. Вычислите длины диполей. В какой молекуле связь более полярна? Укажите направления дипольных моментов связей в этих молекулах.
5. Дипольный момент молекулы SO2 равен 1,61D, молекулы СО2 — нулю. Одинаковы ли валентные углы ОSО и ОСО? Ответ мотивировать.
Задачи для самостоятельного решения:
1. Какие типы гибридизации АО углерода соответствуют образованию молекул СН4, С2Н6, С2Н4, С2Н2.
2. Укажите тип гибридизации АО кремния в молекулах SiН4 и SIF4. Полярны ли эти молекулы?
3. Дипольный момент молекулы СS2 равен нулю. Каким типом гибридизации АО углерода описываете образование этой молекулы?
4. Дипольные моменты молекул ВF3 и NF3 равны соответственно 0 и 0,2D. Какими типами гибридизации АО бора и азота описывается образование этих молекул?
Занятие №10.
Химическая связь. Метод МО.
П ри
описании химической связи методом
молекулярных орбиталей (МО)
исходят из того, что все электроны
связанных атомов участвуют в
образовании химической связи и в
соединении находятся на так называемых
молекулярных орбиталях.
В многоатомных молекулах одна молекулярная
орбиталь, содержащая обычно два электрона,
может охватывать все ядра молекулы.
Электронная пара, находящаяся на
такой молекулярной орбитали, называется
делокализованной в отличие от
локализованных пар, связывающих
только два ядра.
ри
описании химической связи методом
молекулярных орбиталей (МО)
исходят из того, что все электроны
связанных атомов участвуют в
образовании химической связи и в
соединении находятся на так называемых
молекулярных орбиталях.
В многоатомных молекулах одна молекулярная
орбиталь, содержащая обычно два электрона,
может охватывать все ядра молекулы.
Электронная пара, находящаяся на
такой молекулярной орбитали, называется
делокализованной в отличие от
локализованных пар, связывающих
только два ядра.
Число молекулярных орбиталей равно сумме атомных. Различают три группы молекулярных орбиталей: связывающие, разрыхляющие и несвязывающие. Электроны, находящиеся на связывающих молекулярных орбиталях, имеют энергию меньшую, чем на атомных, т.е. связывают ядра атомов. Электроны, находящиеся на разрыхляющих молекулярных орбиталях, имеют энергию большую, чем на атомных, и, следовательно, ослабляют связь между атомами. Энергия электронов на несвязывающих молекулярных орбиталях практически равна их энергии на исходных атомных, поэтому такие электроны не влияют на прочность связи. Взаимное расположение связывающих и разрыхляющих молекулярных орбиталей на энергетических диаграммах для соединений элементов 2-го периода приведены на схеме.
Исходя из распределения электронов по молекулярным орбиталям, определяют такие характеристики химической связи, как кратность и магнитные свойства. Кратность связи рассчитывается как полуразность чисел электронов на связывающих и разрыхляющих орбиталях. По магнитным свойствам соединения делят на парамагнитные и диамагнитные. Парамагнитные соединения имеют неспаренные электроны, в диамагнитных соединениях все электроны спарены. Анализируя энергетические диаграммы, можно сопоставить энергии и длины связей, а также потенциалы ионизации не сильно различающихся по электронному строению соединений.
Задачи:
1.Составьте энергетические схемы образования следующих частиц: Н2, Н2-, Н2+, Не2, Не2+, ННе. Определите возможность существования каждой частицы. Напишите электронную формулу молекулы.
2.Составьте энергетические схемы образования двухатомных молекул простых веществ элементов II периода.
3. Какая из молекул – В2 или С2 характеризуется более высокой энергией диссоциации на атомы? Сопоставьте магнитные свойства этих молекул.
4. Как распределяются электроны по МО в молекуле CN и в молекулярном ионе СN-, образующемся по схеме: С- + N → CN-. В какой из этих частиц длина связи наименьшая?
5. Как изменяются длина связи, энергия диссоциации и магнитные свойства в ряду: О22-- О2-- О2 - О2+?
6. Как изменяются длина связи, энергия диссоциации и магнитные свойства в ряду: NО- - NО - NО+?
7. Составьте энергетическую диаграмму молекулы LiH. Какие орбитали в ней являются связывающие, а какие – несвязывающие?
Задачи для самостоятельного решения:
Почему не существует устойчивых молекул Be2 и Ne2?
Рассмотрите с позиции метода МО возможность образования молекул В2, F2, BF. Какая из этих молекул более устойчивая?
Опишите с позиции метода МО электронное строение молекул СО и NО.
4. Как изменяются длина связи, энергия диссоциации и магнитные свойства в ряду: CО- - CО - CО+?
Занятие №11.
Химическая связь. Ионная связь.
При полном смещении межъядерной электронной плотности к атому с большей электроотрицательностью длина диполя становится равной длине связи (l = d), и атомы превращаются в положительно и отрицательно заряженные ионы, между которыми действуют силы электростатического притяжения. Такую связь называют ионной. Степень полярности или ионности связи i определяется отношением l /d и варьируется от 0 до 1, что соответствует чисто ковалентной и чисто ионной связям. В остальных случаях эта величина имеет промежуточные значения.
Ионная связь, в отличие от ковалентной, характеризуется: 1) ненаправленностью, так как сферическое поле вокруг ионов во всех направлениях равноценно; 2) ненасыщаемостью, поскольку при взаимодействии ионов не происходит полной компенсации их силовых полей; 3) координационными числами в ионных соединениях, которые определяются не электронной структурой атомов, а соотношением радиусов взаимодействующих ионов.
Соединения с ионным типом связи не имеют молекулярного строения и представляют собой твердые вещества, образующие ионные кристаллические решетки, с высокими температурами плавления и кипения.
Энергия ионной кристаллической решетки U может быть вычислена с использованием экспериментальных данных по циклу Борна - Габера.
Например вычисления U NaCl, используя следующий термохимический цикл:
Naк → Naг + ΔНсубл + 26 ккал
Naг → Naг+ + е + INa + 118 ккал
1/2Сl2,г → Сlг +1/2Есвязи + 29 ккал
Сlг + e → Сl-г - Есродства(Cl) - 89 ккал
___________________________
Naк + 1/2Сl2,г → Naг+ + Сl-г + 26 + 118 + 29 - 89 = 84 ккал.
Вместе с тем для реакции образования NaCl к в стандартном состоянии
Naк + 1/2Сl2,г → NaСlк - 98 ккал = ΔНf.
Следовательно, для процесса NaСlк → Naг+ Сl-г энергия кристаллической решетки
U = - ΔНf - Есродства(Cl) + ΔНсубл(Na) + INa + 1/2Есвязи(Cl2) = 182 ккал/моль.
Уравнение для теоретического расчета энергии ионной кристаллической решетки было получено Борном в виде
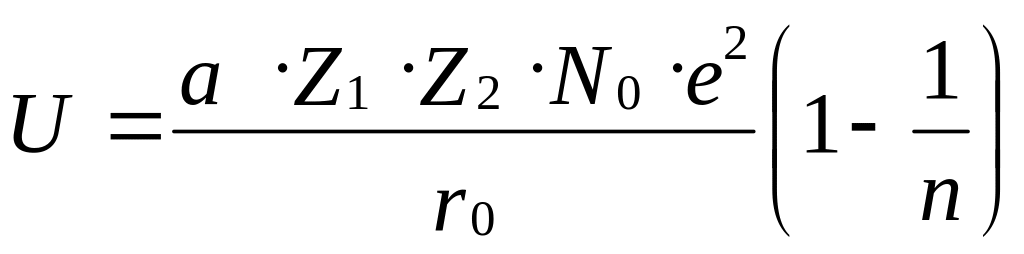 ккал/моль,
ккал/моль,
где а — константа Маделунга, вычисляемая теоретически и учитывающая взаимодействие данного иона с другими ионами, находящимися на разных расстояниях от него; N0 — число Авогадро 6,02∙1023 моль-1, Z1 и Z2 - заряды ионов, e – элементарный заряд электрона 4,8∙10-10 ед. CGSE, n – коэффициент отталкивания, зависящий от электронной конфигурации ионов. Для ионов с электронными конфигурациями He, Ne, Ar, Kr и Xe величина коэффициента отталкивания n= 5, 7, 9, 10, 12. Для кристаллической решетки типа NаСl, а =1,747. Межионное расстояние r0 заменяется суммой радиусов катиона и аниона.
Свойства ионных соединений во многом определяются взаимной поляризацией входящих в их состав ионов. Поляризация иона выражается в относительном смешении ядра и окружающих его электронов внешней электронной оболочки под действием электрического поля соседнего иона; при этом валентные электроны смещаются в сторону катионов. Подобная деформация электронной оболочки ведет к понижению степени ионности связи и к превращению ее в полярную ковалентную связь.

![]()
Поляризуемость ионов (т. е. их способность деформироваться под действием внешнего электрического поля) характеризуется следующими особенностями:
1. При одинаковом абсолютном значении заряда и равных радиусах ионов поляризуемость анионов больше поляризуемости катионов.
2. Поляризуемость ионов с аналогичным электронным строением возрастает с ростом ионного радиуса (т. е. с увеличением числа электронных слоев). Так, по возрастанию поляризуемости ионы можно расположить в следующие ряды:
F- <Cl- <Br- <I-; Li+ < Na+ <K+ <Rb+ <Cs+
3. При одном и том же заряде и одинаковом радиусе ионов поляризуемость ионов с 18-электронной оболочкой (например, Сu+, Сd2+) выше, чем ионов с благородногазовой электронной структурой (Nа+, Са2+ и т. п.).
Поляризующее действие иона (т. е. его способности деформировать, поляризовать другой ион) возрастает с увеличением заряда и уменьшением радиуса иона и значительно зависит от его электронной структуры. Ионы с благородногазовой электронной конфигурацией (например, Са2+ Ва2+) оказывают более слабое поляризующее действие, чем ионы с незавершенным электронным слоем (Тi2+, Fе2+, Рb2+ и т. п.). Наиболее сильное поляризующее действие (при одном и том же заряде иона) проявляют ионы с 18-электронной структурой внешнего слоя (Сu+, Ag+, Zn2+, Сd2+, Нg2+).
Поскольку размеры анионов, как правило, больше размеров катионов, то анионы обладают большей поляризуемостью и меньшей поляризующей способностью, чем катионы. Поэтому при взаимодействии катиона с анионом поляризации подвергается преимущественно анион; поляризацией катиона в большинстве случаев можно пренебречь.
Задачи:
1. Вычислите энергию кристаллической решетки NaF по уравнению Борна и с использованием термохимического цикла Борна – Габера. Сравнить полученные величины.
2. Вычислите по формуле Борна– Габера U(BaCl2).
3. Вычислите по циклу Борна — Габера энергию кристаллической решетки КF.
4. Вычислите с использованием цикла Борна — Габера энергию кристаллической решетки LiF.
5. Вычислите с использованием цикла Борна — Габера энергию кристаллической решетки KCl.
6. Вычислите с использованием цикла Борна — Габера энергию кристаллической решетки CaO.
7. Исходя из представлений о природе ионной связи, объясните, почему при обычных условиях ионные соединения существуют в виде ионных кристаллов, а не в виде отдельных молекул.
8. Температура плавления СаСl2 — 780 °С, СdСl2 — 560 °С; радиус иона Са2+ равен 0,104 нм, иона Сd2+ — 0,099 нм. Объясните различие температур плавления.
9. При переходе от СsF к СsI температура плавления кристаллов уменьшается. Объясните наблюдаемый ход изменения температур плавления.
10. Объясните неустойчивость гидроксидов меди(I) и серебра (I).
11. Объясните с позиции представлений о поляризации ионов меньшую устойчивость АuСl3 в сравнении с АuСl и РbСl4 в сравнении с РbСl2.
12. К2СО3 плавится при 890 °С без разложении, Аg2СО3 разлагается уже при 220 °С. Объяснить указанное различие.
13. ВаС12 в водных растворах диссоциирует полностью, а НgСl2 почти не диссоциирует. Объясните это различие в свойствах солей.
Задачи для самостоятельного решения:
1. Вычислите с использованием цикла Борна — Габера энергию кристаллической решетки CaF2.
2. Вычислите с использованием цикла Борна — Габера энергию кристаллической решетки CsF.
3. Вычислите с использованием цикла Борна — Габера энергию кристаллической решетки ZnO.
4. Какой из перечисленных ионов обладает большим поляризующим действием: а) Nа+; б) Са2+; в) Мg2+; г) А13+?
5. У какого из соединений — SrF2 или РbF2— температура плавления выше?
6. Какое из соединений — МgСО3 или ZnСО3 — термически более устойчиво?
7. Какой из ионов — Са2+ или Сd2+ — оказывает более сильное поляризующее действие на анионы?
Занятие №12.
Химическая связь в комплексных соединениях.
Электростатическая теория рассматривает образование комплексов как результат электростатического взаимодействия между ионом комплексообразователя и лигандами, которыми являются противоположно заряженные ионы или полярные молекулы (ион-дипольное взаимодействие). Сила притяжения между этими частицами и сила расталкивания между лигандами уравновешивают друг друга при определенном значении координационного числа, что соответствует наибольшей энергии связи комплекса.
Согласно методу ВС образование комплексных соединений осуществляется за счет донорно-акцепторного взаимодействия между комплексообразователем и лигандами.
Обычно центральный атом имеет свободные орбитали, а лиганды имеют неподеленные электронные пары.
В образовании такой координационной связи могут участвовать ns-, np- и nd- или (n—1)d- АО. Одновременно nd- и (n—1)d- АО связей не образуют из-за достаточной большой разницы их энергий. Комплексы, в образовании которых принимают участие nd- АО, называют внешнеорбитальными, а (n—1)d- АО — внутриорбитальными.
Гибридизация орбиталей центрального атома при образовании комплексом определяет их геометрическую конфигурацию. В соответствии с наиболее распространенными значениями координационного числа (2, 4 и 6) комплексы имеют соответственно линейную (sр), тетраэдрическую (sp3), квадратную (dsp2) и октаэдрическую (sp3d2 или d2sp3) формы.
Магнитная восприимчивость
зависит от наличия неспаренных
электронов, поэтому по экспериментально
найденным значениям магнитного момента
μ можно определите число неспаренных
электронов, пользуясь формулой
![]() ,
где n
— число неспаренных
электронов. Комплексы, при образовании
которых электронное строение и число
неспаренных электронов
комплексообразователя сохраняется,
называется высокоспиновыми. Комплексы,
при образовании которых число неспаренных
электронов комплексообразователя
уменьшается, называется низкоспиновыми.
,
где n
— число неспаренных
электронов. Комплексы, при образовании
которых электронное строение и число
неспаренных электронов
комплексообразователя сохраняется,
называется высокоспиновыми. Комплексы,
при образовании которых число неспаренных
электронов комплексообразователя
уменьшается, называется низкоспиновыми.
Правило эффективного атомного номера (ЭАН) Сиджвика указывает на тенденцию центрального атома получить за счет комплексообразования электронную конфигурацию благородного атома. Число собственных электронов нейтрального атома вместе с числом электронов, полученных им от лигандов, называют эффективным атомным номером. Согласно правилу Сиджвика ЭАН должен быть равен атомному номеру ближайшего благородного газа, что и определяет координационное число комплексообразователя. Правило Сиджвика имеет много исключений.
Теория кристаллического поля (ТКП) рассматривает взаимодействие комплексообразователя и лигандов как электростатическое, но с учетом его влияния на энергетическое состояние электронов (n – 1)d - подуровня центрального атома.
В комплексах различной геометрической конфигурации две группы орбиталей, отличающиеся разной симметрией, оказываются в неравноценном пространственном положении по отношению к лигандам, что и приводит к расщеплению энергии d-подуровня.
В октаэдрических комплексах большее отталкивающее действие со стороны лигандов испытывают орбитали dz2 и dx2-y2, вытянутые по осям координат и таким образом непосредственно направленные на лиганды, расположенные по углам октаэдра. Эту группу обозначают dγ.
Вторая группа орбиталей dxy, dxz, dzy наоборот, оказываются в более выгодном положении, находясь в пространстве между лигандами, что снижает их отталкивающее действие. Эту группу обозначают dε.
В результате энергия первой группы d-орбиталей становится выше, а второй ниже по сравнению с тем вырожденным состоянием, которое они имели бы в сферическом поле лигандов.
Разницу в энергии двух образовавшихся подуровней, т. е. Еdγ—Еdε, называют параметром расщепления Δ.

Повышение энергии двух АО компенсируется понижением энергии трех других, поэтому 2Еdγ + 3Еdε = 5Еd, а разности энергии Еdγ - Еd и Еd - Еdε, соответственно равны 3/5Δ (0,6Δ) и 2/5Δ (0,4Δ). Выигрыш в энергии при расщеплении d-подуровня называют энергией стабилизации кристаллическим полем ЕСКП или ЭСКП.
Значение параметра расщепления зависит от природы лигандов, которые по силе создаваемого ими поля располагаются в следующий спектрохимический ряд:
Лиганды слабого поля |
Лиганды средней силы |
Лиганды сильного поля |
I–, Br–, Cl–, OH–, F– |
H2O, NCS–, CH3COO–, NH3 |
СО, CN-, NO2- |
В тетраэдрических комплексах dγ и dε -подуровни по значению энергии меняются местами. Благодаря меньшему числу лигандов параметр расщепления в тетраэдрических комплексах меньше, чем в октаэдрических: ΔТ = 4/9ΔО .
Значение параметра расщепления зависит также от степени окисления комплексообразователя. Повышение степени окисления центрального атома, усиливая его взаимодействие с лигандами, увеличивает параметр расщепления.
При поглощении света возможен переход с dγ на dε уровень. Энергия этого электронного перехода может быть вычислена по соотношению E = hc/λ.
Видимый спектр имеет следующие длины волн в А:
фиолетовый |
4000—4240 |
желтый |
5750 — 5850 |
голубой |
4240—4900 |
оранжевый |
5850 — 6470 |
зеленый |
4900—5750 |
красный |
6470 — 7100 |
При поглощении веществом определенной части спектра само вещество окрашивается в дополнительный цвет.
Поглощение |
фиолетовый |
синий |
голубой |
сине-зеленый |
зеленый |
окраска вещества |
зелено-желтый |
желтый |
оранжевый |
красный |
пурпурный |
Задачи:
1. Покажите схемой распределение электронов по валентным орбиталям центрального атома в комплексах: а) [РСl6]- и [СrСl6]3-; б) [Сr(Н2О)6]3+ и [Мn(Н2О)6]2+. Какие из них являются внешне- и какие внутриорбитальными?
2. Комплекс [Fе(NН3)6]2+ в отличие от [Fе(СN)6]3- является непрочным. Объясните причину. Какой из них относится к низкоспиновым?
3. Катионы Fе2+ и Со3+ имеют в d-подуровне по шесть электронов, однако их гексааммиакаты различаются значением магнитного момента, который соответственно равен 4,6 и 0. На основании этих данных объясните, почему одни из этих комплексов значительно прочнее другого.
4. Для комплексов [CoF6]3- и [Co(CN)6]3- укажите их геометрическую конфигурацию и тип гибридизации орбиталей центрального атома. Является ли каждый из них: а) внешне- или внутриорбитальным; б) низко- или высокоспиновым; в) пара- или диамагнитным? Какой из них имеет меньшее значение энергии связи и проявляет окислительные свойства?
5. К высоко- или низкоспиновым относятся комплексы: [Fе(СN)6]4-, [Fе(Н2О)6]2+, [CoCl6]3-, [Co(NO2)6]3-? Чему должны быть равны их магнитные моменты?
6. Образуют ли d-элементы I и II групп периодической системы низкоспиновые октаэдрические комплексы?
7. Почему ион Сr3+ с любыми лигандами образует октаэдрические комплексы только внутриорбитальные и высокоспиновые?
8. Будет ли иметь окраску ион Сu2+?
9. Для комплексного иона [Сu(NН3)4]2+ полоса поглощения при 3040 А°, а для иона [Сu(Н2О)4]2+ при 3650 А°. Каковы энергии электронных переходов и как изменяется сила поля лигандов при переходе от NН3 к Н2О?
10. Какую окраску можно ожидать для соединений Мn3+ в водных растворах, если Δ = 21000 см-1 для иона [Мn(Н2О)6]3+ ? Вычислите энергию электронного перехода.
11. Покажите тип гибридизации и геометрическую форму комплексных ионов [AuСl4]- и [РСl4]-. Чему равны их магнитные моменты?
12. Сравните EСКП для комплексов [Мn(Н2О)6]2+ и [Со(Н2О)6]2+.
Задачи для самостоятельного решения:
1. Изобразить распределение электронов в октаэдрическом комплексе: [Сr(СN)6]3-, [Fе(СN)6]3-, [Fе(СN)6]4-, [Со(Н2О)6]2+, [Со(Н2О)6]3+. Укажите магнитные свойства комплексного иона
2. Почему октаэдрические комплексы Ni(II) могут быть только высокоспиновыми? Чем объясняется различие в геометрической конфигурации комплексов [Ni(NН3)4]2+ и [Ni(CN)4]2-? Какую из них имеет карбонил никеля и чем это определяется?
3. Комплекс [Со(NН3)6]2+ — высокоспиновый. Останется ли он таким же после окисления Со2+ до Со3+?
4. Для [Сr(Н2О)6]2+ Δ = 40 ккал/г-ион. Определите положение полосы поглощения и окраску иона в водном растворе.
5. Для Rh3+ Δ = 77 ккал/г-ион в водных растворах. Определите окраску [Rh(Н2О)6]3+ и положение полосы поглощения.
Занятие №13.
Контрольная работа 2.
Контрольная работа № 2 содержит задачи на следующие темы:
Периодическая система
Периодичность изменения свойств элементов и их соединений.
Химическая связь. Метод ВС.
Химическая связь. Метод МО.
Химическая связь. Ионная связь.
Химическая связь в комплексных соединениях.
При подготовке к контрольной работе рекомендуется решить все задачи из разделов для самостоятельной работы, и оценить свои знания с помощью проверочного теста.
Тест для проверки знаний:
1. Из перечисленных ниже характеристик атомов элементов периодически изменяется
(1) заряд ядра атома;
(2) относительная атомная масса;
(3) число энергетических уровней в атоме;
(4) число электронов на внешнем энергетическом уровне.
2. Внутри периода увеличение порядкового номера элемента обычно сопровождается
(1) уменьшением атомного радиуса и возрастанием электроотрицательности атома;
(2) возрастанием атомного радиуса и уменьшением электроотрицательности атома;
(3) уменьшением атомного радиуса и уменьшением электроотрицательности атома;
(4) возрастанием атомного радиуса и возрастанием электроотрицательности атома.
3. Атом какого элемента легче всего отдает один электрон (числа означают порядковый номер элемента):
(1) натрий,11; (2) магний, 12; (3) алюминий, 13; (4) кремний, 14?
4. Атомы элементов 1А группы периодической системы элементов имеют одинаковое число
(1) электронов на внешнем электронном уровне;
(2) нейтронов;
(3) всех электронов.
5. Элементы расположены в порядке возрастания электроотрицательности в ряду
(1) As, Se, Cl, F; (2) C, I, B, Si; (3) Br, P, H, Sb; (4) О, Se, Br, Te.
6. Во втором и третьем периодах периодической системы по мере уменьшения размеров атомов элементов
(1) размер их ионов также уменьшается;
(2) электроотрицательность уменьшается;
(3) металлические свойства элементов ослабевают;
(4) металлические свойства элементов усиливаются.
7. Какой ряд включает только переходные элементы:
(1) элементы 11, 14, 22, 42; (2) элементы 13, 33, 54, 83;
(3) элементы 24, 39, 74, 80; (4) элементы 19, 32, 51, 101?
8. Какой из приведенных ниже элементов имеет химические свойства, позволяющие говорить о его сходстве с элементом кальцием:
(1) углерод. С; (2) натрий, Na; (3) калий. К; (4) стронций, Sr?
9. Неметаллические свойства элементов, расположенных в главных подгруппах периодической системы Д. И. Менделеева, наиболее ярко выражены у тех из них, которые находятся
(1) в верхней части подгруппы;
(2) в нижней части подгруппы;
(3) в середине подгруппы;
(4) у всех элементов подгруппы выражены примерно в одинаковой степени.
10. Какой ряд элементов представлен в порядке возрастания атомного радиуса:
(1) О, S, Se, Те; (2) C, N, О, F; (3) Na, Mg, Al, Si; (4) I, Br, Cl, F?
11. Металлический характер свойств элементов в ряду Mg—Ca—Sr—Ba
(1) уменьшается;
(2) возрастает;
(3) не изменяется;
(4) уменьшается, а затем возрастает.
12. Неметаллический характер свойств элементов в ряду N—P—As—Sb—Bi
(1) уменьшается;
(2) возрастает;
(3) не изменяется;
(4) уменьшается, а затем возрастает.
13. Какая пара в указанной совокупности элементов — Са, Р, Si, Ag, Ni, As — обладает наиболее сходными химическими свойствами:
(1) Са, Si; (2) Ag, Ni; (3) Р, As; (4) Ni, Р?
14. По своим химическим свойствам радиоактивный элемент радий ближе всего к
(1) цезию; (2) барию; (3) лантану; (4) актинию.
15. На основании положения элемента лантана в периодической системе можно с уверенностью утверждать, что для лантаноидов наиболее характерной степенью окисления будет
(1) +1; (2) +2; (3) +3; (4) +4.
16. Основные свойства гидроксидов элементов 1А группы по мере увеличения порядкового номера
(1) уменьшаются;
(2) возрастают;
(3) остаются неизменными;
(4) уменьшаются, а затем возрастают.
17. На основе положения элементов в периодической системе наиболее вероятное соединение германия с селеном можно изобразить формулой • • • .
18. Гипотетический элемент Z образует хлорид ZCl5. Какая наиболее вероятная формула у его оксида:
(1) ZO2; (2) ZO5; (3) Z2O5; (4) Z5O2?
19. Простые вещества каких элементов обладают наибольшим сходством физических и химических свойств:
(1) Li, S; (2) Be, Cl; (3) F, Cl; (4) Li, F?
20. Из приведенных ниже элементов третьего периода наиболее ярко выраженными неметаллическими свойствами обладает
(1) алюминий; (2) кремний; (3) сера; (4) хлор.
21. Из приведенных элементов IIIA группы ярко выраженными неметаллическими свойствами обладает
(1) бор; (2) алюминий; (3) галлий; (4) индий.
22. Какой из приведенных элементов четвертого периода периодической системы проявляет одинаковые значения валентности в своем водородном соединении и в высшем оксиде:
(1) бром; (2) германий; (3) мышьяк; (4) селен?
23. Характер оксидов в ряду P2O5—SiO2—Аl2Оз—MgO изменяется следующим образом:
(1) от основного к кислотному;
(2) от кислотного к основному;
(3) от основного к амфотерному;
(4) от амфотерного к кислотному.
24. Напишите формулы высших оксидов элементов и соответствующих кислот; назовите эти кислоты:
|
Элемент
|
Оксид |
Кислота
|
Название кислоты
|
(1)
|
N |
…… |
…… |
…… |
(2) |
P |
…… |
…… |
…… |
(3)
|
As |
…… |
…… |
…… |
(4)
|
Sb |
…… |
…… |
…… |
25. На основании положения элемента в периодической системе напишите его соединения, формы которых указаны ниже:
|
Элемент
|
Оксид |
Гидрид
|
Гидроксид
|
(1)
|
Ca |
…… |
…… |
…… |
(2) |
S |
…… |
…… |
…… |
(3)
|
Li |
…… |
…… |
…… |
(4)
|
C |
…… |
…… |
…… |
26. Из приведенного перечня элементов: Be, В, С, N, Al, Si, Р, S, Ga, Ge, As, Br — оксиды типа ЭО2 образуют • • • , а гидриды типа ЭН4 — • • • .
27. На основании положения элемента в периодической системе выведите формулы его высшего оксида и гидроксида и укажите их характер:
|
Элемент
|
Оксид |
Гидроксид
|
Характер |
(1)
|
Zn |
…… |
…… |
…… |
(2) |
Ag |
…… |
…… |
…… |
(3)
|
P |
…… |
…… |
…… |
(4)
|
Sn |
…… |
…… |
…… |
28. Элемент с порядковым номером 34 образует водородное соединение • • • , высший оксид • • • и гидроксид • • • . Последний проявляет
(1) кислотные свойства;
(2) основные свойства;
(3) амфотерные свойства.
29. Максимальное число химических элементов, которое может заполнить шестой период периодической системы, должно быть равно
(1) 8; (2) 18; (3) 32; (4) 50.
30. Максимальное число элементов в седьмом периоде должно быть
(1) 18; (2) 32; (3) 50; (4) 72.
31. В седьмом периоде последним должен быть элемент с порядковым номером
(1) 118; (2) 114; (3) 112; (4) 110.
32. Свойства щелочных металлов следует ожидать у элементов с порядковыми номерами
(1) 111 и 190; (2) 119 и 169; (3) 137 и 187; (4) 155 и 211.
33. Конфигурация орбиталей валентных электронов висмута совпадает с
(1) селеном и теллуром;
(2) азотом и фосфором;
(3) кремнием и германием;
(4) ниобием и танталом.
34. Элемент с порядковым номером 117 следует отнести к
(1) щелочным метал лам; (3) галогенам;
(2) щелочноземельным металлам; (4) переходным элементам.
35. Максимальная валентность свинца в кислородных соединениях равна:
(1) II; (2) IV; (3) VI; (4) VIII.
36. Вид орбиталей валентных электронов у индия совпадает с
(1) Am и Fr; (2) Pb и Sn; (3) Аl и Ga; (4) Сu и Ag.
37. Титан относится к
(1) s-; (2) p-; (3) d-; (4) f-элементам.
38. Максимальная валентность брома в кислородных соединениях
(1) I; (2) III; (3) V; (4) VII.
39. Седьмой период системы элементов должен закончиться элементом с порядковым номером
(1) 108; (2) 110; (3) 118; (4) 128.
40. Угол между связями Н—Э наибольший в молекуле соединения
(1) Н2Те; (2) H2Se; (3) H2S; (4) H2О.
41. В ряду К—Са—Sc—Ti радиус атомов • • • (уменьшается, увеличивается).
42. Энергия, которая указана в уравнении Сl°(г.) → Cl+(г.)+e — 1254 кДж, является для атома хлора
(1) энергией химической связи;
(2) энергией ионизации;
(3) электроотрицательностью;
(4) сродством к электрону.
43. Сродством к электрону называют
(1) энергию, необходимую для отрыва электрона от невозбужденного атома;
(2) способность атома данного элемента к оттягиванию на себя электронной плотности;
(3) переход электрона на более высокий энергетический уровень;
(4) выделение энергии при присоединении электрона к атому или иону.
44. Какой из элементов имеет наибольшее значение энергии ионизации:
(1) Li; (2) F; (3) Fе; (4) I?
45. Энергия, затрачиваемая на удаление одного электрона от атома элемента в газообразном состоянии, у магния
(1) меньше, чем у натрия, и больше, чем у алюминия;
(2) больше, чем у натрия, и меньше, чем у алюминия;
(3) меньше, чем у натрия и алюминия;
(4) больше, чем у натрия и алюминия.
46. Исходя из анализа электронных структур атомов и положения элементов в периодической системе, укажите, какой из каждых двух приведенных ниже атомов имеет большее сродство к электрону:
(1) калий или кальций;
(2) сера или хлор;
(3) водород или литий?
47. Химические элементы расположены в порядке возрастания электроотрицательности в ряду
(1) Si, P, Se, Вr, Сl, О; (2) Si, P, Вr, Se, C1, О;
(3) P, Si, Вr, Se, C1, О; (4) Se, Si, P, Вr, C1, О.
48. Какой ряд элементов расположен по мере возрастания их атомных радиусов:
(1) Na, Mg, Al, Si; (3) O, S, Se, Те;
(2) С, О, N, F; (4) I, Br, C1, F?
49. В ряду щелочных металлов (от Li до Cs) цезий является наименее электроотрицательным. Это объясняется тем, что он имеет
(1) наибольшее число нейтронов в ядре;
(2) большее число валентных электронов по сравнению с другими элементами;
(3) большую атомную массу;
(4) валентные электроны, в наибольшей степени удаленные от ядра атома.
50. Изоэлектронными называют ионы, имеющие одно и то же число электронов и одинаковую структуру внешнего электронного уровня. Ионы О2-, F-, Na+, Mg2+, A13+ имеют электронную конфигурацию благородного газа неона и расположены в порядке возрастания атомных масс элементов. При этом их ионные радиусы
(1) практически не изменяются;
(2) уменьшаются;
(3) увеличиваются;
(4) уменьшаются, затем увеличиваются.
51. Примером неполярной молекулы, имеющей полярную ковалентную связь, будет
(1) N2; (2) H2О; (3) NH3; (4) CCl4.
52. Из приведенных молекул: Н2, О2, Н2О, СО2, СН4, H2S — полярными являются • • • .
53. В каком из соединений между атомами образуется ковалентная связь по донорно-акцепторному механизму:
(1) КСl; (2) NH4Cl; (3) ССl4; (4) CO2?
54. Валентные орбитали атома бериллия в молекуле гидрида бериллия • • • гибридизованы по типу
(1) sp; (2) sp2; (3) sp3; (4) d2sp3,
а молекула имеет структуру:
(а) линейную; (в) тетраэдрическую;
(б) плоскую; (г) октаэдрическую.
55. Валентные орбитали атома бора в молекуле ВF3 гибридизованы по типу
(1) sp; (2) sp2; (3) sp3; (4) d2sp3,
а молекула имеет структуру:
(а) линейную; (в) тетраэдрическую;
(б) плоскую; (г) октаэдрическую.
56. Наличие четырех эквивалентных связей С—Н в молекуле метана объясняется тем, что
(1) происходит взаимное отталкивание четырех электронных пар;
(2) атом углерода гибридизован с образованием четырех sp3орбиталей;
(3) атом углерода имеет один s- и три р- валентных электрона;
(4) атом углерода имеет два s- и два р- валентных электрона.
Ответы:
1. (4) число электронов на внешнем энергетическом уровне.
2. (1) уменьшением атомного радиуса и возрастанием электроотрицательности атома.
3. (1) натрий,11.
4. (1) электронов на внешнем электронном уровне.
5. (1) As, Se, Cl, F.
6. (3) металлические свойства элементов ослабевают.
7. (3) элементы 24, 39, 74, 80.
8. (4) стронций, Sr.
9. (1) в верхней части подгруппы.
10.(1) О, S, Se, Те.
11. (2) возрастает.
12. (1) уменьшается.
13. (3) Р, As.
14. (2) барию.
15. (3) +3.
16. (2) возрастают.
17. GeSe2.
18. (3) Z2O5.
19. (3) F, Cl.
20. (4) хлор.
21. (1) бор.
22. (2) германий.
23. (2) от кислотного к основному.
24.
|
Элемент
|
Оксид |
Кислота
|
Название кислоты
|
(1)
|
N |
N2O5 |
HNO3 |
Азотная |
(2) |
P |
P2O5 |
H3PO4 |
Фосфорная |
(3)
|
As |
As2O5 |
H3AsO4 |
Мышьяковая |
(4)
|
Sb |
Sb2O5 |
HSbO3 |
Сурьмяная |
25.
|
Элемент |
Оксид |
Гидрид |
Гидроксид |
(1)
|
Ca |
CaО |
CaН2 |
Ca(ОН)2 |
(2) |
S |
SО3 |
Н2S |
Н2SО4 |
(3)
|
Li |
Li2О |
LiН |
Li ОН |
(4)
|
C |
CО2 |
CН4 |
Н2CО3 |
26. оксиды типа ЭО2 образуют С, Si, Ge , а гидриды типа ЭН4 — С, Si, Ge.
27.
|
Элемент
|
Оксид |
Гидроксид
|
Характер |
(1)
|
Zn |
ZnО |
Zn(ОН)2 |
Основной |
(2) |
Ag |
Ag2О |
AgОН |
Основной |
(3)
|
P |
P2О5 |
Н3PО4 |
Кислотный |
(4)
|
Sn |
SnО2 |
SnО2·Н2О |
Амфотерный |
28. Н2Sе, SеО3 и Н2SeО4. (1) кислотные свойства.
29. (3) 32.
30. (2) 32.
31. (1) 118.
32. (2) 119 и 169.
33. (2) азотом и фосфором.
34. (3) галогенам.
35. (2) IV.
36. (3) Аl и Ga.
37. (3) d-элементам.
38. (4) VII.
39. (3) 118.
40. (4) H2О.
41. Уменьшается.
42. (2) энергией ионизации.
43. (4) выделение энергии при присоединении электрона к атому или иону.
44. (2) F.
45. (4) больше, чем у натрия и алюминия.
46. (1) калий; (2) хлор; (3) водород.
47. (1) Si, P, Se, Вr, Сl, О.
48. (3) O, S, Se, Те.
49. (4) валентные электроны, в наибольшей степени удаленные от ядра атома.
50. (2) уменьшаются.
51. (4) CCl4.
52. Н2О, H2S.
53. (2) NH4Cl.
54. (1) sp, (а) линейную.
55. (2) sp2, (б) плоскую.
56. (2) атом углерода гибридизован с образованием четырех sp3орбиталей.
Задания для индивидуальной расчетно-графической работы:
Для элемента с порядковым номером равным номеру варианта провести следующие расчеты:
1. Написать электронную формулу элемента и показать графически заполнение электронами всех атомных орбиталей.
2. Рассчитать энергию внешнего электрона элемента.
3. Определить массу одного атома элемента и его объем.
4. Определить массу одной молекулы простого вещества элемента.
5. Исходя из положения элемента в ПС, перечислить возможные степени окисления атома элемента в соединениях с другими элементами.
6. Написать формулу оксида, хлорида, гидрида, сульфида.
7. Рассчитать длину связи в молекулах оксида, хлорида, гидрида, сульфида, используя справочные значения ковалентных радиусов.
8. Вычислить длину диполя водородного и кислородного соединения элемента.
9. Изобразить связь в молекуле простого вещества элемента с помощью метода ВС.
10. Изобразить связь в молекуле простого вещества элемента с помощью энергетической диаграммы метода МО, указать кратность связи и написать формулу.
11. Указать тип гибридизации атома элемента в молекулах всех возможных оксидов (в случае кислорода – молекулы водородных соединений).
12. Указать все виды связей (σ, π, δ) в молекулах оксидов (в случае кислорода – молекулы водородных соединений).
13. Указать значения валентных углов в молекулах оксидов (в случае кислорода – молекулы водородных соединений).
14. Указать форму молекул оксидов (в случае кислорода – молекулы водородных соединений).
15. Вычислить энергию образования ионного соединения АВ и энергию взаимодействия ионов А+ и В-.
Для вариантов 1, 5, 6, 7, 8, 9, 14, 15, 16, 17: А – калий, В – элемент с порядковым номером, равным номеру элемента.
Для вариантов 3, 4, 11, 12, 13, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28: В – хлор, А– элемент с порядковым номером, равным номеру элемента.
Для вариантов 2, 10, 18: А – элемент с порядковым номером равным (номер варианта +1), В – элемент с порядковым элементом равным (номер варианта -1).
Литература.
