
- •Филиал в г. Северодвинске Архангельской области
- •Основные законы химии
- •Задачи:
- •18. Какие вещества называются простыми, а какие – сложными? Среди данных веществ укажите простые и сложные, напишите формулы всех веществ: железо, азотная кислота, бензол, углерод, гидразин, си-лан.
- •41. Если отсчитывать по 60 молекул в минуту, то сколько лет потре-буется для пересчёта всех молекул, содержащихся в 1 кг йода (примите один год равным 365 суток)?
- •65. Некоторый газ массой 82,8 г занимает объем 32,7 л при 286 к и давлении 104 кПа. Вычислите молярную массу газа.
- •144. Определите эквивалентную массу ортофосфорной кислоты в реакциях:
- •170. Какие из указанных газов вступают в химические реакции с растворами щелочей: hCl, h2s, nh3, ch4, so2, so3? Напишите уравне-ния реакций.
Министерство образования и науки Российской Федерации
федеральное государственное автономное образовательное учреждение
высшего профессионального образования
«Северный (Арктический) федеральный университет имени М.В. Ломоносова»
Филиал в г. Северодвинске Архангельской области
|
||||||||||||||||||||||
|
Физика и защита окружающей среды |
|
||||||||||||||||||||
|
(наименование кафедры) |
|
||||||||||||||||||||
|
|
|
||||||||||||||||||||
|
Аленевский Даниил Сергеевич |
|
||||||||||||||||||||
|
(фамилия, имя, отчество студента) |
|
||||||||||||||||||||
|
|
|
||||||||||||||||||||
|
Институт |
Севмашвтуз |
курс |
1 |
группа |
1139 |
|
|
||||||||||||||
|
|
|
||||||||||||||||||||
|
|
|
||||||||||||||||||||
|
|
|
||||||||||||||||||||
|
ИНДИВИДУАЛЬНОЕ ТВОРЧЕСКОЕ ЗАДАНИЕ |
|
||||||||||||||||||||
|
|
|
||||||||||||||||||||
|
По дисциплине |
Химия |
|
|||||||||||||||||||
|
|
|
||||||||||||||||||||
|
На тему |
Основные законы. Газовые законы |
|
|||||||||||||||||||
|
|
(наименование темы) |
|
|||||||||||||||||||
|
|
|
||||||||||||||||||||
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
||||||||||||||||||
|
Отметка о зачёте |
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
(дата) |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
||||||||||||||||||
|
Руководитель |
|
|
|
|
|
|
|||||||||||||||
|
|
|
(должность) |
|
(подпись) |
|
(инициалы, фамилия) |
|
||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
(дата) |
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
Северодвинск 2014_ |
|
||||||||||||||||||||
|
|
|
||||||||||||||||||||
Изучение газов составляло предмет пневматологии и привело в XVII и в начале XVIII в. к установлению ряда законов.
1)Закон Авагадро: одинаковые объемы различных газов при одинаковых условиях (давлении и температуре) содержат одинаковое число молекул.
Большое практическое значение имеет следствие из закона Авогадро: при нормальных условиях (н.у.) один моль любого газа занимает объем, равный 22,4 л.
Объем 22,4 л называют молярным (мольным) объемом газа и обозначают соответственно VM = 22,4 л/моль.
История: Первые количественные исследования реакций между газами принадлежат французскому ученому Гей-Люссаку. Он является автором законов о тепловом расширении газов и закона объемных отношений. Эти законы были объяснены в 1811 году итальянским физиком Амедео Авогадро.
2)Газы нередко бывают реагентами и продуктами в химических реакциях. Не всегда удается заставить их реагировать между собой при нормальных условиях. Поэтому нужно научиться определять число молей газов в условиях, отличных от нормальных.
Для этого используют Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
|
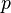 —
давление,
—
давление,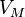 —
молярный объём,
—
молярный объём,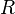 —
универсальная газовая
постоянная
—
универсальная газовая
постоянная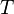 —
абсолютная температура,
К.
—
абсолютная температура,
К.Так как
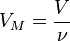 ,
где
,
где
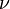 —
количество вещества,
а
—
количество вещества,
а
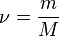 ,
где
,
где
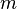 —
масса,
—
масса,
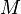 —
молярная масса,
уравнение состояния можно записать:
—
молярная масса,
уравнение состояния можно записать: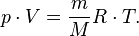
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
Уравнение, выведенное Клапейроном, содержало некую неуниверсальную газовую постоянную
 ,
значение которой необходимо было
измерять для каждого газа:
,
значение которой необходимо было
измерять для каждого газа: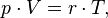
Менделеев же обнаружил, что прямо пропорциональна , коэффициент пропорциональности он назвал универсальной газовой постоянной.
(R – газовая постоянная (0,0821 л·атм/моль·K)).
3) Закон Гей-Люссака гласит: отношение объема газа к его температуре при неизменных давлении газа и его массе постоянно.
Впервые закон был опубликован в 1802 году французским физиком и химиком Жозефом Луи Гей-Люссаком.
Следует отметить, что в англоязычной литературе закон Гей-Люссака обычно называют законом Шарля и наоборот. Кроме того, законом Гей-Люссака называют также химический закон объёмных отношений.
Математически закон выражается следующим образом:
![]()
или
![]()
где
![]() —
объём газа,
—
температура.
—
объём газа,
—
температура.
Если известно состояние газа при неизменном давлении и двух разных температурах, закон может быть записан в следующей форме:
![]()
или
![]() .
.
Для реальных газов закон Гей-Люссака не выполняется в области низких температур (т. е. вблизи абсолютного нуля). При охлаждении до абсолютного нуля все, кроме гелия, газы сжижаются.
4) Закон Бо́йля — Марио́тта — один из основных газовых законов, открытый в 1662 году Робертом Бойлем и независимо переоткрытый Эдмом Мариоттом в 1676 году. Описывает поведение газа в изотермическом процессе. Закон является следствием уравнения Клапейрона[2].
При постоянных температуре и массе газа произведение давления газа на его объёмпостоянно.
В математической форме это утверждение записывается в виде формулы
![]()
где
—
давление газа;
—
объём газа, а
![]() —
постоянная в оговоренных условиях
величина. В общем случае значение
определяется
химической природой, массой и температурой
газа.
—
постоянная в оговоренных условиях
величина. В общем случае значение
определяется
химической природой, массой и температурой
газа.
Очевидно, что если индексом 1 обозначить величины, относящиеся к начальному состоянию газа, а индексом 2 — к конечному, то приведённую формулу можно записать в виде
![]() .
.
Из сказанного и приведённых формул следует вид зависимости давления газа от его объёма в изотермическом процессе:
![]()
Эта зависимость представляет собой другое, эквивалентное первому, выражение содержания закона Бойля — Мариотта . Она означает, что
Давление некоторой массы газа, находящегося при постоянной температуре, обратно пропорционально его объёму.
Тогда связь начального и конечного состояний газа, участвовавшего в изотермическом процессе, можно выразить в виде:
![]()
Важно уточнить, что данный закон справедлив только в тех случаях, когда рассматриваемый газ можно считать идеальным. В частности, с высокой точностью закон Бойля — Мариотта выполняется применительно к разреженным газам. Если же газ сильно сжат, то наблюдаются существенные отступления от этого закона.
5) Зако́н Ша́рля или второй закон Гей-Люссака — один из основных газовых законов, описывающий соотношение давления и температуры для идеального газа. Экспериментальным путем зависимость давления газа от температуры при постоянном объёме установлена в 1787 году Шарлем и уточнена Гей-Люссаком в 1802 году.
Давление газа фиксированной массы и фиксированного объёма прямо пропорционально абсолютной температуре газа.
Проще говоря, если температура газа увеличивается, то и его давление тоже увеличивается, если при этом масса и объём газа остаются неизменными.Закон имеет особенно простой математический вид, если температура измеряется по абсолютной шкале, например, в градусах Кельвина. Математически закон записывают так:
или
![]()
где:
P — давление газа,
T — температура газа (в градусах Кельвина),
k — константа..
Для сравнения того же вещества при двух различных условиях, закон можно записать в виде:
![]()
