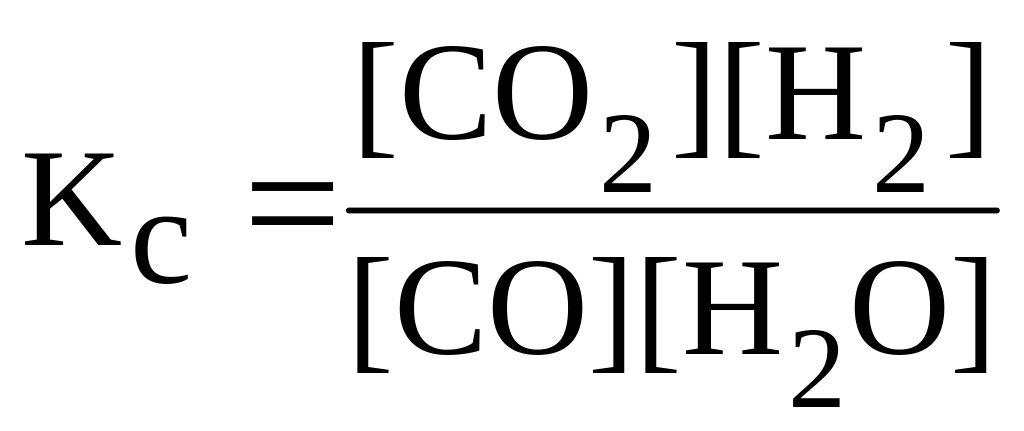Установите соответствие: цифра буква
41. Если кинетическое уравнение имеет вид |
|
то порядок реакции |
1)
2)
3)
|
|
А. нулевой Б. первый В. полуторный Г. второй Д. третий Е. определить нельзя |
42. Катализ называется |
|
если |
1) гомогенным 2) гетерогенным 3) автокатализом |
|
А. катализатор и реагенты находятся в разных фазах Б. активность катализатора усиливается промоторами В. скорость реакции возрастает по мере накопления продукта реакции Г. катализатор и продукты реакции образуют одну фазу Д. катализатор и реагенты образуют одну фазу Е. катализатор и продукты реакции находятся в разных фазах |
43. критерием состояния химического равновесия |
|
является |
1) термодинамическим 2) кинетическим |
|
А. G = 0, Gmax Б. G = 0, Gmin В. Vпр = Vобр Г. kпр = kобр |
44. Реакции являются |
|
если |
1) простыми 2) сложными 3) конкурирующими |
|
А. конечный продукт образуется в результате двух и более простых реакций (элементарных актов) Б. одно и то же вещество одновременно взаимодействует с одним или несколькими реагентами В. их протекание сопровождается фазовыми переходами Г. одна реакция вызывает протекание в системе другой реакции Д. их протекание обусловлено наличием катализатора Е. продукт образуется в результате непосредственного взаимодействия молекул реагентов |
45. Если температурный коэффициент реакции равен 2, то при |
|
скорость реакции |
1) понижении температуры на 300 2) повышении температуры на 200 3) повышении температуры на 300 |
|
А. увеличится в 4 раза Б. уменьшится в 4 В. увеличится в 8 Г. уменьшится в 8 Д. уменьшится в 16 Е. увеличится в 16 |
46. РЕАКЦИИ |
|
соответствует уравнение элементарного акта |
1) мономолекулярной 2) бимолекулярной 3) тримолекулярной |
|
А. А В + С Б. 3А + B C + 2D В. 2А + 2B В + С Г. 2А + B 3С Д. 2А + B + C 2D + E Е. А + B C + D + E |
47. Уравнение |
|
отражает зависимость |
1) закона действующих масс 2) правила Вант-Гоффа 3) Аррениуса |
|
А. скорости реакции от температуры Б. скорости реакции от массы катализатора В. скорости реакции от концентрации реагентов Г. константы скорости от концентрации веществ Д. скорости реакции от времени Е. константы скорости реакции от температуры |
48. в биохимическом процессе, протекающем в растворе по уравнению: A + B ⇄ AB, H > 0 |
|
равновесие смещается |
1) при повышении температуры 2) при понижении давления 3) при введении в систему дополнительного количества вещества А |
|
А. влево Б. вправо В. не смещается |
49. в процессе |
|
реализуется катализ |
1
уреаза
H+
2
Ni 3) CH2 =CH2(газ) + H2(газ) C2H6(газ) |
|
А. автокатализ Б. гетерогенный В. промотированный Г. ферментативный Д. комплексный Е. гомогенный |
50. Если энергия активации равна (в кДж/моль) |
|
то реакция протекает |
1) 25 2) 75 3) 140 |
|
А. очень медленно Б. с выделением теплоты В. за относительно небольшой промежуток времени Г. очень быстро Д. с поглощением теплоты Е. не протекает вообще |
51. Для реакции, протекающей по уравнению |
|
выражение для скорости прямой реакции имеет вид |
1) Н2(газ) + I2(газ) 2HI(газ) 2) С(тв) + О2(газ) СО2(газ) 3) HHb(р-р) + О2(газ) HHbО2(р-р) |
|
А.
Б.
В.
Г.
Д.
Е. |
52. Если при повышении температуры на 300 скорость реакции увеличилась в |
|
то температурный коэффициент равен |
1) 8 раз 2) 27 3) 64 |
|
А. 2 Б. 3 В. 4 Г. 8 Д. 9 Е. 16 |
53. если в газофазных равновесных системах при т = Const увеличить давление |
|
то равновесие сместится в направлении реакции |
1) H2 + I2 ⇄ 2HI 2) 2H2 + O2 ⇄ 2H2O 3) C4H10 ⇄ С2H4 + С2H6 |
|
А. прямой Б. обратной В. не сместится |
54. Выражение для константы химического равновесия обратимой реакции |
|
имеет вид |
1) 3Fe тв. + 4H2O газ ⇄ Fe3O4 тв. + 4H2 газ 2) H2 газ + Cl2 газ ⇄ 2HCl газ 3) CO2 газ + H2 газ ⇄ СO газ + H2O газ |
|
А.
Б.
В.
Г.
Д.
Е.
|
55. в биохимическом процессе, протекающем в растворе по уравнению: A + B ⇄ AB, H < 0 |
|
равновесие смещается |
1) при повышении температуры 2) при удалении из системы вещества АB 3) при введении в систему катализатора |
|
А. влево Б. вправо В. не смещается |
56. если в газофазных равновес-ных системах при т = Const увели-чить давление |
|
то равновесие сместится в направлении
|
1) H2 + I2 ⇄ 2HI 2) 2H2 + O2 ⇄ 2H2O 3) C4H10 ⇄ С2H4 + С2H6 |
|
А. прямом Б. обратном В. не сместится |
55. Если зависимость скорости реакции от концентраций реагентов имеет вид |
|
то эта реакция |
|
|
А. нулевого порядка Б. первого порядка В. мономолекулярная Г. бимолекулярная Д. второго порядка Е. дробного порядка Ж. тримолекулярная |