
- •Методическое руководство
- •Зав. Кафедрой фмд ______________ е.Г. Суровцова Одобрено Методическим советом тти нияу мифи
- •Председатель Методического совета
- •Лабораторная работа №11
- •Краткие теоретические сведения:
- •Опыт №1 химические свойства металлов
- •Опыт №2 свойства оксидов металлов
- •Опыт №3 свойства оснований
- •Опыт №4 экспериментальная задача по теме: “металлы”
- •Контрольные задания:
- •Литература
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ

ТРЕХГОРНЫЙ ТЕХНОЛОГИЧЕСКИЙ ИНСТИТУТ - филиал
Федерального государственного бюджетного образовательного учреждения
высшего профессионального образования
«Национальный исследовательский ядерный университет «МИФИ»
Кафедра физико-математических дисциплин
ОБЩИЕ ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ.
СВОЙСТВА ОКСИДОВ И ГИДРОКСИДОВ МЕТАЛЛОВ.
Методическое руководство
к лабораторной работе №11
по курсу «Химия»

Трехгорный
2011
Общие химические свойства металлов. Свойства оксидов и гидроксидов металлов: Методическое руководство к лабораторной работе №11 по курсу «Химия». Составитель: ст. преподаватель Е.Г. Суровцова – Трехгорный: ТТИ НИЯУ МИФИ, 2011. – 8 с.
Методическое руководство к лабораторной работе №11 «Общие химические свойства металлов. Свойства оксидов и гидроксидов металлов» содержит основные положения, описание опытов, порядок выполнения работы, а также контрольные задания.
Рекомендовано для студентов 1 курса дневной и вечерней форм обучения специальностей «Технология машиностроения», «Приборостроение».
Методическое руководство обсуждено и одобрено на заседании кафедры ФМД (протокол № _______от _______________2011 г.).
Зав. Кафедрой фмд ______________ е.Г. Суровцова Одобрено Методическим советом тти нияу мифи
протокол № _______от ______________2011 г.
Председатель Методического совета
____________________ Е.В. Миронова
Лабораторная работа №11
Тема: Общие химические свойства металлов.
Свойства оксидов и гидроксидов металлов.
Цель: изучить на практике химические свойства металлов, их оксидов и гидроксидов.
Оборудование: штатив с пробирками, спиртовка, держатель.
Реактивы: цинк, железо, медь, соляная кислота (НСl), дистиллированная вода, гидроксид натрия, хлорид железа (III), сульфат меди, сульфат алюминия, сульфат магния, хлорид кальция, оксид кальция, оксид меди (II), карбонат натрия, роданид аммония.
Краткие теоретические сведения:
Взаимодействие металлов с простыми веществами. Наиболее энергично восстановительные способности металлов проявляются в их реакциях с галогенами и кислородом:



 2e-
2e-
0 0 +1 -1
2Na +
Cl2![]() 2NaCl
2NaCl



 6e-
6e-
0 0 +3 -1
2Al + 3Cl2 2AlCl3


 4e-
4e-
0 0 +2 -2
2Mg + O2 2MgO

 12e-
12e-
0 0 +3 -2
4Al + 3O2 2Al2O3
Менее энергично металлы реагируют с серой:

 2e-
2e-
0 0 +1 -2
2Na + S 2Na2S

 6e-
6e-
0 0 +3 -2
2Al + 3S 2Al2S3
Еще труднее, чем с серой, металлы реагируют с неметаллами V группы – азотом и фосфором:

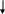 6e-
6e-
0 0 +2 -3
3Mg + N2 Mg3N2

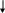 6e-
6e-
0 0 +2 -3
3Ca + 2P Ca3P2
Наиболее активные металлы главных подгрупп являются настолько сильными восстановителями, что восстанавливают даже водород до степени окисления – 1 и образуют гидриды:


 2e-
2e-
0 0 +2 -1
Ca + H2 CaH2
Взаимодействие металлов со сложными веществами. Восстановительные свойства металлы проявляют и в реакциях со сложными веществами – кислотами солями и водой.
Металлы с кислотами реагируют по-разному.
Металлы, которые в электрохимическом ряду напряжений металлов находится до водорода, восстанавливают ионы водорода в HNO3, а те, которые находятся после водорода, восстанавливают атом основного элемента, образующего данную кислоту, например:
а)
![]()
б)
![]()
0 +6 +2 +4
в) Cu
+ 2H2SO4
![]() CuSO4
+ SO2
CuSO4
+ SO2![]() + 2H2O
+ 2H2O
Пример,
![]() баланса
баланса
![]()
![]()
При взаимодействии с водными растворами солей металлы, находящиеся в электрохимическом ряду напряжений металлов левее, восстанавливают металлы, находящиеся в этом ряду правее от них.
Эта закономерность характерна для металлов как главных, так и побочных подгрупп, например:
Zn
+ Pb(NO3)2
Zn(NO3)2+Pb![]() молекулярное уравнение
молекулярное уравнение
0 0
Zn+Pb2++2NO![]() Zn+2+2NO
+Pb
ионное полное уравнение
Zn+2+2NO
+Pb
ионное полное уравнение
![]() сокращенное ионное
уравнение
сокращенное ионное
уравнение

 2e-
2e-
0 0
Zn + Pb2+ Zn2++Pb
Однако следует учесть, что металлы с сильными восстановительными свойствами (например, Li, Na, K, Ca) в этих условиях будут восстанавливать водород воды, а не металл соответствующей соли.
Самые активные металлы (от Cs до Са) реагирует с водой при обычных условиях. В этих реакциях образуются растворимые в воде основания (щелочи) и выделяется водород:
 2e-
2e-
0 +1 +1 0
2Na
+ 2HOH
2NaOH+H2![]()
2e-
0 +1 +2 0
Ca + 2HOH Ca(OH)2+H2
Менее активные металлы реагируют с водой при повышенной температуре с выделением водорода и с образованием оксида соответствующего металла:
2e-
0 +1 +2 0
1Zn + 1H2O 1ZnO+1H2

![]()
Ход работы:
