
- •О. М. Семенюк
- •Практичне заняття №1
- •Тема: Техніка безпеки при роботі в лабораторії неорганічної
- •Та органічної хімії.
- •Правила поведінки студентів у кабінеті хімії
- •І. Загальні вимоги
- •II. Вимогі безпеки перед початком роботи
- •V. Вимоги безпеки в аварійній ситуації
- •Практичне заняття №2 тема: Вивчення енергетики та спрямованості хімічних реакцій. Окисно-відновні процеси.
- •Завдання для контролю кінцевого рівня знань
- •Практичне заняття №3 тема: Вивчення властивостей речовин різних класів неорганічних сполук(оксидів, основ, кислот та солей).
- •Завдання для контролю вихідного рівня знань
- •I. Виконання дослідів
- •II. Оформлення результатів
- •III. Висновок
- •Завдання для контролю кінцевого рівня знань
- •Практичне заняття №4 тема: Розв’язування розрахункових задач за темою «Розчини» Теоретичні питання, які виносяться на практичне заняття
- •Завдання для контролю кінцевого рівня знань
- •Практичне заняття №5 тема: Теорія електролітичної дисоціації. Реакції в розчинах електролітів. Гідроліз солей.
- •Завдання для контролю вихідного рівня знань
- •I. Виконання дослідів
- •II. Оформлення результатів
- •III. Висновок
- •Завдання для контролю кінцевого рівня знань
- •Практичне заняття №6 тема: Комплексні сполуки, їх будова та номенклатура. Теоретичні питання, які виносяться на практичне заняття
- •Практичне заняття №7 тема: Вивчення властивостей галогенів.
- •Завдання для контролю вихідного рівня знань
- •I. Виконання дослідів
- •II. Оформлення результатів
- •III. Висновок
- •Завдання для контролю кінцевого рівня знань
- •Практичне заняття №8 тема: Вивчення властивостей сполук Сульфуру.
- •Завдання для контролю вихідного рівня знань
- •I. Виконання дослідів
- •II. Оформлення результатів
- •III. Висновок
- •Завдання для контролю кінцевого рівня знань
- •Практичне заняття №9 тема: Вивчення властивостей сполук Нітрогену та Фосфору.
- •Завдання для контролю вихідного рівня знань
- •I. Виконання дослідів
- •II. Оформлення результатів
- •III. Висновок
- •Завдання для контролю кінцевого рівня знань
- •Практичне заняття №10 тема: Вивчення властивостей сполук Карбону та Бору.
- •Завдання для контролю вихідного рівня знань
- •I. Виконання дослідів
- •II. Оформлення результатів
- •III. Висновок
- •Завдання для контролю кінцевого рівня знань
- •Практичне заняття №11 тема: Вивчення властивостей сполук лужних та лужноземельних металів. Сполуки Арґентуму, Цинку та Плюмбуму (іі).
- •Завдання для контролю вихідного рівня знань
- •I. Виконання дослідів
- •II. Оформлення результатів
- •III. Висновок
- •Завдання для контролю кінцевого рівня знань
- •Практичне заняття №12 тема: Вивчення властивостей сполук Мангану, Хрому та Феруму.
- •Завдання для контролю вихідного рівня знань
- •I. Виконання дослідів
- •II. Оформлення результатів
- •III. Висновок
- •Завдання для контролю кінцевого рівня знань
I. Виконання дослідів
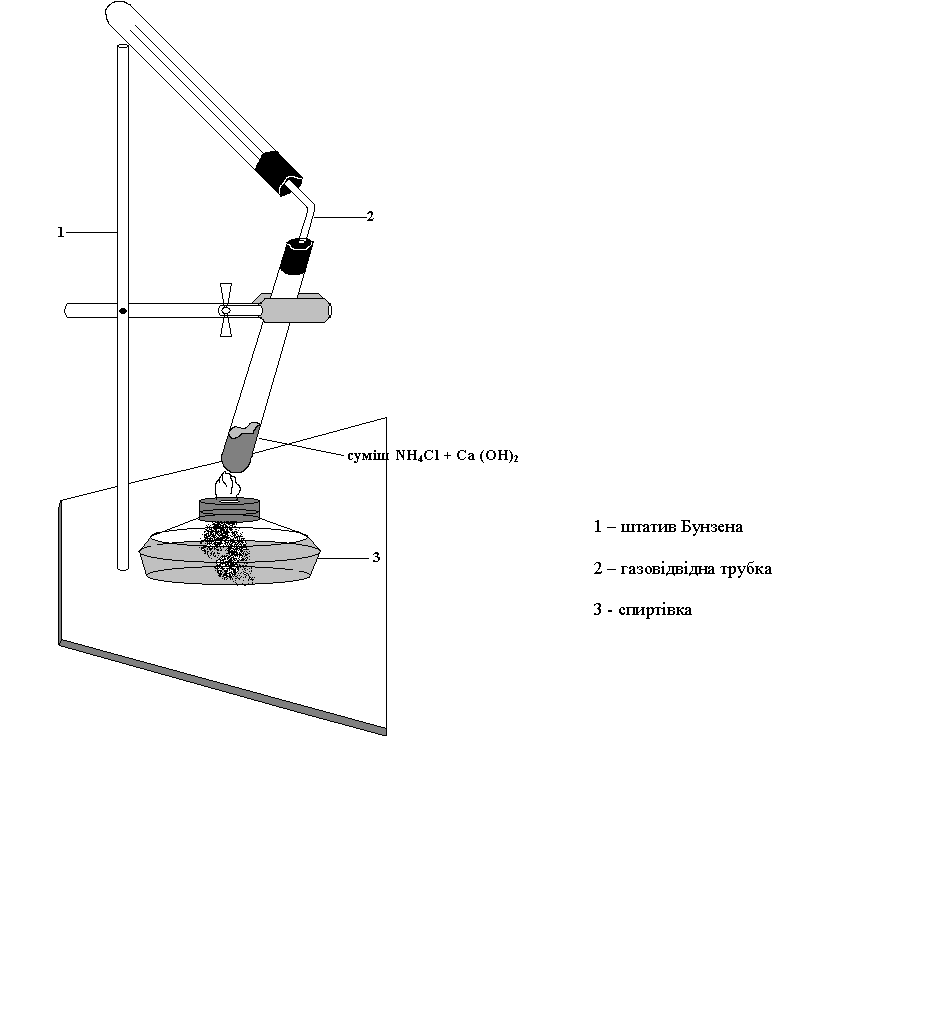
ДОСЛІД №1. Добування аміаку в лабораторних умовах.
Мета: Засвоїти лабораторні способи добування аміаку.
Складіть прилад, зображений на рис.1. На аркуш паперу або у фарфорову чашку насипте хлориду амонію та гідроксиду кальцію, взяті в приблизно рівних кількостях. Суміш перемішайте скляною паличкою та всипте в суху пробірку з газовідвідною трубкою, закріпіть її в лапці штатива похило, як показано на рисунку.
На газовідвідну трубку надіньте суху пробірку для збирання аміаку. Пробірку із сумішшю хлориду амонію та гідроксиду кальцію прогрійте спочатку всю, а потім ту її частину, де міститься суміш. Для виявлення аміаку піднесіть до отвору перевернутої пробірки вологий лакмусовий папірець.
Що спостерігаєте? Напишіть рівняння реакції.
Рис. 1
ДОСЛІД № 2. Якісні реакції на йон амонію.
Мета: Навчитися виявляти іон амонію.
з лугами
Налийте в пробірку 3 краплі розчину хлориду амонію та додати стільки ж гідроксиду натрію. Злегка нагрійте та піднесіть до її отвору вологий лакмусовий папірець.
За запахом та зміною забарвлення індикатора зробіть висновок про природу газу, що виділяється. Напишіть рівняння реакції в молекулярній та йонній формі.
з реактивом Неслера
До 1 мл розчину хлориду амонію додають 1 мл реактиву Неслера. Спостерігають за утворенням червоно-бурого осаду.
Напишіть рівняння реакції.
ДОСЛІД№3. Окиснювальні властивості нітратної кислоти.
Мета: Перевірити на досліді, як впливає концентрація нітратної кислоти на її окиснювальні властивості.
Внесіть у дві пробірки по декілька мідних дротинок. Додайте в першу 5 крапель концентрованої, в другу – розведеної нітратної кислоти. Другу пробірку слід злегка нагріти.
1. Що спостерігаєте? Запишіть рівняння реакцій. Складіть електронний баланс та на його основі розставте коефіцієнти.
ДОСЛІД№4. Одержання та гідроліз солей ортофосфатної кислоти.
Внесіть до пробірки по декілька крапель розчинів хлориду кальцію та гідрогенфосфату натрію.
Що відбувається? Запишіть рівняння реакції.
Додайте в цю ж пробірку дистильованої води та фенолфталеїну.
Чи гідролізує утворена сіль? Поясніть.
До чистої пробірки внесіть мікрошпатель кристалічного гідрогенфосфату натрію, розчиніть та перевірте дію утвореного розчину на фенолфталеїн.
3. Опишіть свої спостереження. Чому індикатор змінює забарвлення?
II. Оформлення результатів
Результати спостережень оформляють вкінці кожного досліду, відповідно до запитань.
III. Висновок
У висновку підбиваються підсумки роботи та узагальнюються результати досліджень.
Завдання для контролю кінцевого рівня знань
Напишіть рівняння реакцій розведеної нітратної кислоти з: сріблом, кальцієм та залізом. Урівняйте методом електронного балансу.
Напишіть рівняння термічного розкладу нітратів: кальцію, нікелю та меркурію (ІІ).
Речовина, в якій нітроген може бути тільки окисником:
а) HNO2 в) NН4ОН д) N2
б) NH3 г) KNO3 е) N2O3
За допомогою яких реакцій можна здійснити перетворення:
N2 → NO → NO2 → N2O3 → HNO2 → NH4NO2 → N2
Зразок сплаву міді з сріблом масою 5,36 г обробили концентрованою нітратною кислотою. Виділилось 2,688 л бурого газу. Обчисліть масові частки металів у сплаві.
