- •382 Глава 13
- •Глава 14
- •384 Глава 14
- •386 Глава 14
- •388 Глава 14
- •390 Глава 14
- •392 Глава 14
- •Если аминокислоты: триптофан, тирозин, фенилаланин и гистидин—перемещаются в менее полярное окружение, Хмакс и є возрастают. Следовательно:
- •394 Глава 14
- •Абсорбционная спектроскопия 395
- •400 Глава 14
- •402 Глава 14
- •404 Глава 14
- •406 Глава 14
- •408 Глава 14
- •410 Глава 14
- •412 Глава 14
- •414 Глава 14
- •Глава 15
раствора
белка в воде относительно раствора
белка в 20%-ном этиленгликоле, имеется
пик при 292 нм. Количество триптофана в
образце может быть определено из D2So
и егво, измеренных в Н20; а из ЛЄ292
Для свободного триптофана в воде
и в 20%-ном этиленгликоле известна
ожидаемая AD292
для образца при условии, что призошла
пертурбация всех триптофановых остатков.
Допустим, что эта величина равняется
1,00. Если же для этого белка измерить
Д-Огэг, то она будет составлять 0,6. Так
как пертурбации подвергаются только
те остатки, которые расположены на
поверхности, то их число 0,6/1,00-5 = 3. Если
известна аминокислотная последовательность
белка, с помощью простого приема можно
идентифицировать отдельные триптофановые
остатки, которые находятся на
поверхности. При обработке белка
различными окислителями, индольная
группа триптофана окисляется и
перестает поглощать. Преимущественно
будут окисляться только те триптофановые
остатки, которые находятся на поверхности;
но это необходимо проверять. Это тоже
может быть сделано с помощью метода
пертурбации растворителем и
дифференциальной спектроскопии. Если
Д1>292 = 0 после окисления, окисленные
триптофановые остатки должны быть на
поверхности. Убедившись в этом, можно
заново определить последовательность
аминокислот в окисленном белке и
отметить положение окисленных
триптофановых остатков. Следовательно,
могут быть идентифицированы отдельные
триптофановые остатки, находящиеся
на поверхности. Такого рода информация
помогает при установлении
пространственной структуры молекулы
и часто служит отправной точкой для
рентгеноструктурного анализа.
В
предыдущем примере величина AD292,
которую можно было ожидать, если бы все
триптофановые остатки находились на
поверхности, была рассчитана из
величин оптической плотности и молярного
коэффициента погашения чистого белка
в отсутствие пертурбанта. Такой расчет
невозможен, если в образце белка
содержатся поглощающие примеси. Однако
измерение можно сделать другим путем,
воспользовавшись тем, что, если белок
денатурировал, все аминокислоты
находятся в контакте с растворителем.
Следовательно, максимальное значение
AZ)292
можно определить из дифференциального
спектра денатурированного белка в
растворителе-пертурбанте против
нативного белка в полярном растворителе.
До
сих пор мы пытались отличить внешние
аминокислоты от внутренних. Однако это
различие не всегда отчетливо, поскольку
в некоторых случаях хромофор не спрятан
полностью, а находится в глубокой
полости. При этом воздействовать на
его спектр можно только в том случае,
если молекулы пертурбанта меньше
некоторого критического размера и
могут попасть в по-402 Глава 14
лость.
Этот факт также можно использовать для
получения информации о конформации
молекулы. Приведем список веществ,
которые наиболее часто применяют с
этой целью, а также их усредненные
диаметры: D20 (2,2 А), диметилсульфоксид
(4,0
А), этиленгликоль (4,3 А), глицерин (5,2 А),
арабит (6,4 А), глюкоза (7,2 А) и сахароза
(9,4 А).
Пример
14-Ж. Переход
спираль
— клубок
в белках (денатурация).
Так как в процессе денатурации спрятанный
хромофор становится доступным
растворителю, контролируя поглощение
этих хромофоров, можно наблюдать переход
спираль — клубок в белках так же, как
путем исследования гиперхромии изучали
денатурацию ДНК. Например, если в белке
содержатся трип- тофановые остатки,
часть из которых расположена внутри,
то, измеряя Дє292,
можно проследить, как в зависимости
от температуры происходит разворачивание
молекулы. Это можно, кроме того,
использовать для изучения влияния на
термическую устойчивость других
факторов, таких, например, как концентрация
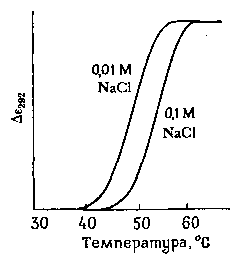
NaCl. На рис. 14-19 показаны
такого рода данные, полученные для
гипотетического белка.
Пример
14-3. Обнаружение
связывания с белками малых молекул.
Связывание субстрата с активным центром
фермента оказывает влияние на
полярность этого района или на доступность
его растворителю и часто вызывает
изменение спектров хромофоров,
находящихся в активном центре или
недалеко от него. Сравнивая наблюдаемые
изменения с изменениями, происходящими
при пертурбации растворителем, можно
получить информацию о структуре
активного центра. Например, добавление
различных субстратов к лизоциму приводит
к сдвигу Ямакс триптофана в
область больших длин волн. Величина
изменения такая, какую можно было
ожидать при перемещении одного трип-
тофанового остатка из полярного
окружения в неполярное. На основании
этого можно предположить, что триптофан
находится в месте связывания. Кроме
того, изучение лизоцима мето
РИС.
14-19.
Изучение
перехода спираль-клубок в гипотетическом
белке методом пертурбационной
дифференциальной спектроскопии в
20%-ном
водном растворе этиленгликоля,
содержащем NaCl в двух
различных концентрациях.
Измерения
ведутся при одной длине волны. Раствором
сравнения для получения дифференциального
спектра служит раствор белка в
этиленгликоле, содержащем NaCl,
при 20°С. Отметим, что этот белок более
устойчив при больших концентрациях
NaCl, так как в 0,1 М NaCl
он разворачивается при более высоких
температурах.
АБСОРБЦИОННАЯ
СПЕКТРОСКОПИЯ 403